125I粒子对胆管细胞癌HCCC-9810细胞凋亡及Livin基因表达的影响
2020-12-03杜小丽刘兆玉
杜小丽,刘兆玉,贺 倩,林 伟
人类胆管细胞癌来源于胆管上皮细胞,可发生在肝内外胆管的任何部位[1]。近几年来,胆管细胞癌是肝脏最常见恶性肿瘤,且发生率逐渐增高[2]。由于治疗方式选择的限制及大部分病例确诊时已经是中晚期,胆管细胞癌的存活率相当低[3]。放疗是胆管细胞癌非手术治疗方式之一,粒子植入治疗方式属于放疗中的一种。Schoenthaler et al[4]认为针对病理检查提示切缘阳性者,术后辅助放疗尤其是植入粒子放疗,有效缓解肿瘤痛的同时,能获得较单纯手术更好的预后。此外,Moon et al[5]进行的胆管癌体外研究发现,胆管细胞癌具有显著的放射抵抗性。Livin作为新发现的凋亡抑制基因,具有抑制肿瘤细胞凋亡的作用,可能对肿瘤细胞的放射敏感性存在着一定的影响。因此,该研究将探讨125I粒子对人胆管细胞癌HCCC-9810 细胞Livin基因的表达及细胞凋亡的影响,不仅能为胆管细胞癌细胞Livin基因功能及胆管细胞癌放射抵抗性探讨提供一些实验佐证,还可为临床胆管细胞癌治疗提供新的思路。
1 材料与方法
1.1 材料人胆管细胞癌HCCC-9810细胞购于中国协和医科大学细胞库;RPMI1640培养基、0.25%胰蛋白酶、胎牛血清购于美国Hyclone公司;Annexin V/PI双染试剂购于南京凯基生物科技发展有限公司;浓缩型DAB显色试剂盒购于北京中杉金桥生物技术有限公司;RT-PCR试剂盒购于大连TaKaRa生物工程有限公司;125I粒子购于北京同辐公司。
1.2 实验分组将对数生长期的细胞接种于25 ml培养瓶内。实验分为5组,分别为:空白对照组、空壳组、0.5 mCiGy125I粒子组、0.7 mCiGy125I粒子组、0.9 mCiGy125I粒子组。
1.3 细胞培养用含12%胎牛血清的RPMI1640培养基,在37 ℃、饱和湿度、5% CO2培养箱中培养胆管细胞癌HCCC-9810细胞。0.25%胰蛋白酶传代,选取对数生长期细胞(培养48 h后)进行实验。
1.4 流式细胞仪检测细胞凋亡率对照组及各实验组每组设5个复孔。参照文献[6]描述的方法操作。
1.5 免疫组化法检测Livin蛋白的表达对照组及各实验组每组设12个复孔。按照说明书进行,Livin的一抗浓度为1 ∶200。用Motic Images Advanced 3.2图像分析系统采集图片,测平均灰度值及平均光密度值。
1.6 RT-PCR法检测各组细胞Livin的mRNA的表达对照组及各实验组每组设24个复孔。参照文献[7]描述的方法操作,用PTC-100型PCR仪( 美国M J Research 公司 ) 进行PCR扩增和观察。
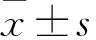
2 结果
2.1125I粒子诱导各组胆管细胞癌HCCC-9810凋亡率的变化利用流式细胞仪Annexin V/PI双染法检测细胞凋亡率的变化,见图1,结果显示:与空白对照组比较,空壳组细胞凋亡率无改变,125I粒子处理均能诱导HCCC-9810细胞凋亡率增加,差异有统计学差异(F=185.09,P<0.05),其中0.5 mCiGy125I粒子实验组细胞凋亡比例最高,0.7 mCiGy125I粒子诱导细胞凋亡率水平最低。
2.2 免疫组化检测Livin蛋白分布、表达的变化结果如图2所示:125I粒子可诱导胆管细胞癌HCCC-9810细胞中Livin蛋白含量增加,其中,0.7 mCiGy125I粒子实验组中表达量最高,差异有统计学意义 (F=98.017,P<0.05)。此外,Livin蛋白主要分布在细胞胞质中,细胞核可见少量表达。
2.3 各组HCCC-9810细胞中Livin 蛋白和mRNA的变化分别利用RT-PCR和Western blot法检测各组HCCC-9810细胞中Livin mRNA和蛋白的变化,结果如图3所示:与空白对照组比较,空壳组中Livin基因和蛋白水平无变化,但125I粒子处理可上调细胞内Livin mRNA(F=84.132,P<0.05)和蛋白(F=285.893,P<0.05)的表达,且两者的变化趋势相一致,差异有统计学意义;其中,0.7 mCiGy125I粒子组中Livin表达最多;此外,我们还发现细胞内蛋白激酶B(protein kinase B,Akt)可被125I粒子磷酸化激活,其激活水平与Livin表达相一致,提示Akt的活化可能参与胆管癌细胞内Livin的表达。

图1 125I粒子诱导胆管细胞癌HCCC-9810细胞凋亡率增加
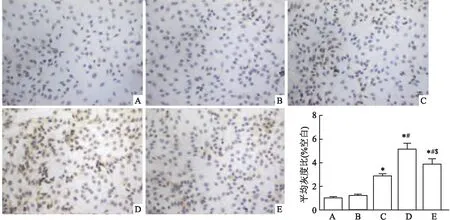
图2 125I粒子上调胆管细胞癌HCCC-9810细胞中Livin蛋白表达
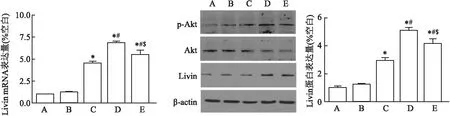
图3 125I粒子增加胆管细胞癌HCCC-9810细胞中Livin mRNA和蛋白的表达
3 讨论
胆管细胞癌由于其治疗方式选择的限制及大部分病例确诊时已经是中晚期,预后较差且存活率偏低[8]。既往介入化疗栓塞术或化疗灌注术为无法手术的进展期胆管细胞癌的主要治疗手段,但考虑胆管细胞癌多为乏血供肿瘤,介入化疗栓塞术或化疗灌注术也不能明显提高患者生存期[9]。
125I粒子治疗肿瘤的机制之一是利用其释放出的γ射线破坏肿瘤细胞的DNA双链,诱导细胞凋亡和抑制有丝分裂而杀死细胞[10]。Livin基因作为凋亡抑制因子(inhibitor of apoptosis protein,IAP)家族的成员之一,具有抑制肿瘤细胞凋亡的作用,可能对肿瘤细胞的放射敏感性产生一定的影响。已有研究[11]发现,Livin基因的表达状况与恶性肿瘤患者放射治疗及化疗疗效有一定的相关性。汤志华 等[12]通过免疫组化法检测胆管细胞癌组织及细胞中Livin蛋白的表达时发现,仅胆管细胞癌组织及胆管细胞癌细胞中表达Livin蛋白,癌旁组织及非肿瘤细胞中无Livin蛋白表达。本研究结果显示,空白对照组与空壳组中胆管细胞癌细胞内Livin基因的表达差异无统计学意义,提示空壳对胆管细胞癌Livin基因的表达影响不大,但细胞凋亡率出现轻度增加(差异无统计学意义),这可能与空壳钛金属材质改变了细胞生长微环境所致有关。然而,3组125I粒子实验组中的细胞凋亡率均显著高于空白对照组(P<0.05),可能与置入125I粒子后改变细胞生长微环境及125I粒子释放出γ射线诱导细胞凋亡有关;同时,3组中Livin蛋白表达水平均较空白对照组及空壳组增加,表明胆管细胞癌具有一定的放射抵抗性,进一步佐证了Moon et al[5]的研究结果。
本研究还发现,125I粒子诱导HCCC-9810细胞内Livin表达和125I粒子诱导HCCC-9810细胞凋亡呈现明显的负相关,即Livin表达越高,细胞凋亡发生率越低,0.7 mCiGy125I粒子诱导HCCC-9810细胞Livin基因表达的能力最强。考虑到Livin作为重要的凋亡抑制基因,在各种恶性肿瘤中特异性高表达,如肺癌、黑色素瘤等[13-14],已有学者认为其可作为抗肿瘤治疗的重要靶点[15]。但目前仅有少数体外细胞学研究证实胆管细胞癌中Livin的存在,考虑体内外分子调控环境差异,现有相关研究尚存在一定的欠缺,故亟需建立胆管细胞癌动物模型以进一步论证上述结论。
综上所述,本研究发现125I粒子可诱导胆管细胞癌细胞凋亡及Livin基因的表达,同时也从基因和蛋白进一步验证胆管细胞癌放射抵抗性可能与Livin的表达水平有一定的相关性,提示Livin可作为胆管细胞癌放射抵抗性的判断标志物及治疗靶点。
