茎瘤芥BXL基因家族的全基因组鉴定及在瘤状茎膨大过程中的表达分析
2020-12-02赖彪陈春帆刘春渝朱纯真杜丽娜
赖彪,陈春帆,刘春渝,朱纯真,杜丽娜
长江师范学院现代农业与生物工程学院,重庆 408100
木聚糖是双子叶植物次生壁中主要的半纤维素成分,是由β-1,4木糖苷键连接D-木糖残基为主链的复杂分子多聚糖。木聚糖的水解在一系列酶的作用下完成,其中,内切β-1,4-木糖酶(β-1,4-endoxylanase,EC 3.2.1.8)和β-D-木糖苷酶(β-D-xylosidase,BXL,EC 3.2.1.37)是水解木聚糖主链的关键酶。不溶性的木聚糖首先由内切木糖酶催化水解为较短的可溶性的低聚木糖,然后由BXL从非还原性末端进一步水解为木糖[1-2]。BXL是木聚糖完全降解的关键酶,已广泛应用于食品、能源、造纸等行业[3-5]。目前,国内外对BXL的研究主要集中在细菌和真菌等微生物,对植物中BXL的研究较少[1-2]。目前已从小麦粉[1]、大麦幼苗[6]、拟南芥的茎[7]等植物材料中分离得到BXL。多数植物BXL属于第3族糖苷水解酶(family 3 of glycoside hydrolases,GH3)[6-8]。BXL的氨基酸序列具有GH3家族保守的N-端和C-端催化域,其中含有可能参与底物结合的WGR和KH基序[7-9]。BXL催化低聚木糖水解的过程是一种酸碱催化反应,在其活性位点上有2个关键催化氨基酸残基:亲核催化的天冬氨酸(Asp)和酸碱催化谷氨酸(Glu)[6-7,10]。
目前关于BXL家族基因在植物上的功能研究还很少。在模式植物拟南芥上AtBXL1的下调表达导致细胞壁组分改变,且果荚变小和种子变少,可能参与了细胞壁半纤维素代谢和植物发育,此外,AtBXL1还受到黑暗和糖饥饿处理的诱导[11-13]。有研究对杨树(Populustrichocarpa)BXL家族基因进行了全基因组鉴定和表达分析,并发现氮处理可诱导3个PtBXL基因在上部茎干中的表达[14]。此外,在梨(Pyruspyrifolia)[15]、草莓(Fragariaananassa)[16-17]和桃(Prunuspersica)[18]果实上的研究表明BXL可能参与果实成熟过程中的质地变化。
茎用芥菜属于十字花科芸薹属芥菜种的变种,包括茎瘤芥(Brassicajunceavar.tumidaTsen et Lee)、笋子芥(B.junceavar.carassicaulis)和抱子芥(B.junceavar.gemmifera)[19]。芥菜是由二倍体B.rapa(AA)和B.nigra(BB)杂交后经自然的染色体加倍而形成的异源四倍体(AABB)物种[20]。茎瘤芥的瘤状膨大的茎是其收获器官,可鲜食,亦是加工腌制榨菜的优异原料。茎瘤芥在发育过程中瘤状茎的膨大与光周期和温度等外界环境条件和激素水平如生长素、赤霉素和细胞分裂素相关[21-22]。茎瘤芥发育过程中茎的膨大是由细胞增殖、细胞膨大和分化这些基本细胞活动参与的复杂的过程[23]。研究表明,细胞壁代谢相关的多聚半乳糖醛酸酶(PG)和木葡聚糖内转糖苷酶/水解酶(XTH)在瘤状茎膨大过程中基因表达显著提高,可能在茎瘤芥茎膨大中发挥着重要的作用[24-25]。
目前茎瘤芥基因组测序已完成,为从基因组水平研究茎瘤芥提供了重要基础[20]。本研究利用生物信息学技术,筛选茎瘤芥BjuBXL家族基因并进行生物信息学分析,并通过实时荧光定量技术对茎瘤芥BjuBXL1-1/2基因在瘤状茎不同组织、发育阶段和部位的表达进行分析,旨在为研究BjuBXL在茎瘤芥发育中的功能提供基础,并为茎瘤芥品质改良提供候选基因。
1 材料与方法
1.1 试验材料
用于实时荧光定量PCR检测的茎瘤芥样品采自‘永安小叶’品种,9月中旬播种育苗,1个月后移植,种植于重庆涪陵区长江师范学院校内实验基地,采用正常的水肥管理。为研究BjuBXL1-1和BjuBXL1-2基因在瘤状茎不同发育阶段和茎不同部位的表达,在茎瘤芥的瘤状茎膨大过程中于瘤状茎直径2、4、6、8和10 cm五个发育阶段取样,分别标记为D1~D5。D1阶段取整个茎,D2~D4阶段时取瘤状茎最大横切面1 cm厚度的茎组织,并从表皮到内髓等距分为2个部分取样,分别标记为D2/D3/D4-P1和D2/D3/D4-P2。D5阶段时取瘤状茎最大横切面1 cm厚度的茎组织,并从外层到内髓等距分为4个部分取样,分别标记为D5-P1~D5-P4。并取其他组织样品包括:根、叶(成熟叶)、花、茎组织(D4-P2)。取样后迅速放入液氮中,置于-80 ℃冰箱保存。
1.2 茎瘤芥BjuBXL基因家族成员的鉴定
首先,参照文献[11],确定拟南芥中BXL基因家族成员,利用拟南芥信息资源网(TAIR,http://www.arabidopsis.org)提取拟南芥中的7个BXL家族基因的蛋白序列,利用Blastp软件对其在已经发布的茎瘤芥基因组中进行比对[20],筛选出与拟南芥同源性高的BXL序列,并逐一进行序列分析和验证,最终获得茎瘤芥BjuBXL基因家族成员候选基因。
1.3 茎瘤芥BjuBXL基因家族成员的基本特性分析
利用在线软件ExPASy(ExPASy,http://www. expasy.org/tools/)预测茎瘤芥BjuBXL家族成员蛋白的分子质量、等电点和亲疏水性。利用在线软件PSORTⅡ(https://www.genscript.com/psort.html)对蛋白进行亚细胞定位预测。
1.4 多重序列比对和构建系统进化树
利用Clustal X和Gendoc软件将茎瘤芥BjuBXL氨基酸序列进行多重序列比对分析。利用Clustal X和MEGA 5.0软件,通过邻接法(Bootstrap设定为1 000)构建茎瘤芥和拟南芥BXL系统进化树。
1.5 茎瘤芥BjuBXL基因家族的基因结构、保守基序和染色体定位分析
使用软件TBtools软件,根据已经发布的茎瘤芥基因组注释数据[20],分析BjuBXL家族成员的的外显子-内含子结构和染色体定位信息[26]。应用MEME(http://meme-suite.org/tools/meme)[27]预测茎瘤芥BXL的保守基序,并利用TBtools软件对Motif元件作图。
1.6 茎瘤芥BjuBXL在不同发育阶段茎的转录组中的表达分析
下载已发布的茎瘤芥不同发育阶段茎的转录组数据(SRP151320),该数据库使用的材料为‘涪杂2号’茎瘤芥4个不同膨大阶段的茎组织(Stage 1~Stage 4直径分别为2、4、6和8 cm),共3个生物重复[28]。通过该转录组数据库分析茎瘤芥BjuBXL家族成员在不同发育阶段茎中的表达模式。
1.7 实时荧光定量PCR
实时荧光定量PCR在ABI QuantStudio 3 Real-Time PCR System上进行,以茎瘤芥TUB基因为内参[24],运用2-ΔΔCT法进行数据分析[29]。使用的引物如下:BjuBXL1-1-F:GAAGGGATTGTTGACGGAGT,BjuBXL1-1-R:GCCCAAGATTAGCATACGG;BjuBXL1-2-F:CCGAACACTCCGTTTCTGTC,BjuBXL1-2-R:CCACTCGTAGCCTCCAATACC;BjuTUB-F:GCGTCTTGTCCGTGAGATTGC,BjuTUB-R:GCCGAGATGAGGTGGTTAAGGT。
2 结果与分析
2.1 茎瘤芥BjuBXL基因家族鉴定及序列分析
为鉴定茎瘤芥中BjuBXL基因家族,利用Blastp软件将拟南芥BXL家族基因(AtBXL1-7)的氨基酸序列在茎瘤芥基因组数据库中搜索,共筛选到16个BjuBXL家族成员。将茎瘤芥BjuBXL家族成员与拟南芥AtBXL1~7进行系统进化分析,根据其与拟南芥中AtBXL的同源关系进行排序命名(图1A),与AtBXL1聚类的有4个(BjuBXL1-1~BjuBXL1-4),与AtBXL2聚类的有1个(BjuBXL2),与AtBXL3聚类的有4个(BjuBXL3-1~BjuBXL3-4),与AtBXL4聚类的有2个(BjuBXL4-1和4-2),与AtBXL5聚类的有1个(BjuBXL5),与AtBXL6聚类的有2个(BjuBXL6-1和6-2),与AtBXL7聚类也有2个(BjuBXL7-1和7-2)。BXL家族基因分为2个亚类,亚类1包括:BXL1~5,亚类2包括BXL6和BXL7。

方框内为WGR和KH保守位点,实心三角形为推测的亲核催化氨基酸残基位点(Asp)和酸碱催化氨基酸残基位点(Glu),空心三角形为推测的酸碱催化氨基酸残基替代位点(Glu)。The redboxes indicate conserved WGR and KH motifs. Solid triangles represent the putative catalytic nucleophile (Asp) and putative catalytic acid/base (Glu). Hollow triangles represent the putative alternative catalytic acid/base residue (Glu).
16个BjuBXL蛋白序列比对分析显示(图1B),它们均含有WGR和这2个参与底物结合的保守位点,此外,它们还均包含木糖水解酶2个保守的活性位点氨基酸残基即亲核催化氨基酸残基Asp和2个候选的酸碱催化氨基酸残基Glu[6-7,9]。
茎瘤芥中BjuBXL家族基因理化性质分析(表1)显示,BjuBXL家族基因的推测蛋白最短为769个氨基酸(BjuBXL7-1,BjuA027714),最长为984个氨基酸(BjuBXL5,BjuB025113);分子质量为83.37~109.32 ku;等电点介于5.44~9.01,其中有12个BjuBXL蛋白的等电点大于7,偏碱性。亲疏水性均值(GRAVY)为-0.273~-0.049,均小于0,表明BjuBXL均为亲水性蛋白;亚细胞定位预测结果显示,7个定位于线粒体,6个定位于内质网,2个定位于细胞外,1个定位于高尔基体。
2.2 茎瘤芥BXL家族基因的结构和保守基序分析
对BjuBXL的基因结构进行比较分析,结果表明,BjuBXL家族基因所含外显子和内含子数量差异较大。亚类1(BXL1~5)的外显子数量较多,为5~11个,其中,BjuBXL2外显子数量最多,为11个;而亚类2(BXL6和BXL7)中外显子数量较少,为3~5个(图2)。
利用MEME在线网站分析BjuBXL的Motif元件及保守序列(图2),结果显示:所有的BjuBXL的氨基酸序列均含有10个保守的Motif元件。保守位点WGR和KH分别位于Motif 2和Motif 1,亲核催化氨基酸位点(Asp)和酸碱催化氨基酸位点(Glu)分别位于Motif 4和Motif 7。
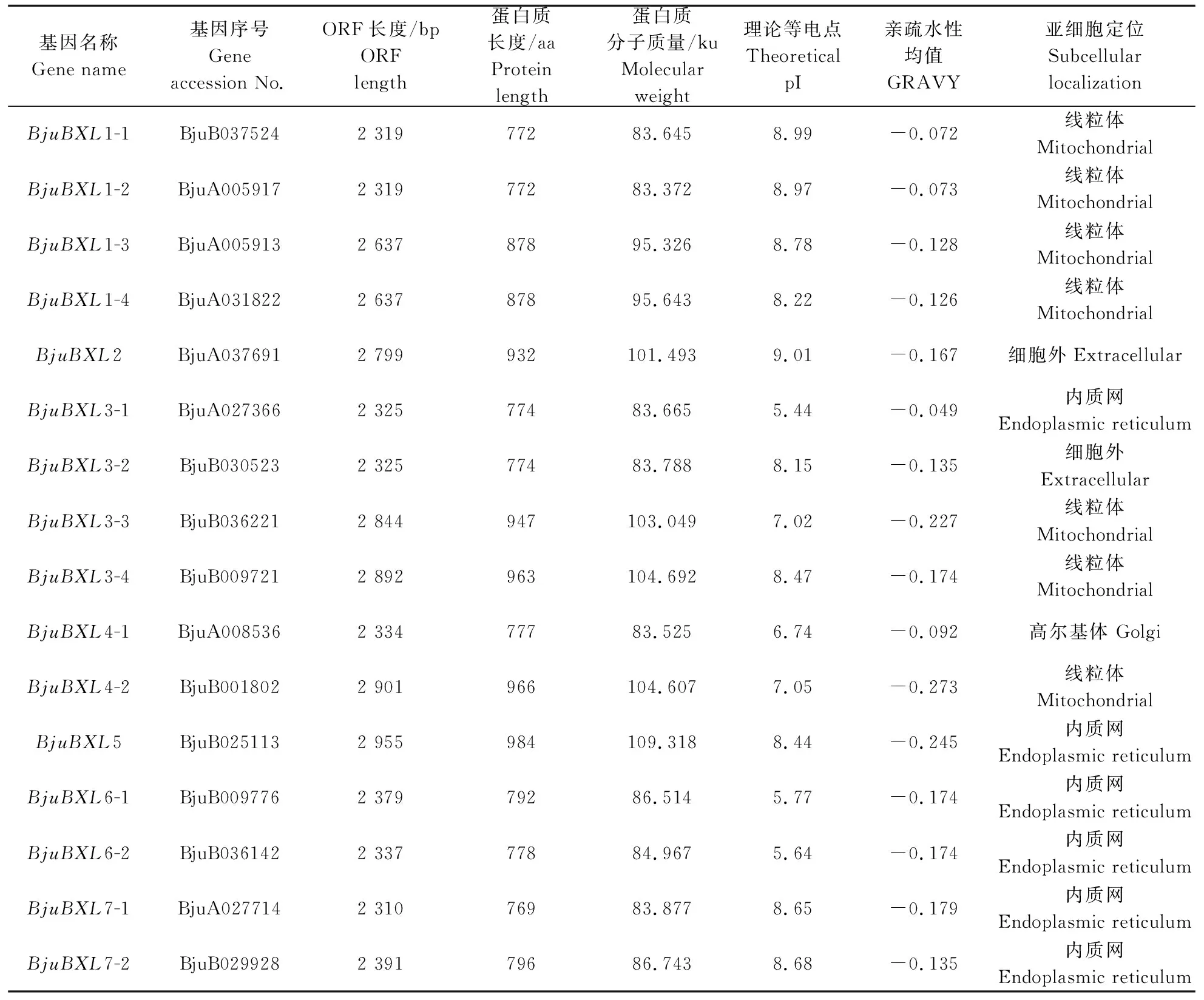
表1 茎瘤芥BXL基因家族蛋白理化性质 Table 1 The physicochemical properties of protein of BXL gene family in Brassica juncea var. tumida
2.3 茎瘤芥BXL基因家族的染色体定位分析
茎瘤芥基因组包括A(J01-J10)和B(J11-J18)2个亚基因组,共18条染色体[20]。利用基因组信息分析了16个BjuBXL家族成员在染色体上的定位(图3)。结果显示:15个BjuBXL分别定位于9条染色体上,其中有7个定位于A亚基因组,包括BjuBXL1-2和BjuBXL1-3在J01号染色体上,BjuBXL4-1在J02号染色体上,BjuBXL3-1和BjuBXL7-1在J07号染色体上,BjuBXL1-4在J09号染色体上和BjuBXL2在J09号染色体上;有8个定位于B亚基因组,BjuBXL3-4和BjuBXL6-1在J12号染色体上,BjuBXL5在J15号染色体上,BjuBXL7-2和BjuBXL3-2在J17号染色体上,BjuBXL6-2、BjuBXL3-3和BjuBXL1-1在J18号染色体上;而BjuBXL4-2定位于未组装到染色体上的Scaffold00153。

图2 BjuBXL基因家族基因结构和保守位点分析
2.4 茎瘤芥BXL基因家族的表达分析
利用公开的茎瘤芥不同发育阶段茎的转录组数据库[28],分析16个BjuBXL在瘤状茎膨大过程中的表达情况(图4)。结果显示:16个BjuBXL的表达聚为两大类,聚类1包括7个BjuBXL,它们在瘤状茎膨大过程中表达水平较低且变化不明显;聚类2包括9个BjuBXL,它们在瘤状茎膨大过程中表达水平有较大变化,其中BjuBXL1-1和BjuBXL1-2在瘤状茎膨大过程中明显上调,这表明BjuBXL1-1和BjuBXL1-2可能参与茎瘤芥瘤状茎的膨大。
2.5 茎瘤芥BjuBXL1-1和BjuBXL1-2的表达分析
利用荧光定量PCR对BjuBXL1-1和BjuBXL1-2在茎瘤芥不同组织、茎的不同发育阶段和不同部位的表达进行了分析(图5)。组织表达结果显示(图5A),BjuBXL1-1和BjuBXL1-2的组织表达模式相似,在根、叶、花、果荚和膨大的茎中均有表达,其中在花和

图3 BjuBXL基因家族染色体定位分析

图4 BjuBXL基因家族在茎瘤芥不同发育阶段瘤状茎转录组中的表达热图
膨大的茎中表达水平较高,在果荚中表达水平最低。BjuBXL1-1和BjuBXL1-2在茎的不同发育阶段的表达显示,随着瘤状茎的膨大,BjuBXL1-1和BjuBXL1-2的表达均显著上调,尤其从D3(直径为6 cm)阶段开始显著增加,D5阶段达到最高。在同一发育阶段茎的不同部位中的表达比较发现,BjuBXL1-1和BjuBXL1-2的表达模式也一致,在茎内髓区的表达均显著高于外髓区(P1),例如:BjuBXL1-1和BjuBXL1-2在D3-P2中的表达分别是D3-P1中的5.64倍和5.39倍,在D5-P4中的表达分别是D5-P1的2.89倍和5.02倍,这表明BjuBXL1-1和BjuBXL1-2功能可能一致,参与茎瘤芥瘤状茎膨大过程中茎的内髓区的细胞代谢。
3 讨 论
我国茎瘤芥的生产主要集中在重庆、四川和浙江等省市,其中重庆是我国茎瘤芥的核心种植区和主要加工区域,2016年种植面积达10万hm2以上,总产量280万t,茎瘤芥产业是重庆市提高农民收入和助推扶贫攻坚的重要产业之一[30]。茎瘤芥在生长发育过程中易出现空心、先期抽薹等现象,从而影响了其产量和品质。因此,研究茎瘤芥的发育具有重要的意义。
半纤维素是植物细胞壁中的主要成分之一。BXL负责将低聚木糖和木二糖水解为木糖单体,是细胞壁半纤维素降解的关键限速酶[2]。目前,关于BXL的研究主要在微生物上,除了模式植物拟南芥和杨树外,很少对BXL基因家族有所研究。本研究利用生物信息学分析方法从茎瘤芥基因组数据库中共鉴定到16个BjuBXL基因并分析了它们在茎膨大过程中的表达。

柱子上方不同小写字母表示差异显著(P<0.05)。Different lowercase letters above the pillars indicate significant difference (P<0.05).
本研究通过对拟南芥BXL家族基因在茎瘤芥基因组中进行BLAST分析,发现拟南芥中AtBXL1~7在茎瘤芥中均有1~4个相应的同源基因,通过系统进化分析把BjuBXL归为7类(BXL1-7),2个亚族(图1)。Chen等[14]从杨树中鉴定了10个PtBXL家族基因也归为2个亚族,本研究结果与之一致。序列比对和保守基序分析发现16个BjuBXL在Motif 2和Motif 1上分别含有WGR和KH保守位点。在拟南芥中的研究表明该保守位点参与底物的结合[7]。茎瘤芥属于异源四倍体(AABB),分为A和B两个亚基因组,共18条染色体[20]。本研究染色体定位预测发现有7个BjuBXL定位于A亚基因组中的5条染色体上,8个BjuBXL定位于B亚基因组的4条染色体上。BjuBXL1和BjuBXL3均有4个同源基因,BjuBXL1有3个同源基因定位于A亚基因组的J01和J09染色体上,另一个同源基因定位于B亚基因组的J18染色体上;BjuBXL3有1个同源基因定位于A亚基因组的J07染色体上,其他3个同源基因分别定位于B亚基因组的J12、J17和J18染色体上。
研究表明,拟南芥中AtBXL1主要在茎组织中表达[31]。本研究中组织表达分析显示BjuBXL1表达水平最高的组织是花和膨大的茎组织。茎瘤芥发育过程中茎的快速膨大与果实成熟过程中的膨大有一定的相似性。有研究表明BXL参与果实质地变化,例如:在日本梨中β-D-木糖苷酶基因PRXYL在果实成熟和采后衰老过程中积累[15];草莓β-D-木糖苷酶(FaXyl1)基因在果实成熟软化过程中表达量高并具有较高β-木糖苷酶活性,且其表达受各种植物激素的调控[16-17];桃PpXyl的表达与果实冷害症状的絮败指标呈负相关[18]。茎瘤芥在茎的膨大过程中进行着复杂的细胞增殖、细胞膨大和分化等细胞活动,因此,茎的膨大与细胞壁代谢相关酶密切相关[32]。转录组数据显示茎瘤芥中BjuBXL1的2个同源基因BjuBXL1-1和BjuBXL1-2在茎膨大过程中明显上调。qRT-PCR进一步验证了BjuBXL1-1和BjuBXL1-2的表达,并发现它们在茎瘤芥膨大茎的不同部位有显著差异,表现为从外层到内髓(P1~P4)其表达显著上调,这表明BjuBXL1-1和BjuBXL1-2主要参与茎瘤芥茎膨大过程中茎内髓区组织细胞壁的代谢。有研究对茎瘤芥发育过程中瘤状茎细胞分裂和核内再复制发生的时空变化进行了分析,结果表明茎瘤芥茎膨大过程中茎的外层细胞主要进行细胞增殖,而内髓区细胞通过核内再复制而增大,而且发现细胞壁重构酶基因BjXTH1和BjXTH2在核内的复制细胞中专一地表达[23]。BjuBXL1-1和BjuBXL1-2在膨大茎的内髓区的表达水平最高,可能与内髓区细胞增大过程中细胞的代谢相关。本研究所使用的‘永安小叶’茎瘤芥品种的口感好,但在茎膨大过程中,茎的髓部容易出现空心现象从而影响其商品价值。BjuBXL1-1和BjuBXL1-2在茎快速膨大过程中在中心髓部的表达显著升高是否与内髓区域的空心的发生相关,也值得进一步研究。
综上,本研究从茎瘤芥中鉴定了16个BXL基因,其中BjuBXL1-1和BjuBXL1-2基因在茎瘤芥的茎膨大过程中可能具有重要功能,可为进一步研究BXL在茎瘤芥发育中的作用提供科学依据。
