猕猴桃采后软腐病病原菌鉴定及香芹酚对其控制效果
2020-12-02左盼盼付苏彭丽桃范刚杨书珍李杰
左盼盼,付苏,彭丽桃,范刚,杨书珍,李杰
华中农业大学食品科技学院,武汉 430070
猕猴桃(Actinidiachinensis)又名藤梨、奇异果,因其富含维生素C、维生素E、叶酸等营养成分,热量低,营养价值高,味道酸甜可口,深受消费者的喜爱[1]。猕猴桃作为我国新兴的经济林树种之一,近年来得到了快速发展,我国已经成世界上猕猴桃优势主产国,其产量和种植面积均位居世界第一[2]。但由于猕猴桃果实皮薄汁多、营养丰富,在果实贮运和销售过程中极易遭受病原微生物侵染而腐烂变质,给生产带来巨大损失。其中,猕猴桃软腐病是猕猴桃采后贮运和销售过程中危害最为严重的真菌病害,在陕西、贵州等主产区的发病率高达20%~50%,严重制约了猕猴桃产业的健康发展[3]。猕猴桃软腐病菌在幼果期侵染果实后长期潜伏在果实组织中,至成熟期发病,尤其在贮藏后期、销售和消费过程中发病严重。猕猴桃软腐病的病原菌多属内生菌,很难从果实外部判断病害发生;同时,引起猕猴桃软腐病的病原菌种类多,且病菌类型和致病力易受宿主生长地域、气候条件和品种抗性等因素影响,发病情况复杂,以上因素均为猕猴桃软腐病的防控带来很大困难[4]。但目前有关猕猴桃软腐病的病原菌鉴定和病害控制方面的研究报道相对较少,且存在一定争议。因此,研究猕猴桃采后软腐病的病原菌种类及其控制措施对于猕猴桃产业的健康发展具有重要意义。
精油是从植物中提取的一种次生代谢物质,具有强烈芳香性的挥发性油状混合物,目前已经发现的植物精油超过3 000种,其中约1 340种植物精油具有抗菌活性,是开发新型安全抗菌剂的优质资源[5]。香芹酚(2-甲基-5-异丙基苯酚)又称香荆芥酚,是香芹、牛至和百里香的主要活性成分,由于安全性好,在美国已被批准为“GRAS”类别的天然香料[6]。研究发现香芹酚具有抗癌、抗氧化、抗菌等多种生物活性,不仅对肠道沙门氏菌、大肠杆菌、蜡样芽孢杆菌、金黄色葡萄球菌等细菌具有显著的抑制效果[7],对青霉菌、匍茎根霉菌、灰霉菌和曲霉菌也表现出良好的抑菌作用,在食品防腐保鲜领域展现出良好的应用前景[8-9],但有关香芹酚在猕猴桃采后软腐病的控制效果方面的研究鲜见报道。本研究从发病猕猴桃果实中分离、鉴定软腐病的主要致病菌,并在此基础上测定离体条件下和模拟商业销售环境中香芹酚对猕猴桃软腐病菌的控制效果,以期为探究猕猴桃采后软腐病的发病规律和绿色防控提供参考。
1 材料与方法
1.1 材料与试剂
发病猕猴桃果实分别采集于湖北省襄阳市谷城县万丰园猕猴桃基地、陕西周至县猕猴桃基地及华中农业大学周边超市。用于模拟销售贮藏实验的猕猴桃采自周至县猕猴桃基地,品种为“徐香”。培养基为马铃薯葡萄糖琼脂(PDA)培养基;2×TaqPCR Master Mix购自天一辉远生物科技有限公司。香芹酚购自上海麦克林生化科技有限公司;所用其他试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 病原菌分离与纯化
采用组织分离法[10]对致病真菌进行分离,具体步骤如下:用水清洗猕猴桃病果表面,用灭菌解剖刀切取病健交接处组织,将组织小块在75%乙醇中浸泡5 s,无菌水清洗3次,最后接在PDA培养基上,于26 ℃恒温条件下倒置培养,当菌落直径为1 cm时,挑取菌落边缘菌丝转接到新的PDA 培养基内于26 ℃恒温条件下倒置培养,经3~5次划线分离,直至获得纯病原菌菌落,4 ℃冰箱保存。
1.3 致病性测定
根据柯赫氏法则进行致病性测定:挑选健康、无损伤的“徐香”猕猴桃果实,用75%乙醇溶液表面消毒,取菌落边缘的菌饼(直径为 5 mm),采用针刺法将菌饼接种于伤口处。以接种无菌的PDA 培养基作为对照,于26 ℃ 恒温培养,记录发病情况并釆用十字交叉法测量病斑直径。发病后于病斑处再次分离培养病原菌,并与原接种菌株进行对比,形态学鉴定一致则确定为该病原菌。
1.4 病原菌鉴定
1)形态学鉴定。根据各致病菌株在PDA上的菌落特征、光学显微镜下菌丝形态、分生孢子及分生孢子梗的形状、色泽、菌丝隔膜等性状进行初步鉴定。
2)分子生物学鉴定。参照Edwards等[11]的CTAB法提取菌株DNA。真菌rDNA -ITS区的通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS2(5′-TCCTCCGCTTATTGATATGC-3′)作为PCR扩增引物。引物扩增体系为:15 μL 2×TaqPCR Master Mix,1 μL DNA,1 μL 10 mmol/L上游引物与1 μL 10 mmol/L下游引物,12 μL超纯水。PCR循环条件为95 ℃预变性5 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s共35个循环,72 ℃修复延伸5 min,4 ℃ 保存。PCR产物用1%琼脂糖进行凝胶电泳,电压120 V,时间20 min,在凝胶成像分析仪中进行拍照检测。PCR产物经琼脂糖凝胶电泳检测后,由天一辉远生物科技(武汉)有限公司进行测序,测序结果在NCBI数据库中进行BLAST比对分析,确定菌株的分类地位。
1.5 香芹酚对猕猴桃软腐病病原菌的抑制作用
采用生长速率法[12]测定香芹酚对猕猴桃软腐病原真菌的抑制效果。将病原菌孢子接种至PDA 培养基上于26 ℃培养3 d后,于菌落边缘处用7 mm的打孔器取菌饼,将菌饼反贴于PDA培养基上;然后,在无菌滤纸片上滴加0、0.29、0.58、0.87、1.16、1.45、1.74 μg香芹酚并反贴于培养皿内盖中央,快速用封口膜将培养皿密封,使香芹酚的终质量浓度分别为0、2.9、5.8、8.7、11.6、14.5、17.4 μg/L。以不含香芹酚作为对照;每个浓度设置3个重复,置于26 ℃条件下培养72 h后测定病原菌的菌落直径。
1.6 模拟销售条件下香芹酚对猕猴桃软腐病的控制效果
挑选大小、色泽及成熟度一致且无机械损伤的健康徐香猕猴桃果实,将50 μL 58 mg/L香芹酚溶液均匀喷施在包装纸表面,晾干后包裹猕猴桃果实,然后将猕猴桃置于聚乙烯保鲜袋中,并于模拟常温货架环境(温度为25 ℃、相对湿度为90%)条件下放置。以上每个处理设置3个重复,每个重复30个果实。放置期间每隔2 d统计猕猴桃果实的软腐病发病率,并取样用于品质指标测定。果实硬度使用GY-4型水果硬度计测定,可溶性固形物(SSC)含量使用手持测糖仪测定,可滴定酸(TA)含量参照文献[13]的酸碱滴定法测定。VC含量采用磷钼酸法测定,总酚(TP)和总类黄酮(TF)分别参考朱仙慕等[14]和陆蓓等[15]的紫外分光光度法进行测定。
2 结果与分析
2.1 猕猴桃果实软腐病病原菌的显微形态特征
本研究从50个不同来源的猕猴桃软腐病发病果实中分离获得8种病原菌共96株,依次编号为MH-1~MH-8,各种类病原菌分别检出23、31、17、10、5、4、4和2株。病原菌的菌落特征和显微结构如图1所示,根据菌落特征、生长速率和菌丝孢子形态等初步鉴定出5种。
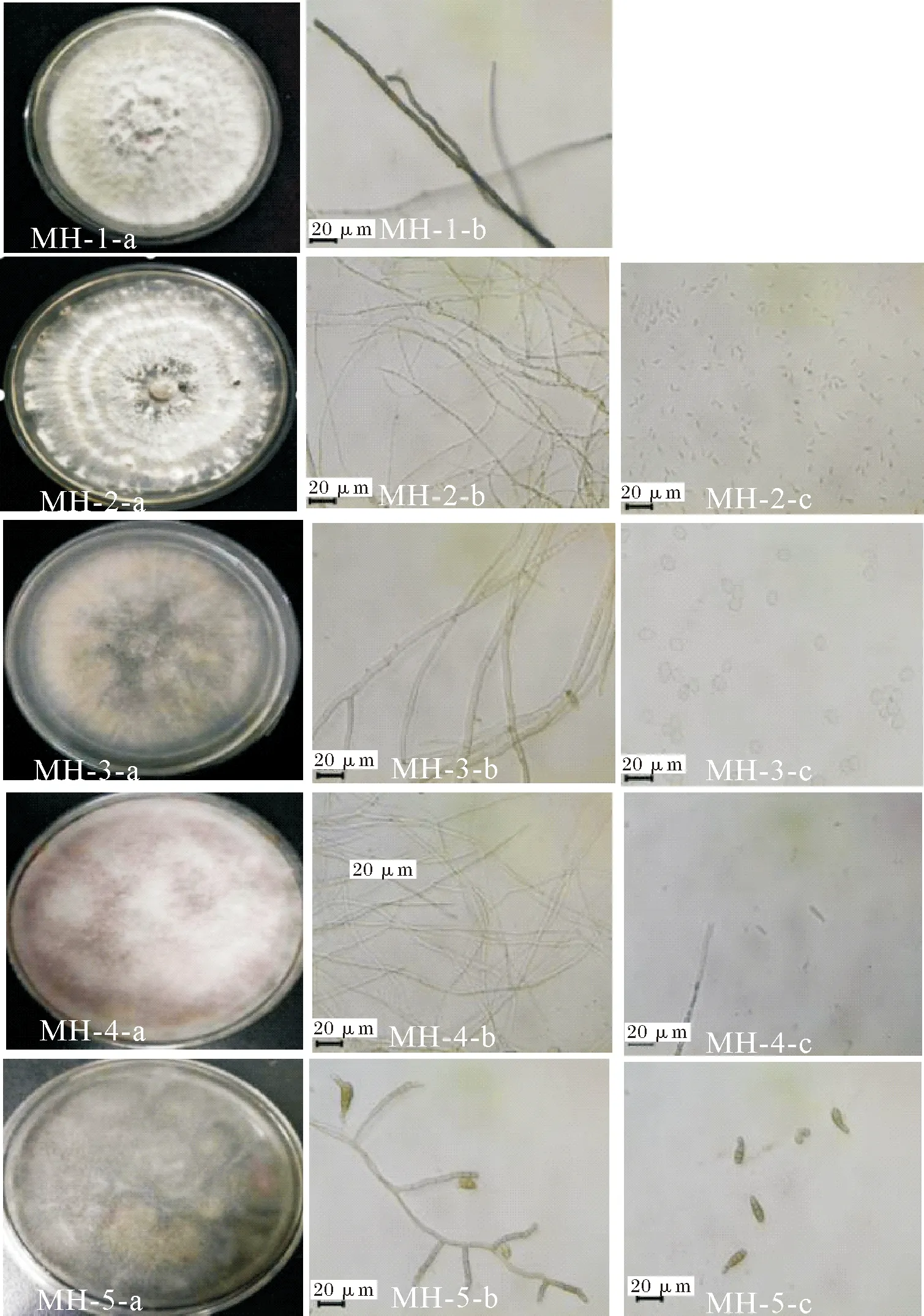
图1 5种病原真菌在PDA培养基上菌落特征(a)、显微菌丝形态(b)和孢子形态(c)观察
MH-1:菌丝初为白色,培养3 d后从菌落中央渐转为墨绿色,菌落边缘不整齐,气生菌丝发达,7 d后,菌落颜色加深至黑色;菌丝有节状隔膜,多核,直径约3.55~5.69 μm,依据上述特征并结合文献[16]初步鉴定为葡萄座腔菌(Botrytisdothidea)。
MH-2:菌丝为白色,边缘较整齐,呈明显轮状生长,气生菌丝不发达,紧贴培养基生长且生长速度较慢,5 d后产生菌核;菌丝较细,2.45~3.86 μm,分生孢子器暗褐色、分散、球形或扁球状、单腔;分生孢子梗分隔、细长,孢子形状似麦粒,孢子大小为(2.07~2.88) μm×(6.21~7.89) μm。依据上述特征并结合文献[17]初步鉴定为拟茎点霉菌(Phomopsissp.)。
MH-3:菌丝为灰白色绒状,然后转为浅褐色,菌落边缘较整齐,气生菌丝旺盛,3 d后菌落直径达
到90 mm,可产生黑色菌核;菌丝有节状隔膜,直径为6.05~8.28 μm,具隔膜,顶端呈 1~2 次分枝,分枝的末端膨大,上密生小梗,小梗上聚生大量分生孢子;孢子为椭圆形,大小为(11.08~13.23) μm×(7.88~9.35) μm,依据上述特征并结合文献[18]初步鉴定为灰葡萄孢菌(Botrytiscinerea)。
MH-4:菌落初为白色,从底部逐渐变为红色,边缘呈放射状,气生菌丝为白色且旺盛;菌丝宽度约为3.45~5.52 μm,分生孢子为弯月形或纺锤形,有2~5个隔膜,大小为(3.59~4.91) μm×(25.45~33.06) μm,依据上述特征并结合文献[19]初步鉴定为层出镰刀菌(F.proliferatum)。
MH-5:菌落初为白色,后变为灰绿色,3 d后转为墨绿色,气生菌丝不发达,边缘整齐,生长速度适中;菌丝有横隔,宽度约为4.27~5.87 μm;分生孢子呈纺锤形、棍棒形或梨形,褐色,大小为(7.21~8.54) μm×(19.02~23.07) μm,依据上述特征并结合文献[17]初步鉴定为链格孢菌(Alternariasp.)。
2.2 猕猴桃果实软腐病病原菌的致病性
将分离纯化的病原菌回接至健康猕猴桃果实,室温放置7 d后,5株病原菌造伤接种的猕猴桃果实均出现了明显的软腐病病状,而对照组的则不发病(图2A)。对发病组织的病原菌重新分离再培养后,其培养特性和菌丝形态与原病菌一致。由图2B可知,MH-1与MH-2两种病原真菌的病斑直径最大,分别为(40.37±0.55)和(37.6±3.31) mm,致病性最强,而MH-3和MH-4致病性最弱。因此,本研究进一步利用ITS基因序列对MH-1、MH-2进行分子鉴定。
2.3 猕猴桃果实软腐病病原菌的分子鉴定
以通用引物进行PCR扩增得到MH-1和MH-2 菌株的rDNA-ITS序列,电泳图谱显示2个菌株的rDNA-ITS序列长度大小为500~750 bp(图3)。测序结果显示MH-1、MH-2菌株的rDNA-ITS序列大小分别为552、587 bp,与电泳图谱结果一致。将获得的序列与GenBank中已有序列进行同源性比较,发现MH-1、MH-2与葡萄座腔菌B.dothidea(KP183175.1)、拟茎点霉菌Phomopsissp.(KJ739493.1)的同源性均达到99%。因此,MH-1与MH-2两种病原菌分别鉴定为葡萄座腔菌(B.dothidea)与拟茎点霉菌(Phomopsissp.)。
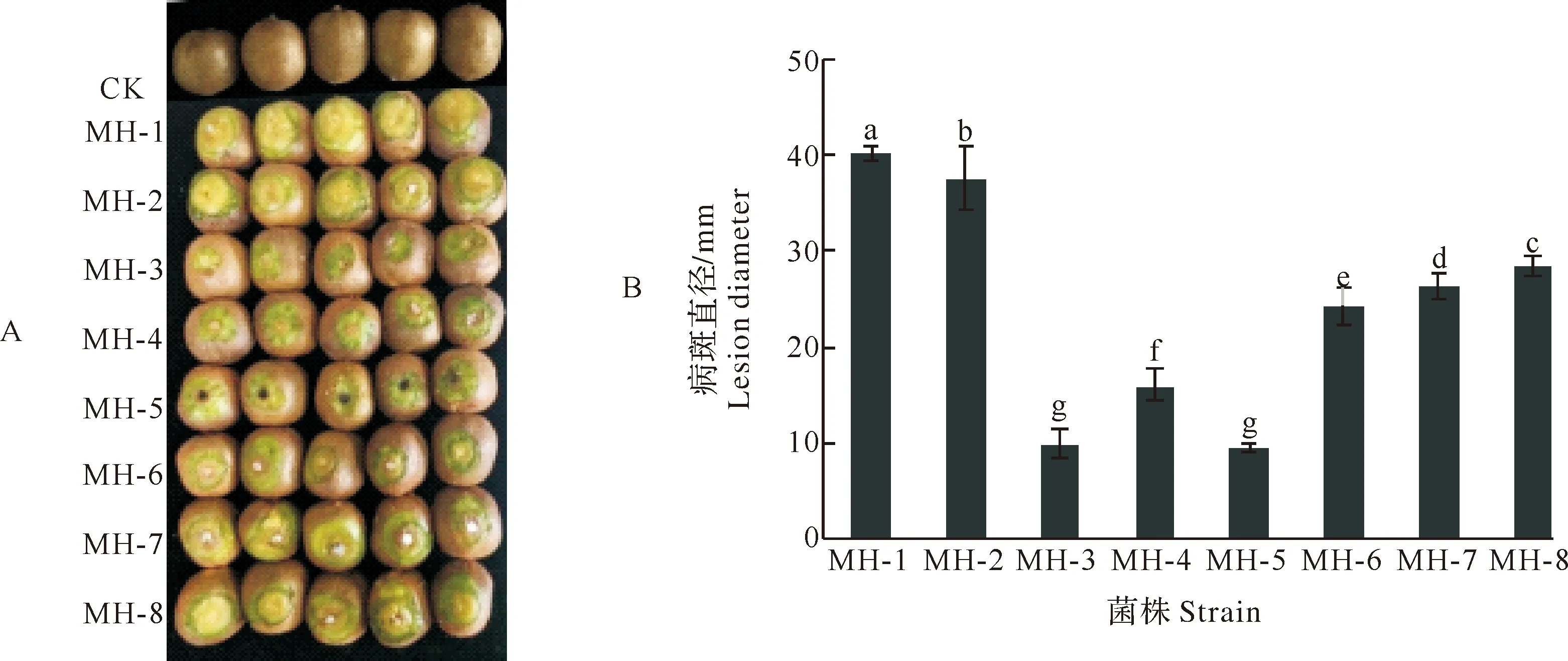
图2 猕猴桃软腐病病原菌的回接病症(A)及致病性测定(B)

图3 MH-1与MH-2 rDNA-ITS序列琼脂糖凝胶电泳图谱
2.4 香芹酚对猕猴桃软腐病菌的抑制作用
香芹酚对8种猕猴桃软腐病病原菌菌丝生长的体外抑制效果见表1。由表1可知,香芹酚处理对8种猕猴桃软腐病菌均有显著抑制作用,其中香芹酚对MH-2和MH-7的抑制效果最强,其次是MH-1和MH-6,其相应的EC50分别为8.78、10.72、12.15、12.15 μg/L,对其余4种病原菌的EC50值均在14~26 μg/L。表明香芹酚在离体条件下可以有效抑制猕猴桃软腐病菌的生长。
2.5 香芹酚在模拟销售条件下对猕猴桃软腐病的发病率的影响
由图4可以看出,随着放置时间延长,处理组和对照组果实在模拟销售条件下的发病率均逐步增高,但香芹酚处理果实的软腐病发生率始终显著低于对照(P<0.05)。在放置2 d时,对照组猕猴桃果实开始有软腐病发生,6 d时对照组猕猴桃果实软腐病发病率明显提高,达32.22%,而此时处理组猕猴桃果实发病率仅为11.11%;8 d时对照组果实的发病率为64.44%,而处理组果实的发病率为32.22%,仅为对照的50.17%(图4)。因此,香芹酚显著降低模拟销售条件下猕猴桃果实软腐病的发生。
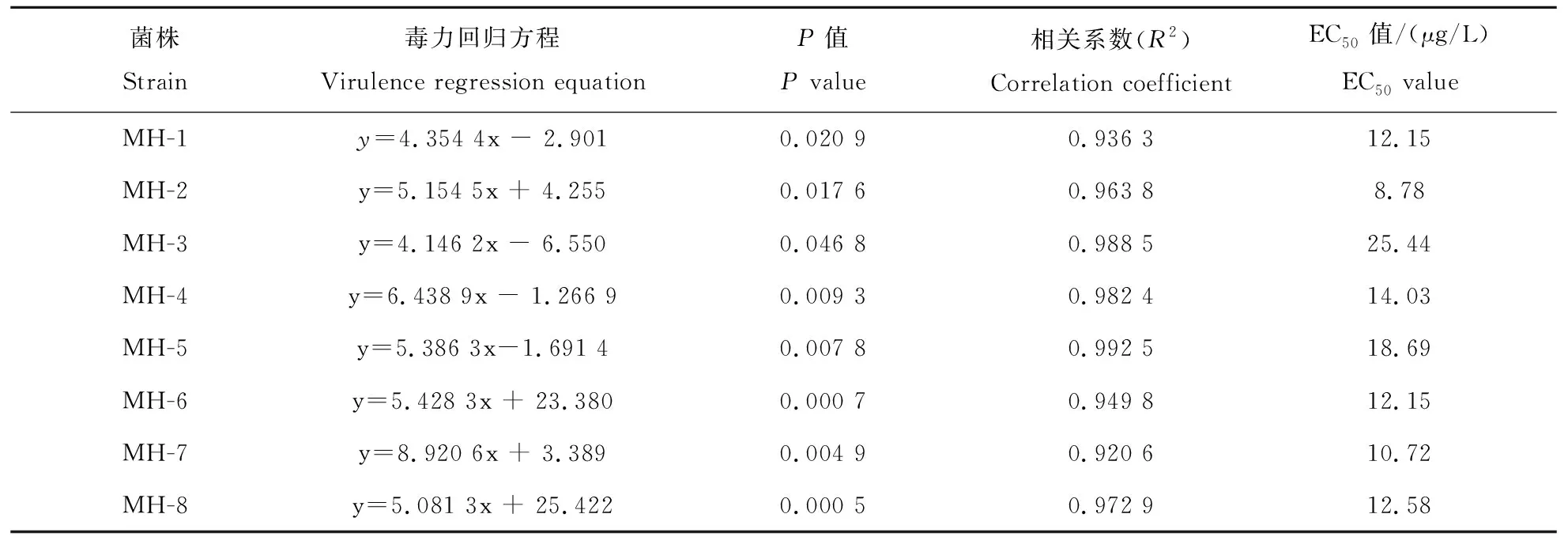
表1 香芹酚对8种猕猴桃软腐病菌的体外抑制作用 Table 1 Inhibition of carvacrol on the eight kiwifruit soft rot pathogens in vitro

图4 香芹酚对模拟销售条件下猕猴桃果实软腐病发病率的影响
2.6 香芹酚处理对模拟销售条件下猕猴桃果实品质的影响
为了评价香芹酚处理对猕猴桃果实品质的影响,本研究测定了处理组和对照组果实硬度、可溶性固形物、可滴定酸、VC含量、总酚含量、总类黄酮含量等相关品质指标,结果如表2所示。经香芹酚处理的猕猴桃果实的硬度、TSS、TP及TF与对照果实无显著差异,而经香芹酚处理的猕猴桃果实VC含量和TA含量显著高于对照组果实,表明香芹酚处理对果实硬度等无不良影响且能够有效保持猕猴桃果实的采后品质。因此,香芹酚处理可使猕猴桃果实在采后销售和消费期间保持较高营养物质和贮藏品质。

表2 香芹酚对猕猴桃采后品质的影响(温度25 ℃,相对湿度90%) Table 2 Effect of carvacrol on quality attributes of kiwifruits at 25 ℃ and RH 90%
3 讨 论
软腐病是引起猕猴桃采后腐烂变质的重要真菌病害之一,目前在我国多个猕猴桃产区均有发生,在国外如日本、新西兰和意大利等国也有发生[20-22]。Li等[10]对来自中国11个猕猴桃主产区的猕猴桃软腐病病果的病原菌进行分离鉴定,发现葡萄座腔菌和拟茎点霉菌是引起猕猴桃软腐病的主要致病菌。葡萄座腔菌不仅危害猕猴桃果实还能使叶片产生斑点,损伤枝条,在枝叶表面产生丰富的分生孢子,同时也引起苹果和梨等果实腐烂[4]。而拟茎点霉属真菌是一类重要的植物病原菌,可引起寄主植物多种病害,如桃枝条溃疡病、大豆茎萎病、叶斑病和果腐等,同时也是导致龙眼、芒果、甜瓜和蓝莓等果实采后腐烂的主要致病菌[23]。本研究也发现葡萄座腔菌和拟茎点霉菌是引起猕猴桃软腐病的主要致病菌,在猕猴桃果实采后软腐病发生过程中起到重要作用,此结果与前人研究基本一致。值得注意的是,拟茎点霉菌在PDA平板上未观察到分生孢子,而李诚等[24]在显微观察拟茎点霉菌和葡萄座腔菌时同样发现2种病原菌在常规培养基上不易产生孢子,需通过近紫外光照射等方法诱导产孢。此外,本研究发现灰葡萄孢菌、层出镰刀菌和链格孢菌也能引起猕猴桃采后软腐病。吴文能等[17]从“贵长”猕猴桃软腐病果中分离出链格孢菌,但检出率较低。陆训等[25]报道引起湖南省猕猴桃发生软腐病的主要致病菌是大豆拟茎点种腐病菌。Zhou等[4]从四川猕猴桃软腐果实中不仅分离出葡萄座腔菌,还分离出焦腐病菌和小新壳梭孢等病原真菌。以上结果表明引起猕猴桃软腐病发生的病原菌种类多,发病规律复杂,有必要对其发病规律进行更加深入系统的研究。
香芹酚作为牛至精油的主要成分,对青霉菌、曲霉菌、根霉菌等多种果蔬采后腐败真菌均有抑制作用[26-27]。Suwanamornlert 等[28]用香芹酚熏蒸和直接接触处理龙眼果实采后病原真菌,发现香芹酚对4种龙眼采后病原菌的菌丝生长抑制表现出显著的抑制作用,其最低抑菌浓度和最低杀菌浓度均仅在40~80 μL/L。Zhang等[29]报道20 ~ 120 μL/L香芹酚处理可以抑制灰葡萄孢菌菌丝生长,菌丝在120 μL/L时受到完全抑制,且抑制效果呈显著的剂量效应。本研究发现香芹酚熏蒸处理对引起猕猴桃软腐病的8种病原菌的菌丝生长均有显著的抑制作用,并且对猕猴桃软腐病的主要致病菌拟茎点霉菌和葡萄座腔菌的抑菌效果尤其显著,其EC50值仅为8.78 μg/L和12.15 μg/L。同时,香芹酚对模拟销售条件下猕猴桃果实采后软腐病具有良好的控制效果,经香芹酚处理后果实病害发生率仅为对照果实的50.17%。Abdollahi等[30]发现在采后喷洒以香芹酚为主要成分的夏味精油能降低无籽葡萄的病害发生率,减少质量损失,对风味口感没有不良影响;Peretto等[31]报道含有香芹酚的可食性膜能有效降低草莓果实采后腐烂,并保持果实品质。此外,香芹酚显著降低甜樱桃[32]、柑橘[33]、番茄[34]等果实采后病害的发生。以上研究显示香芹酚在果实采后病害的控制方面表现出广阔的应用前景。本研究中香芹酚对8株致病真菌均表现出显著的抑制作用;同时,有效降低了模拟销售条件下猕猴桃果实软腐病的发病率,对猕猴桃采后软腐病具有良好的控制效果,可以改善猕猴桃果实品质,减少营养成分的损失,增强果实的耐贮性,从而达到保持猕猴桃果实食用价值且延长货架期的效果。
