管内硼亲和固相微萃取-高效液相色谱全自动在线联用检测茶饮料中的顺式二羟基化合物
2020-12-02何坚刚
王 欣, 何坚刚, 罗 琪, 刘 震
(南京大学化学化工学院, 生命分析化学国家重点实验室, 江苏 南京 210023)
固相微萃取(solid phase microextraction, SPME)[1,2]是20世纪90年代兴起的一项新颖的样品前处理与富集技术。SPME技术自创立以来得到迅速发展与广泛应用[3-5]。SPME将样品取样、样品制备和样品浓缩等过程集成到一个萃取相并一步完成,能与分析仪器进行离线或在线联用。绝大多数的SPME是利用非共价相互作用(如疏水相互作用等)将目标分子吸附到萃取相表面,因而存在着作用力弱和选择性较差的缺点。刘震等[6,7]发展出基于共价相互作用的固相微萃取----硼亲和固相微萃取(BA-SPME)。取代硼酸在较高的pH条件下可以和顺式二羟基分子结合,形成五元环或六元环的硼酸酯,而在较低的pH条件下,硼酸酯解离,释放出顺式二羟基分子[8,9]。因此,和常规的SPME相比,以取代硼酸为配基的硼亲和SPME具有多种优点:(1)选择性较高,能选择性萃取核苷酸、糖蛋白和糖肽等重要的顺式二羟基生物分子;(2)作用力较强,解离平衡常数(Kd)通常为10-1~10-4mol/L,相对于非共价作用,萃取能力较强;(3)由于非共价作用导致的非特异性吸附可以通过重复清洗萃取相的办法清除;(4)可以通过使用酸性pH或加入单糖等顶替试剂即可实现目标物的解吸,不需要高温、高盐浓度、高有机溶剂等容易导致生物分子变性的苛刻条件。硼亲和萃取技术已经在核苷酸等生物小分子[10-15]、糖肽和糖蛋白等生物大分子[16-20]等的富集及分析中展现出强大优势。
SPME的一个重要优势是其易于与分析仪器进行联用。但是,与SPME-GC联用相比,SPME-HPLC联用的实际应用相对要少得多。这主要是因为SPME-HPLC联用受以下两个因素的限制:分析物在液相和常温条件的解吸时间长,容易造成样品残留和样品区带展宽;自动化的SPME-HPLC联用接口和联用方法很少。硼亲和固相微萃取的萃取/解吸为受pH调控的可逆过程,溶质的解吸非常容易,采用弱酸性溶液洗脱即可。该特征使得硼亲和固相微萃取特别适用于HPLC进行在线联用。刘震等[7]已经实现了管内SPME-HPLC-电喷雾串联质谱的在线联用。但目前,已报道的在线联用尚不能进行反复多次的萃取/排除和自动进样等自动化功能,BA-SPME与HPLC的自动化在线联用还未见报道。
儿茶素和茶黄素是茶叶中重要的活性成分,它们均为顺式二羟基化合物。儿茶素能有效地抑制或延缓中风、衰老、癌症和糖尿病的发生,而茶黄素具有调节血脂、预防心血管疾病的功效,而且无毒副作用,被誉为茶叶中“软黄金”[21-25]。因此,对茶叶及茶饮料中的儿茶素等顺式二羟基化合物的自动分析与检测对于茶叶及其制品的质量控制具有重要意义。本文报道了一种新颖的管内硼亲和固相微萃取-高效液相色谱全自动在线联用,用于分析茶饮料中的顺式二羟基化合物。该自动化在线联用方法利用商品化HPLC仪器配备的自动进样器通过六通阀的切换实现流路连接。在本文中,制备了管内硼亲和SPME毛细管,考察了涂层柱的柱容量并对其形貌进行了表征,考察并优化了影响实际样品分离效果的因素,最后,利用该联用方法对3种不同品牌的茶饮料进行了分析,并对沏茶温度对茶水中顺式二羟基化合物含量的影响进行了评价。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1200液相色谱仪(Agilent Technologies,德国)配备二极管阵列检测器(DAD),液相色谱由LC 3D工作站(version B.02.01-SR1)控制。Venusil XBP-C18色谱柱(250 mm×4.6 mm, 5 μm粒径)购自Agela Technologies (Newark,美国)。熔融石英毛细管(75 μm i.d., 375 μm o.d.)购自河北锐沣色谱器件公司。
对乙烯基苯硼酸(VPBA)、间氨基苯硼酸单水化合物(m-PBA)、乙二醇二甲基丙烯酸酯(EDMA)、γ-甲基丙烯酸氧丙基三甲氧基硅烷(γ-MAPS)均为色谱纯,购自美国Sigma公司。邻苯二酚和对苯二酚均为色谱纯,购自Alfa-Aesar天津公司。色谱纯甲醇、乙腈均购自德国Darmstadt公司。偶氮二异丁腈(AIBN)、乙二醇、一缩二乙二醇、磷酸二氢钠、氢氧化钠均为分析纯,购自上海国药化学试剂公司。AIBN使用前用甲醇重结晶。实验用水由Milli-Q纯水仪净化所得。茶饮料均为无糖型,由超市购得,条形码分别为:6925303721428(统一绿茶)、6920459998410(康师傅茉莉花茶)和6921581596048(三得利乌龙茶);溧阳绿茶(常州市六雨茶叶有限公司)。

图 1 管内硼亲和固相微萃取-液相色谱自动在线联用原理示意图Fig. 1 Schematic diagram of automated on-line hyphenation of in-tube solid phase microextraction (SPME) with HPLC a. Extraction (Step 1): from the sample vial, the sample solution is repeatedly drawn into and ejected out of the in-tube SPME capillary; b. desorption and separation (Step 2): the in-tube SPME capillary is connected with the HPLC system.
1.2 实验原理示意图
管内硼亲和固相微萃取-高效液相色谱全自动在线联用的原理见图1。该在线联用分为两步:萃取,解吸和分离。在萃取时,萃取毛细管与自动进样系统的计量泵相连,样品反复多次从样品瓶中被吸取到硼亲和萃取毛细管并排出;在解吸和分离时,通过切换六通阀,硼亲和萃取毛细管连接到液相色谱,被萃取到萃取毛细管管壁上的顺式二羟基化合物用酸性流动相洗脱,然后直接注入HPLC系统进行分离和检测。
1.3 硼亲和涂层柱制备
硼亲和涂层柱按照文献[13]方法适当修改后制作。首先进行毛细管管壁预处理:石英毛细管依次用1 mol/L NaOH溶液冲洗30 min,水冲洗至中性,1 mol/L HCl溶液冲洗30 min,水冲洗二次至中性,再用氮气吹扫12 h至干。将γ-MAPS/MeOH(1∶1, v/v)溶液注入毛细管,在45 ℃水浴中反应过夜。反应结束后用甲醇冲洗毛细管,氮气吹干,得到内壁衍生了双键的毛细管空管。然后进行涂层柱的制备:1 mg AIBN溶于40 μL EDMA溶液中,加入20 mg VPBA,再加入195 μL一缩二乙二醇和45 μL乙二醇,涡旋,在冰浴中超声15 min。将配好的溶液注入内壁衍生了双键的毛细管中,在75 ℃水浴中反应2 h,用HPLC泵将未反应完全的溶液泵出后在毛细管内壁留下涂层,将制得的涂层柱用甲醇冲洗除去残留的未反应物。聚合反应示意图见图2。涂层柱在使用前用100 mmol/L醋酸冲洗活化30 min。
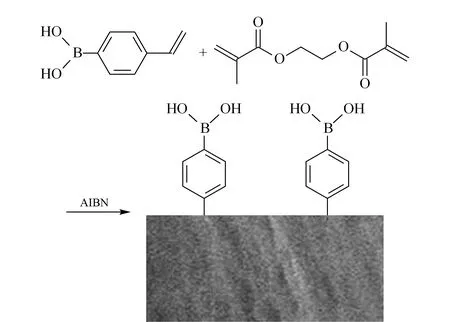
图 2 聚合反应的原理图Fig. 2 Schematic of the copolymerization reactionAIBN: 2,2′-azobis(2-methylpropionitrile).
1.4 色谱分离条件
色谱柱:Venusil XBP-C18色谱柱(250 mm×4.6 mm, 5 μm);柱温:20 ℃;流动相:甲醇/10 mmol/L甲酸(50∶50, v/v);流速:0.5 mL/min; DAD检测波长:275 nm。
1.5 萃取参数设定
抽取/排出体积:40 μL;抽取/排出流速:300 μL/min;抽取/排出次数:20次。
1.6 样品制备
取适量茶饮料,加入等体积100 mmol/L磷酸二氢钠后用氢氧化钠溶液调节pH到8.5,加入偏亚硫酸钠(6 mmol/L)防止儿茶素氧化,混匀后取适量进样。
分别称取1 g溧阳绿茶于3个茶杯中,依次用150 mL温度为95、85、75和65 ℃的水加入杯中,加盖泡30 min,之后分别取上清液与同体积的50 mmol/L的磷酸盐缓冲溶液混合,之后加入偏亚硫酸钠,用1 mol/L NaOH和1 mol/L HCl调节pH到8.5。将1.5 mL经过处理的样品放入样品瓶中进行全自动SPME-HPLC测定。

图 3 固相微萃取毛细管的扫描电镜图Fig. 3 Scanning electron microscope (SEM) images of the SPME capillary a. cross-sectional view of the capillary; b. enlarged image of the edge of the inner surface of the capillary.
2 结果与讨论
2.1 涂层柱的表征
2.1.1萃取相表征
利用扫描电镜(SEM)对poly(VPBA-co-EDMA)涂层毛细管的形貌进行表征。如图3所示,在in-tube SPME毛细管内,已经形成一层高分子涂层,厚度约1.68 μm。涂层表面非常粗糙,这有利于提高萃取相的萃取容量。
2.1.2萃取容量
利用前沿分析法,以邻苯二酚和对苯二酚分别作为样品和死时间标记物,测定了柱容量。经计算柱容量为6.6×10-6mol/L。
2.2 流动相流速选择
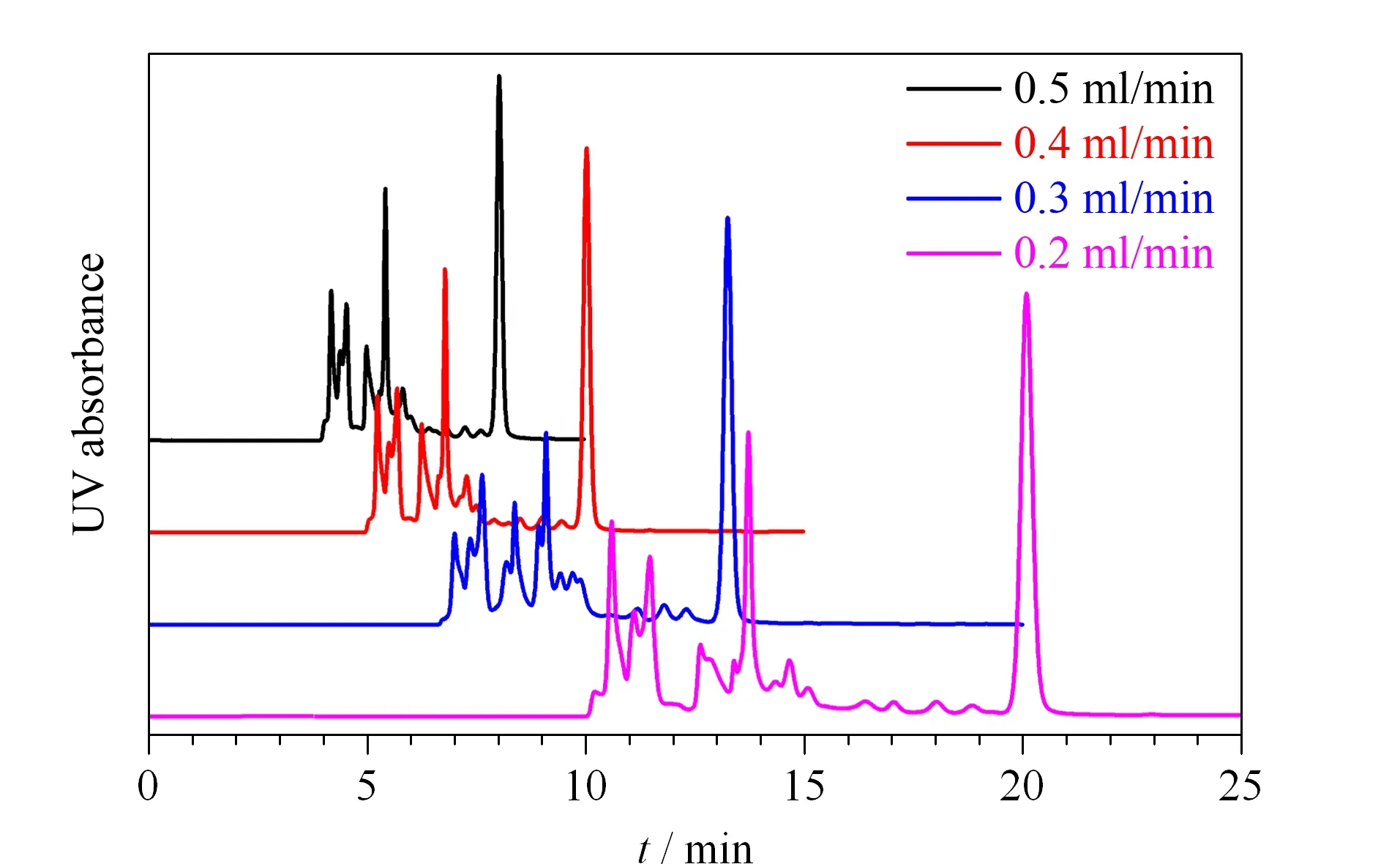
图 4 流速对茶饮料样品中顺式二羟基化合物的分离的影响Fig. 4 Effects of the flow rate of the mobile phase on the separation of cis-diol compounds extracted from tea beverage samples
本方法中,SPME萃取毛细管通过自动进样器的流路与液相色谱的流路直接相连,由于自动进样器流路无法承受太高流量和压力,必须选择合适的流速,以确保在流路压力匹配的同时获得良好的分离。若流速过大,不仅可能造成流路漏液,而且导致分离不足;而若流速太慢,则分离时间过长,峰展宽明显。因此,考察了流速对于样品分离的影响。选用康师傅茉莉花茶作为样品,在不接入SPME并在相同进样量的条件下,依次考察了0.5、0.4、0.3和0.2 mL/min 4个流速条件下的分离情况。由图4可知,随着流速的降低,整体分离效果有所改善,分离得到的组分数目逐渐增加;但就分离时间而言,0.2 mL/min流速下的分离时间是0.5 mL/min流速下的2倍。综合分离效果和分离速度上的考虑,仍选择0.5 mL/min做进一步的考察。根据硼亲和色谱机理[26-28],样品中的非顺式二羟基化合物不被管内硼亲和SPME柱富集,被富集并转移到分离柱上的组分主要为顺式二羟基化合物。
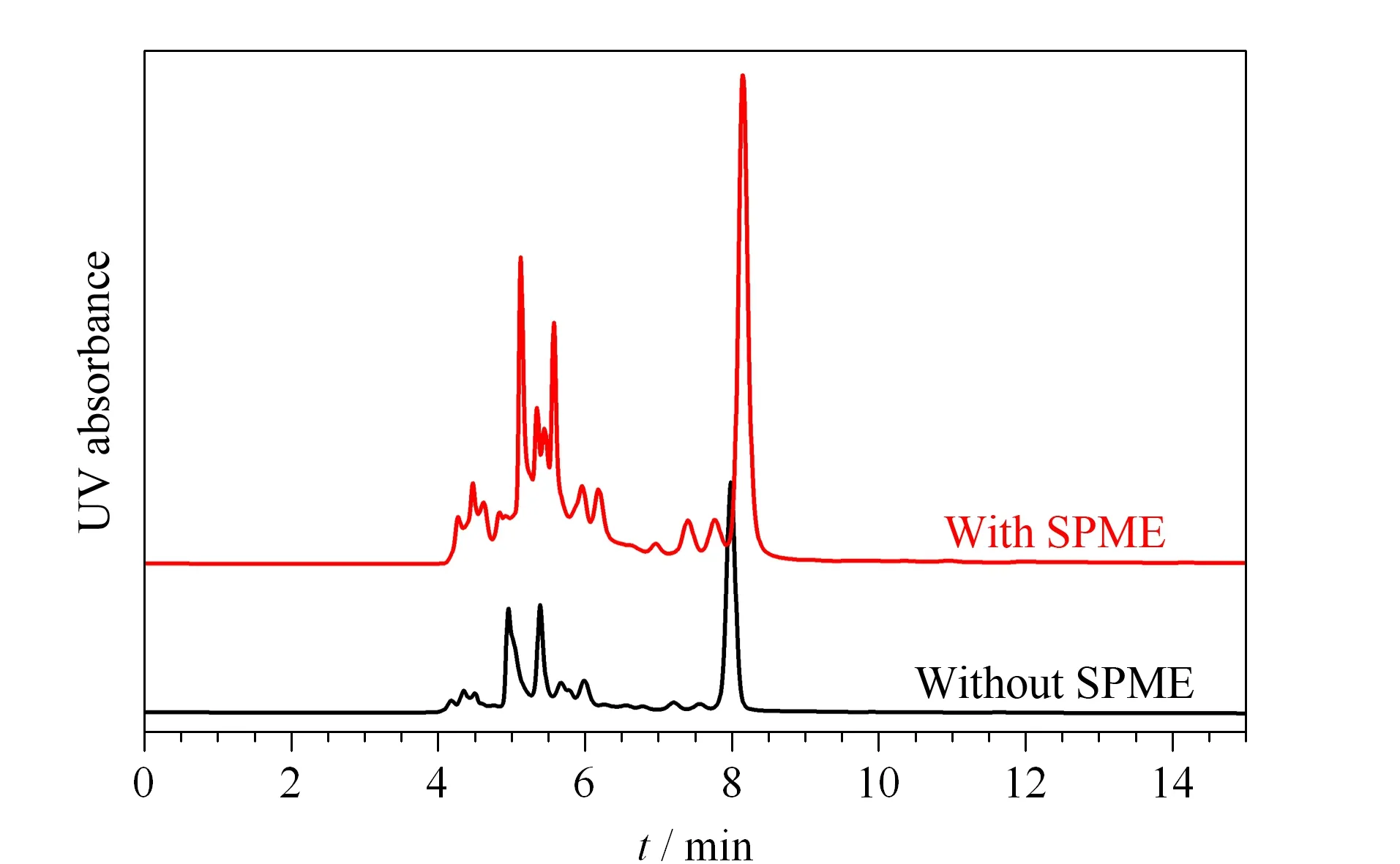
图 5 有无固相微萃取时的HPLC色谱图对比Fig. 5 Comparison of the HPLC chromatograms with and without SPME
2.3 萃取能力及联用性能考察
选择三得利乌龙茶饮料作为考察对象,在全自动抽取/排出情况下,考察了in-tube BA-SPME对实际样品的选择性萃取能力。由图5可知,在选择抽取排出体积、速度和次数分别为40 μL、300 μL/min和20次的情况下,经in-tube BA-SPME萃取后的谱图中检测到的色谱峰个数增加,而且峰的强度普遍增加。以和其他色谱峰基线分离的最后一个峰比较,通过SPME进行样品处理后,峰高增加了2.1倍。以上结果说明采用该管内硼亲和SPME的必要性及该联用系统的有效性。
2.4 实际样品分析
进一步考察了in-tube BA-SPME对于3种茶饮料的萃取及分离能力。由图6可知,3种茶饮料的色谱图轮廓大致相同,说明所含的儿茶素等顺式二羟基成分大致相同,但各色谱峰的信号强度不尽相同,说明儿茶素等顺式二羟基成分含量不同。

图 6 不同茶饮料样品的色谱对比图Fig. 6 Comparison of the chromatograms for different tea beverages

图 7 沏茶温度对茶水中顺式二羟基化合物的影响Fig. 7 Effects of tea-making temperature on the profile of cis-diol compounds in tea
2.5 沏茶温度的影响
选用溧阳绿茶作为考察对象,以烧开后不同温度的自来水来考察沏茶温度对于茶水质量的影响,以茶水中顺式二羟基成分的含量作为评判标准。图7显示了不同沏茶水温下茶水的色谱图。在65~85 ℃范围内,茶水中的顺式二羟基化合物的浓度随着温度升高而增加,但温度进一步升高到95 ℃时,谱图中顺式二羟基化合物的峰高反而降低。这说明,较高的温度有利于将儿茶素等活性成分从茶叶中浸提到水中,但温度过高时,儿茶素等顺式二羟基化合物可能发生氧化,儿茶素等活性成分的浓度反而降低。因此,从最大限度地获得儿茶素等活性成分的角度考虑,沏茶存在一个最佳的温度(本文条件下为85 ℃)。
3 结论
以硼亲和高分子涂层毛细管柱作为管内固相微萃取柱,以商品化和自制茶饮料中的顺式二羟基化合物为目标分析物,通过对自动进样系统的流路进行简单改动,成功建立了硼亲和SPME与HPLC的自动化在线联用。该在线联用方法能明显提高对实际样品中的顺式二羟基化合物的检测灵敏度。由于整个萃取和分离过程由计算机自动控制,该联用系统能提供良好的萃取和分离重现性。利用该系统所得的色谱图能在一定程度上体现不同茶饮料中的顺式二羟基组分的浓度差异。此外,对沏茶温度的考察显示,为获得最大量的儿茶素等顺式二羟基化合物成分,存在一个最佳的沏茶温度。
