解淀粉芽孢杆菌DMBA-K4高产胞外多糖的发酵条件优化及其抗氧化活性研究
2020-12-02邝嘉华黄燕燕胡金双余佳佳周钦育赵珊刘冬梅
邝嘉华,黄燕燕,胡金双,余佳佳,周钦育,赵珊,刘冬梅
(华南理工大学 食品科学与工程学院,广东 广州,510640)
胞外多糖(exopolysaccharide, EPS)是微生物分泌到细胞外的高分子碳水化合物,它在微生物抵抗环境压力(渗透压、干燥、有毒化合物和噬菌体)时发挥重要的作用[1]。
新型天然产物具有独特的生化潜力,多糖作为典型的天然产物代表,备受关注。自然界中的多糖主要从植物和微生物中提取。微生物多糖具有易提取、生产周期短、不受季节影响的特点[2],因此,与植物多糖相比,它被更广泛应用于食品添加剂、黏合剂和废水处理等[3]。此外,EPS还具有良好的抗氧化性[4]、抗肿瘤[5]和免疫调节作用[6]。张玲秀等[7]对枯草芽孢杆菌EPS进行了免疫活性研究,结果表明其提高了小鼠的多项免疫指标;王辑等[8]研究发现植物乳杆菌JLK0142的EPS能作用于小鼠的RAW264.7巨噬细胞,并提高小鼠的免疫能力。解淀粉芽孢杆菌广泛存在于自然界中,是一种公认安全的菌株[9]。目前对其研究较少并主要集中于抗菌肽[10-11]和酶制剂[12-13]等,关于EPS的报道较少。
已有众多学者对源于乳酸菌的EPS进行研究[3,5-6],对解淀粉芽孢杆菌的EPS研究可以丰富人们对新型微生物多糖的认识,扩宽其市场应用前景。而发酵提取工艺是进行深入功能研究的基础,高效且经济的发酵条件对拓展EPS的应用领域具有现实意义。
本研究基于1株从云南普洱茶中分离纯化得到的菌株DMBA-K4,16S rDNA鉴定其为解淀粉芽孢杆菌。针对其产EPS的特点,应用单因素法和响应面法对该菌株的发酵条件进行优化,以期提高积累EPS效率。测定EPS体外抗氧化性,为进一步开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
菌株DMBA-K4,由实验室从云南普洱茶中分离纯化并保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC NO. 60 644。
优化材料:LB培养基、蔗糖、葡萄糖、乳糖、甘露糖、牛肉膏、胰蛋白胨、酵母提取粉、NaCl,购于生工生物工程(上海)股份有限公司;多糖提取纯化及测定材料:浓H2SO4、苯酚、95%乙醇、正丁醇、氯仿,广州卯林试剂有限公司;抗氧化性测定材料:1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、抗坏血酸、FeSO4、无水乙醇、FeCl3、三氯乙酸、K3[Fe(CN)6]、K2HPO4、KH2PO4、水杨酸、30%H2O2,阿拉丁试剂(上海)有限公司,试剂均为分析纯。
1.2 仪器与设备
SW-CJ超净工作台,苏州净化;ZWY-100D温控回旋台式振荡器,智诚;WH-861旋涡振荡器,华利达设备有限公司;CPA225D分析天平,Sartorius;FC/K3/GO酶标仪,赛默飞世尔科技(中国)有限公司;5804R高速冷冻离心机,Eppendorf;PHB-5电子pH计,上海伟业仪器厂;YXQ-30SII立式压力蒸汽灭菌锅,上海博讯;-80 ℃低温冰箱,赛默飞世尔科技(中国)有限公司;透析袋(8 000~14 000 Da),北京生物技术有限责任公司。
1.3 实验方法
1.3.1 16S rDNA菌种分子生物学鉴定
分离纯化后的菌种样品由基迪奥生物技术有限公司进行测序,测序结果与Gen Bank中已知菌种的相对序列进行比对,利用MEGA 6.0软件将实验菌株与选取的序列相似性较高的菌株序列进行对比分析,构建系统发育树。
1.3.2 菌株活化
将DMBA-K4的斜面保种置于LB培养基中分别进行2次活化后得到种子发酵液,该种子发酵液的菌含量为108~109CFU/mL;将上述种子发酵液按体积比4∶100接入扩大培养基中,摇床上以30 ℃、180 r/min的条件培养12 h,得到DMBA-K4发酵液。
1.3.3 胞外多糖的提取
上述发酵液在4 ℃、10 000 r/min离心15 min,除去沉淀菌体,保留上清液;向上清液加入3倍体积的95%乙醇,4 ℃静置24 h,然后离心15 min,倾去上清液,沉淀用适量蒸馏水溶解后,置于透析袋中4 ℃透析24 h;向透析所得的液体中加入25%体积分数的sevage试剂[V(氯仿)∶V(正丁醇)=4∶1],室温下置于摇床振荡30 min,使蛋白吸附在有机相中,然后8 000 r/min 离心1 min,保留水相。重复4~5次,直至蛋白完全除去,冻干保存。
1.3.4 胞外多糖含量测定
采用苯酚-硫酸法测定DMBA-K4发酵液的EPS含量。移取透析后的样品溶液200 μL于洁净试管中,加入100 μL 5%苯酚溶液,摇匀后,缓慢加入500 μL 浓H2SO4,防止液滴飞溅。避光静置30 min后,测定OD490nm,并计算其EPS含量。
以0.2 mg/mL葡萄糖作为标准溶液,取溶液0、0.1、0.2、0.4、0.6、0.8、1.0 mL补水至2.0 mL,测定不同浓度葡萄糖溶液对应的OD490nm。得到线性回归方程y=7.953x+0.079 5,R2=0.991 5。
1.3.5 单因素实验
选取碳源(葡萄糖、甘露糖、乳糖、蔗糖、麦芽糖)、氮源组合(胰蛋白胨和酵母提取粉、胰蛋白胨和牛肉膏、牛肉膏和酵母提取粉、蛋白胨和牛肉膏、蛋白胨和胰蛋白胨)、pH(6、6.5、7、7.5、8)、接种量(1%、2%、3%、4%、5%)、发酵时间(4、8、12、16、24 h)5个变量进行单因素实验,按照1.3.3的方法提取多糖,按照1.3.4的方法测定菌株胞外多糖产量。
1.3.6 响应面试验设计
用软件Design Expert 8.0.6 和Box-Behnken Design (BBD) 设计响应面试验,以培养时间、接种量、pH值作为变量,并选取合适的水平,以产糖量为响应值,试验水平和因素如表1所示。

表1 响应面试验的因素及水平Table 1 Factors and levels of response surface test
1.4 EPS-K4的纯化
按优化后的发酵条件大量制备EPS-K4,利用sevage法多次去除蛋白,经过24 h透析后,冻干得到粗多糖样品。称量100 mg EPS-K4粗多糖样品充分溶于10 mL去离子水中,用0.22 μm滤膜过滤后,加入平衡后的DEAE Sepharose Fast Flow柱(1.6 cm×25 cm)中用NaCl进行洗脱(洗脱梯度为0、0.01、0.02、0.03、0.04 mol/L),同时用苯酚硫酸法对EPS含量进行检测。收集同一组分的多糖洗脱液,经过旋转蒸发浓缩后,透析冻干。继续利用Sephadex G-75 (1.6 cm×60 cm)柱层析对上一步冻干样品纯化。用苯酚硫酸法于490 nm检测多糖含量。收集主峰洗脱液,旋蒸浓缩后,透析冻干,得到精制EPS-K4用于后续研究。
1.5 体外抗氧化性测定
取冻干的精制EPS-K4样品,配置成0、1、2、3、4、5 mg/mL的样品溶液,相同质量浓度的抗坏血酸做阳性对照,分别测定抗氧化指标。
1.5.1 DPPH自由基清除能力测定
取2 mL样品与2 mL 0.2 mmol/L DPPH-乙醇溶液混合,在室温、避光条件下静置30 min。于517 nm处测定吸光度。DPPH自由基清除率计算如公式(1)所示:
(1)
式中:A1,样品组吸光度;A,等体积无水乙醇代替DPPH溶液的空白组吸光度;A0,等体积无菌水代替样品的对照组吸光度。
1.5.2 羟基自由基(·OH)清除能力测定
取1 mL 样品与0.5 mL 9 mmol/L 水杨酸、0.5 mL 9 mmol/L FeSO4溶液和5 mL 8.8 mmol/L H2O2混合,在室温、避光条件下静置30 min,于510 nm处测定吸光度。·OH清除率计算如公式(2)所示:
(2)
式中:A1,样品组吸光度;A,等体积无菌水代替FeSO4溶液的空白组吸光度;A0,等体积无菌水代替样品的对照组吸光度。
1.5.3 总还原力测定
采用铁氰化钾法测定多糖的总还原力。取0.5 mL样品与1.0 mL 1% K3[Fe(CN)6]溶液充分混匀,再加入1 mL 2.0 mol/L的PB缓冲液(pH 6.6),用旋涡振荡器充分混匀。将混合溶液迅速且小心转移至在50 ℃恒温水浴锅中,反应20 min后,快速冷却,并加入1 mL质量分数为10%的TCA溶液充分混匀。然后5 000 r/min离心15 min后,吸取2 mL上清液与0.5 mL的0.1% FeCl3溶液充分混匀,再加入1.5 mL的去离子水,10 min后测定OD700nm。
1.6 数据处理
样品进行3次平行实验,数据采用GraphPad Prism 8.0.1作图,结果均以平均值±标准差表示。t检验用于2组样本之间分析,当差异分析P<0.05时,认为其具有显著性。
2 结果与分析
2.1 基于16S rDNA 的基因序列相似性比对及系统发育树分析
在Gen Bank中,将菌株的16S rDNA 基因序列与相似的已知菌株序列进行比对。选取相似度较高的菌株序列构建系统发育树,结果如图1所示。菌株与BacillusamyloliquefaciensJxnuwy-1在同一分支上,且置信度高,可将菌株鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。图2为革兰氏染色后菌株DMBA-K4的菌落形态。该菌株经染色后呈紫色短杆状,为革兰氏阳性菌并具有典型杆菌特征。现今对微生物胞外多糖的研究普遍聚焦于乳酸菌属,而涉及解淀粉芽孢杆菌的胞外多糖研究较少。本实验主要针对解淀粉芽孢杆菌产胞外多糖的发酵条件优化及其抗氧化活性开展研究。

图1 基于16S rDNA序列菌株DMBA-K4的系统发育树Fig.1 Phylogenetic tree of strain DMBA-K4 based on 16S rDNA sequences

图2 DMBA-K4 革兰氏染色菌落形态观察Fig.2 The microscopic morphology of strain DMBA-K4
2.2 单因素结果分析
2.2.1 碳源选择
由于自身的酶系和转运能力的差别,微生物对碳源的利用能力各不相同。选择合适的碳源种类及其添加量,对提高微生物产胞外多糖的能力、提高经济效益具有重要的意义。本实验对5种不同的碳源进行研究,胞外多糖产量结果如图3-a所示。DMBA-K4以蔗糖为碳源时产糖量是LB培养基的2倍。研究发现,有利于芽孢杆菌高产胞外多糖的碳源多为蔗糖。蔡淼等[14]优化甲基营养型芽孢杆菌产胞外多糖发酵条件时发现,质量浓度为20 g/L的蔗糖是最佳碳源条件。周璇等[15]实验后确定地衣芽孢杆菌II4-01胞外多糖积累最佳碳源条件为25 g/L蔗糖。
深入探究蔗糖添加量对胞外多糖积累影响,结果如图3-b所示。当蔗糖质量浓度为4 g/L时,胞外多糖产量达最大值(150.61 mg/L)。当继续增加蔗糖浓度,产糖量不再增加,进入平台期。考虑经济效益,选择4 g/L 蔗糖为最佳碳源量。
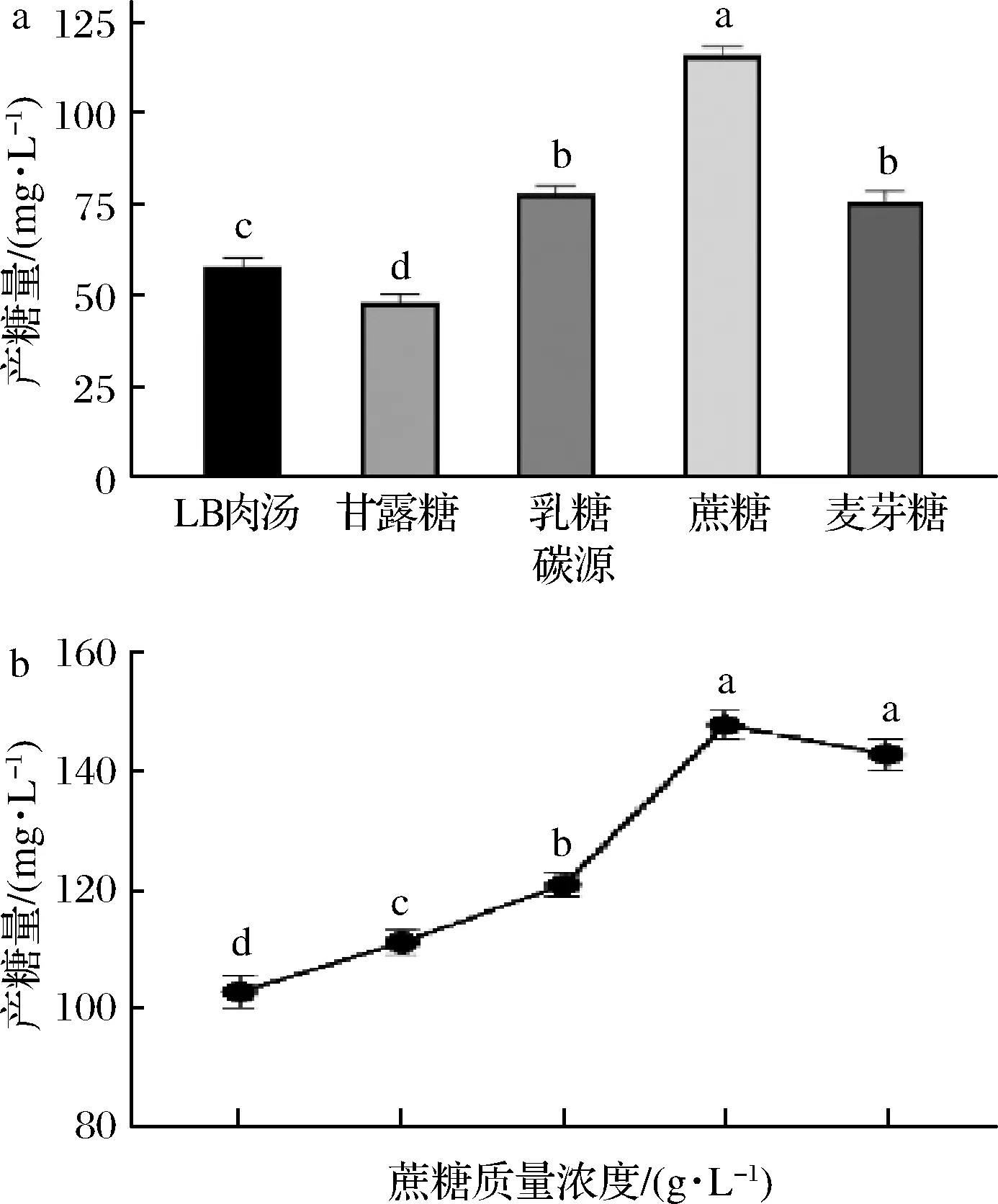
a-碳源种类对EPS产量的影响;b-蔗糖质量浓度对EPS产量的影响图3 碳源对EPS产量的影响Fig.3 Effect of carbon sources on the yield of EPS
2.2.2 氮源选择
氮源是微生物合成蛋白质和核酸所不可缺少的原料。研究表明,乳酸菌LPC-1的最佳氮源为大豆蛋白胨[16];解淀粉芽孢杆菌PB6产EPS最优培养基成分之一为2.5 g/L酵母提取物[17]。本实验设计5组氮源组合与LB肉汤培养基作对比,探究氮源组合对DMBA-K4的EPS产量作用,结果如图4-a所示。胰蛋白胨+酵母粉组的EPS产量最高,达158.21 mg/L,是LB肉汤培养基的2倍。
图4-b为该组合的配比对EPS产量影响的结果。解淀粉芽孢杆菌利用酵母粉生产胞外多糖的能力较强,随着酵母粉含量的增加,EPS逐渐积累。当其质量比为5∶10时,EPS积累能力最强。过量的酵母粉不利于EPS的生产,可能是由酵母粉对菌体的渗透压胁迫作用造成的。
因此在后续发酵条件研究中,以4 g/L 蔗糖、5 g/L胰蛋白胨、10 g/L 酵母提取粉、5 g/L NaCl为DMBA-K4培养基配方。

a-氮源组合对EPS产量的影响;b-胰蛋白胨与酵母粉比例对EPS产量的影响图4 氮源对EPS产量的影响Fig.4 Effect of nitrogen sources on the yield of EPS
2.2.3 发酵时间影响
发酵时间是影响微生物EPS积累的一个重要因素。发酵时间太短,菌体只能进行个体生长,无法完成EPS的积累;发酵时间过长,环境中的酶系有可能分解EPS,影响产糖效率[18]。由图5-a可知,EPS产量随发酵时间逐渐增加,在18 h时积累的EPS达到最大值164.62 mg/L。随发酵时间继续延长,EPS产量出现下降趋势。该变化趋势与许多研究结果一致[19-20],但相应的时间却不尽相同,说明针对不同的菌株选择合适的发酵时间是积累EPS的重要基础。
2.2.4 发酵初始pH影响
合适的pH可使相关酶系保持较高活性,有利于微生物次级代谢产物的产生和积累[21]。本实验将pH变量设为6~8,结果如图5-b所示。随着pH从弱酸性向中性过渡,EPS产量不断增加并在pH为7.5时达到最大值169 mg/L。中性环境更有利于DMBA-K4的EPS积累。
2.2.5 接种量影响
如图5-c所示,当接种量为1%时,菌体生长繁殖速率较低,代谢产物积累较少。接种量为2%~4%时,菌体可利用的营养物质丰富、生长速率较快,EPS生产能力快速提高。当接种量为5%时,菌体出现营养竞争,合成EPS能力下降。该结果与刘刚等[22]、RAZA等[23]报道一致。
2.3 响应面试验结果
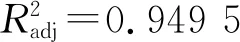
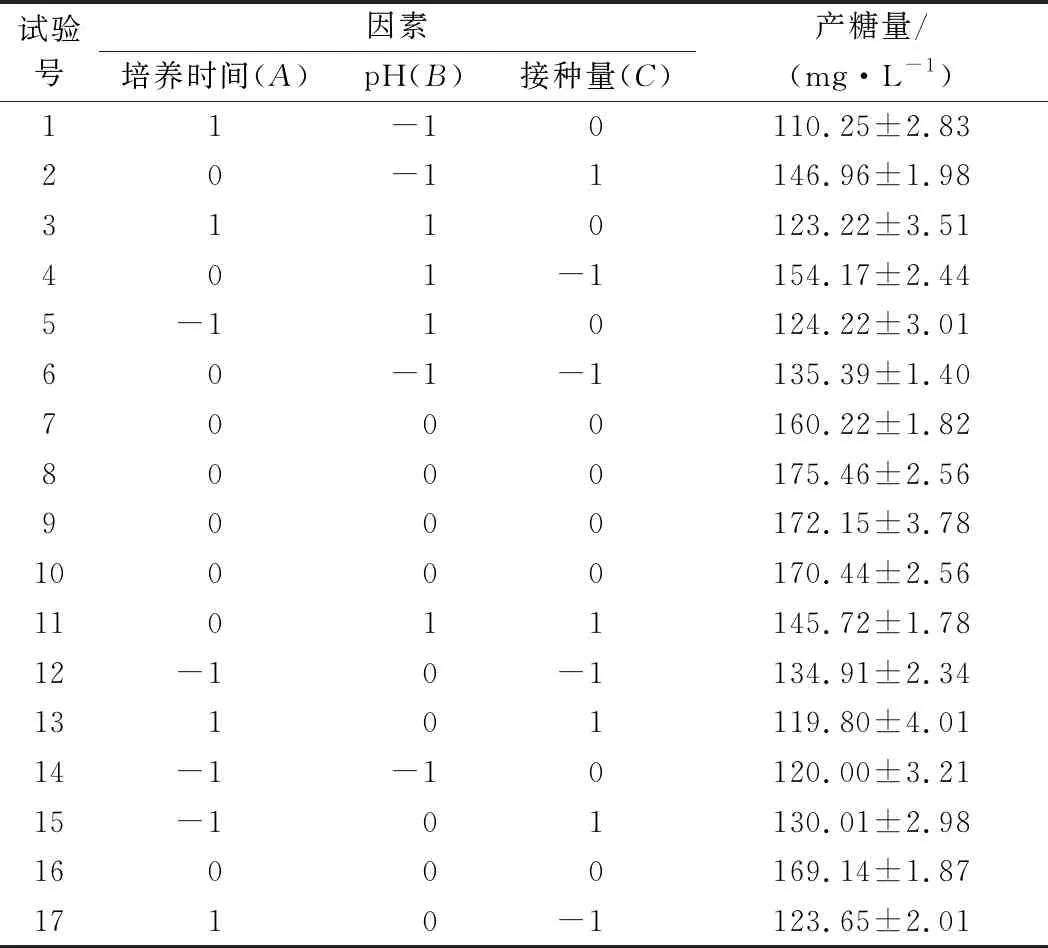
表2 响应面试验设计及结果Table 2 Response surface test design and results
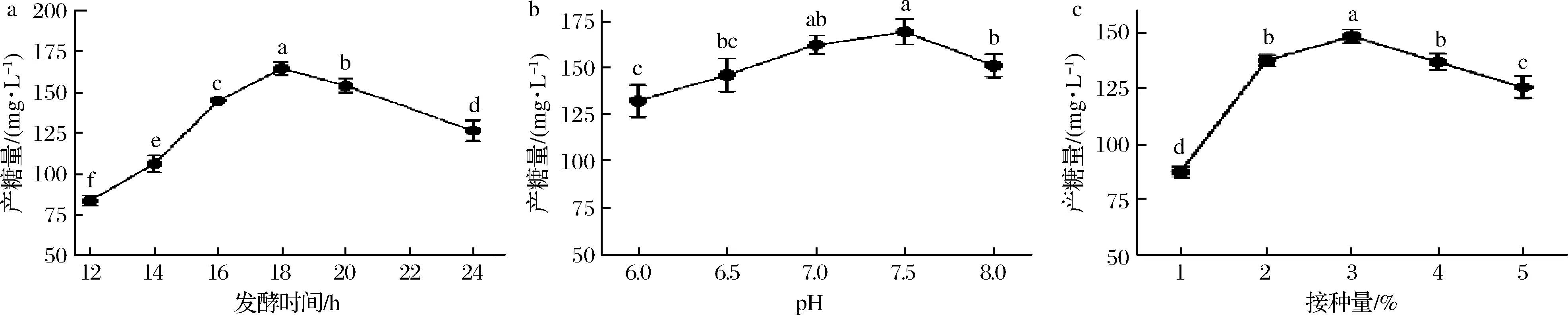
a-发酵时间;b-发酵初始pH;c-接种量图5 三因素对EPS产量的影响Fig.5 Effect of each factors on the yield of EPS
2.4 各因素之间响应面交互作用分析
图6反映各因素间的交互作用,当固定其中一个因素水平为0时,另外2个因素的相互作用强弱可以通过等高线图来表示,形状越趋近于椭圆则表明交互作用显著。结果表明,各因素间相互作用等高线均为椭圆形,因此可认为各因素间交互作用强。
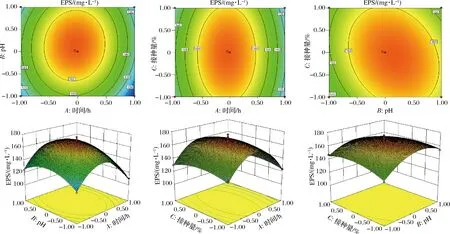
图6 各因素间对EPS产量的等高线图和响应面图Fig.6 Contour and response surface about the effects of two factors on the yield of EPS
根据Design Expert 软件分析并结合实际操作性可知:高产EPS的优化发酵条件为发酵时间18 h、pH 7.6、接种量3.10%,理论EPS产量为169.94 mg/L。在此基础上进行验证试验,经3次平行实验得DMBA-K4的EPS产量为(171.31±2.13) mg/L,与理论值的误差为0.80%,证明本试验优化获得的发酵条件结果正确,具有实践意义。
2.5 EPS体外抗氧化性分析
本实验从3个方面测定菌株DMBA-K4胞外多糖的体外抗氧化性,分别是DPPH自由基清除率、·OH清除率和总还原力,并以抗坏血酸为阳性对照(图7)。
DPPH被广泛应用于评价天然化合物的自由基清除能力,其途径抗氧化剂与DPPH自由基的单电子结合,形成稳定的DPPH[24]。如图7-a所示,DMBA-K4的EPS对DPPH具有一定的清除能力并与其质量浓度呈正相关。当EPS质量浓度为5 mg/mL时,其DPPH自由基清除率达78.60%。在相同EPS浓度下,比较益生菌PediococcuspentosaceusM41和野生型Lactobacillusdelbureckii的DPPH清除率分别为69.94%[25]和68.60%[26]。相较之下,DMBA-K4的EPS具有更强DPPH清除能力,这与其单糖组成、特定官能团含量以及供氢能力相关。
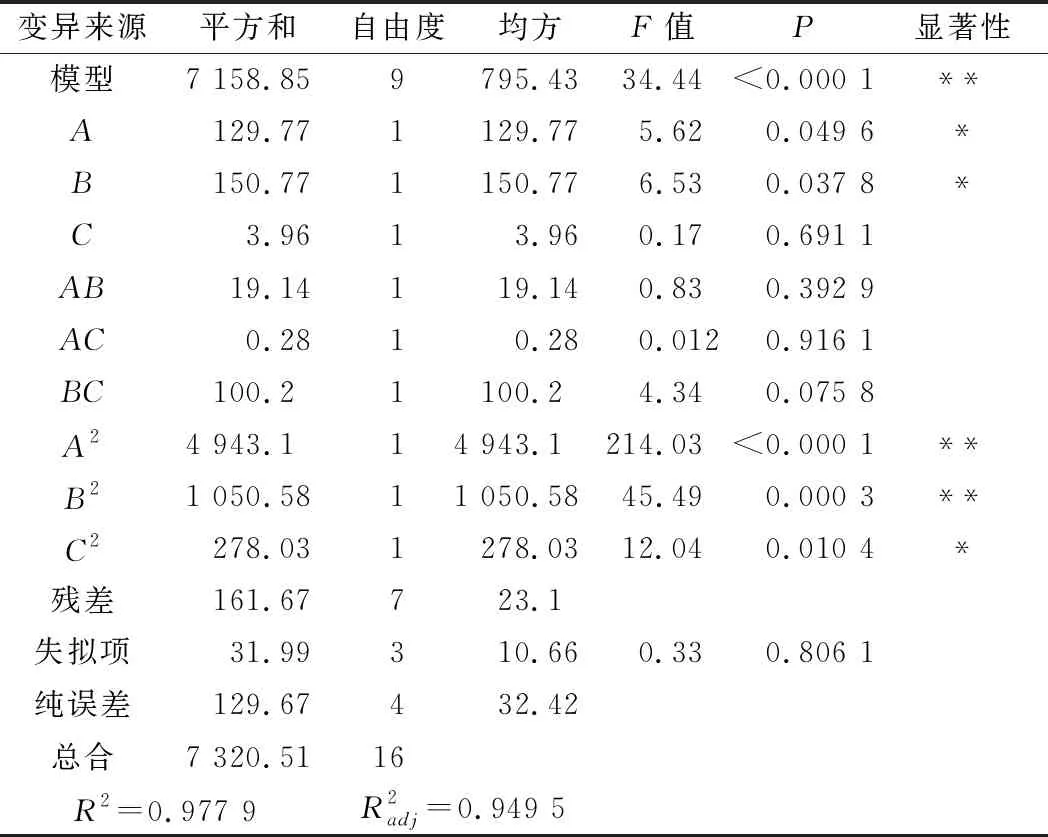
表3 回归模型方差分析结果Table 3 Variance analysis results of regression model for response surface test
·OH是活性氧中最有害的自由基,对人体核酸、碳水化合物等大分子具有较强破坏作用[27]。1~4 mg/mL EPS对·OH清除能力远低于抗坏血酸,但当质量浓度达5 mg/mL时,清除率可达75.47%,展现出良好的抗氧化性(图7-b)。WANG等[28]发现从Umbilicariaesculenta提取的EPS在4 mg/mL时·OH清除率为67.54%,孙建瑞等[29]发现C.vulgaris224的EPS仅在30 mg/mL时对·OH的清除率超50%。胞外多糖可以充当电子或氢供体,达到清除·OH的目的。
总还原力是评价化合物抗氧化性的重要指标之一。在本实验中,EPS的给电子能力随着将Fe3+/铁氰化物配合物还原成亚铁形式的过程而减弱,结果如图7-c所示。EPS的总还原力随质量浓度的增加而增强。在5 mg/mL时,OD700nm为0.40,低于抗坏血酸,这可能是EPS中缺失游离的醛基或酮基造成的。
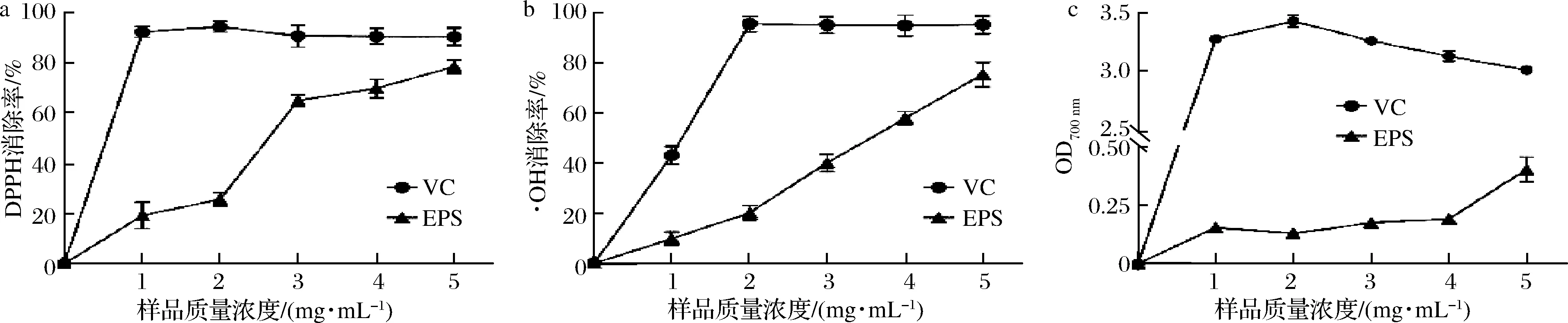
a-DPPH清除率;b-·OH清除率;c-总还原力图7 DMBA-K4胞外多糖的抗氧化活性Fig.7 Antioxidant activity of EPS produced by DMBA-K4
3 结论
针对1株从云南普洱茶中分离的产EPS的菌株,经16S rDNA鉴定为解淀粉芽孢杆菌DMBA-K4。目前对EPS的研究主要是关于乳酸菌的,而关于解淀粉芽孢杆菌的EPS研究较少。本实验通过单因素实验及响应面试验优化其高产EPS的发酵条件,结果为4 g/L 蔗糖、5 g/L胰蛋白胨、10 g/L 酵母提取粉、5 g/L NaCl、发酵时间18 h、pH 7.6、接种量3.10%。优化后,EPS产量为171.31 mg/L,提高155.7%。评价得到的粗多糖的体外抗氧化性,结果表明,该EPS对DPPH自由基和·OH具有明显清除效果,也具有一定的总还原能力。新型的生物活性多糖在化工、药物、食品等工业领域具有良好的应用前景,微生物发酵比传统的种植具有更高的效率和经济效益。因此,解淀粉芽孢杆菌DMBA-K4产的EPS在功能食品研发等领域具有潜在的应用价值。
