五苓散治疗非酒精性脂肪性肝病的网络药理学研究和实验验证
2020-12-02林军苏林红叶小丹朱小区王天娇
林军 苏林红 叶小丹 朱小区 王天娇
1.温州市中医院 浙江,温州 325000 2.辽宁中医药大学附属医院
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种与遗传易感及胰岛素抵抗(insulin resistance,IR)密切相关的代谢应激性肝损伤[1-2]。作为全球最常见的慢性肝病,其成人患病率在6.3%~45%[3]。现代医学对NAFLD发病机制仍未完全阐明,因此治疗尚缺乏理想药物。而中医药治疗具有改善症状、保肝降酶、长期治疗或可逆转脂肪肝等方面的独特优势,临床已广泛用于NAFLD的防治,而且效果显著[4]。五苓散出自张仲景《伤寒论》,具有利水渗湿、温阳化气之功用,临床研究证实五苓散治疗NAFLD疗效显著[5-6],但其作用机制尚未明确。网络药理学是将化学信息学、生物信息学、传统药理学和生物网络、网络分析整合到一起的一种新的药理学研究方法。基于网络药理学对中药复方的有效成分-活性靶点-疾病靶点进行综合网络构建,能够使中药药理学特征概括更为全面,同时也符合中药复方多成分、多靶点、多途径的作用特点[7]。本研究基于网络药理学研究方法对五苓散治疗NAFLD的有效成分、活性靶点、潜在机制进行探讨,并进一步进行动物实验加以验证,以期为五苓散的药理作用研究和临床应用提供更多实验依据。
1 材料和方法
1.1 五苓散中有效成分筛选及靶点预测 通过中药系统药理学数据库与分析平台 (traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)对五苓散有效成分进行初步筛选,其中筛选条件为类药性(drug likeness,DL)≥0.18、口服生物利用度(oral bioavailability,OB)≥30%。 同时对筛选出的有效成分进行靶点预测,利用UniProt对筛选出的靶点蛋白进行名称标准化。
1.2 NAFLD疾病靶点的获取 以 “non-alcoholic fatty liver disease”作为关键词,检索GeneCards、在线人类孟德尔遗传 (online mendelian inheritance in man,OMIM)等数据库并进行筛选,获取NAFLD疾病靶点。
1.3 核心靶点筛选及蛋白质相互作用网络构建 将五苓散-NAFLD靶点进行映射,利用韦恩图在线平台(https://bioinfogp.cnb.csic.es/tools/venny/index.html) 筛选核心靶点。利用STRING数据库在线平台(http://string-db.org/)构建核心靶点的蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,筛选条件设置:种属选择人类、PPI分数为0.4。
1.4 富集分析 将筛选后的核心靶点上传至Cytoscape 3.7.1软件,建立化合物-疾病-靶点调控网络,以展现五苓散对于NAFLD的作用关系。为了说明核心靶点蛋白在基因功能中的作用,本研究利用DAVID数据库对核心靶点进行基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书 (Kyoto Encyclopedia ofGenes and Genomes,KEGG)通路富集分析,物种限定为人类,阈值设定为P<0.05,利用OmicShare云平台(https://www.omicshare.com/)将数据结果可视化。
1.5 动物实验
1.5.1 实验动物 无特殊病原体(specific pathogen free,SPF)级雄性SD大鼠30只,体质量180~220g,购于辽宁长生生物技术有限公司[实验动物生产许可证号码:SCXK(辽)2010-0001],饲养于辽宁中医药大学附属医院中医药试验中心[实验动物使用许可证号码:SYXK(辽)2019-0004]。
1.5.2 实验药品与仪器 五苓散剂量参照全国中医药行业高等教育“十三五”规划教材《方剂学》,70kg成人临床剂量为泽泻15g、猪苓9g、桂枝6g、茯苓9g、白术9g。以上药物均购置于辽宁中医药大学附属医院,将上述药材晾干并研磨成细粉,并用120目筛筛选备用。用药剂量依据人与动物用药剂量体表面积换算法进行计算,配制成0.504g·mL-1的药液,实验前1d以0.9%氯化钠注射液将其配制成所需浓度。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、p53蛋白、白细胞介素-17(interleukin-17,IL-17)酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测试剂盒均购于武汉菲恩生物科技有限公司 (批号:ER1393、ER0394、ER0035);罗氏cobas8000全自动生化分析仪及配套检测试剂总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)均购自于罗氏诊断产品有限公司。Epoch型全波长酶标仪购于美国BioTek公司;TDZ5-WS低速离心机为湘仪离心机仪器有限公司产品。
1.5.3 模型制备 30只大鼠适应性饲养1周后,按随机数字表法分为空白组10只和造模组20只,空白组予普通饲料喂养,造模组予高脂饲料(基础饲料88%、猪油10%、胆固醇1.5%、胆盐0.5%)喂养。按照文献[8]造模方法进行验证,随机选取3只大鼠进行肝脏苏木精-伊红(hematoxylin-eosin,HE)染色与血脂测定,发现造模组大鼠在第8周末达到NALFD诊断标准,遂结束造模。而后将造模组大鼠随机分为模型组与中药组,每组各8只。
1.5.4 实验方法 造模成功后,中药组予五苓散浓缩液灌胃,依据前期研究确定的最佳给药剂量,灌胃剂量为0.52g/kg;空白组及模型组予等量0.9%氯化钠注射液灌胃。3组大鼠连续灌胃28d,每日早晚各1次。
1.5.5 指标检测 处死大鼠,采集腹主动脉血及肝组织。采用罗氏全自动生化分析仪测定大鼠血清TC、TG、LDL-C水平;采用双抗体夹心ELISA检测大鼠肝组织中TNF-α、p53、IL-17表达水平,操作严格按照试剂盒说明书进行。取新鲜肝组织行HE染色以观察肝组织病理学变化。
1.6 统计学分析 采用SPSS 19.0统计软件进行统计学分析,计量资料以x±s表示,组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 五苓散中有效成分筛选和靶标预测结果 根据DL、OB参数在TCMSP中进行筛选,共得到五苓散中茯苓、猪苓、泽泻、白术、桂枝的有效成分46个,其中有19个有效成分未预测到对应靶点,最终获得有效成分27个,有效成分对应的靶点蛋白62个。
2.2 NAFLD疾病靶点筛选结果 通过检索GeneCards、OMIM数据库,检出与NAFLD相关的已知靶点分别为1 256个、493个,删除检索结果中重复靶点后共纳入1 732个与NAFLD发生发展相关的靶点。
2.3 核心靶点筛选及PPI网络构建结果 利用韦恩图在线平台将1 732个NAFLD疾病靶点与62个五苓散有效成分作用靶点进行映射,并绘制韦恩图,筛选得到五苓散治疗NAFLD的核心靶点28个。输入STRING数据库在线平台,分析得到PPI网络图。见图1。在PPI网络图中,共有27个节点(节点代表靶点)、83条边(边代表靶点间相互作用),最终筛选得到五苓散治疗NAFLD的核心靶点27个。

图1 五苓散治疗NAFLD的核心靶点PPI网络图Fig.1 PPI network of core target of Wuling San in the treatment of NAFLD
2.4 化合物-疾病-靶点调控网络构建结果 将27个核心靶点、9个有效成分、中药(茯苓、猪苓、泽泻、白术、桂枝)和疾病(NAFLD)导入Cytoscape 3.7.1软件,以构建化合物-疾病-靶点调控网络。网络中共包含36个节点 (包括27个核心靶点节点以及9个有效成分节点)以及42条边,其中紫色三角形节点代表有效成分,绿色椭圆形节点代表靶点。见图2。

图2 五苓散治疗NAFLD的化合物-疾病-靶点调控网络图Fig.2 Component-disease-target regulatory network of Wuling San in the treatment of NAFLD
2.5 GO功能富集分析结果 利用DAVID 6.8对27个核心靶点进行GO功能富集分析,共得到GO条目190个,其中生物过程(biological process,BP)条目140个、分子功能(molecular function,MF)条目28个、细胞组成(cellular component,CC)条目22个。见图3。GO功能富集分析结果显示,BP主要涉及脂质及雌二醇反应、细胞凋亡、细胞增殖等方面,MF主要涉及乙醇脱氢酶(alcohol dehydrogenase,ADH)活性、半胱氨酸内肽酶活性等方面,CC主要涉及等膜筏、突触前后膜、死亡诱导信号复合物等方面。

图3 五苓散治疗NAFLD的GO功能富集分析Fig.3 GO functional enrichment analysis of Wuling San in the treatment of NAFLD
2.6 KEGG通路富集分析结果 利用DAVID 6.8对27个核心靶点进行KEGG通路富集分析,共得到KEGG条目44个。见图4。KEGG通路富集分析结果显示五苓散治疗NAFLD的通路主要涉及细胞凋亡、TNF信号通路、p53信号通路、IL-17信号通路等。
2.7 动物实验验证结果

图4 五苓散治疗NAFLD的KEGG通路富集分析Fig.4 KEGG pathway enrichment analysis of Wuling Sanin the treatment of NAFLD
2.7.1 各组大鼠肝组织病理学变化比较 空白组可见肝细胞排列整齐,结构正常,无炎性浸润和坏死;模型组可见肝细胞排列紊乱,脂肪细胞空泡样变性及脂质沉积,出现明显炎性浸润和坏死灶;中药组可见脂肪浸润和少量脂肪细胞空泡,肝细胞炎性浸润和坏死灶显著减轻。见图5。
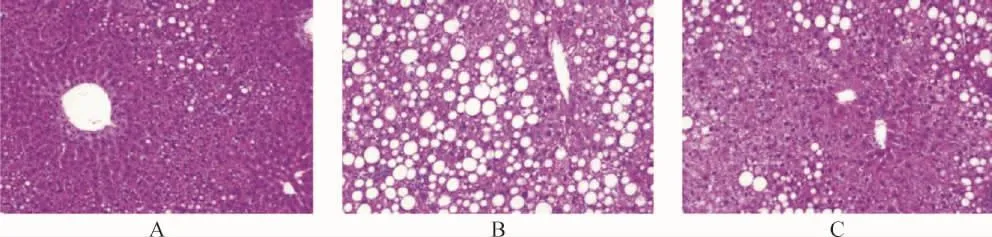
图5 各组大鼠肝组织病理学变化比较(HE染色,400×)Fig.5 Comparison of pathological changes of liver tissue in each group(HE staining, 400×)
2.7.2 各组大鼠血清TC、TG、LDL-C水平比较 与空白组比较,模型组大鼠血清TC、TG、LDL-C水平显著升高,差异具有统计学意义(P<0.01);与模型组比较,中药组大鼠血清TC、TG、LDL-C水平显著降低,差异具有统计学意义(P<0.01)。 见图6。
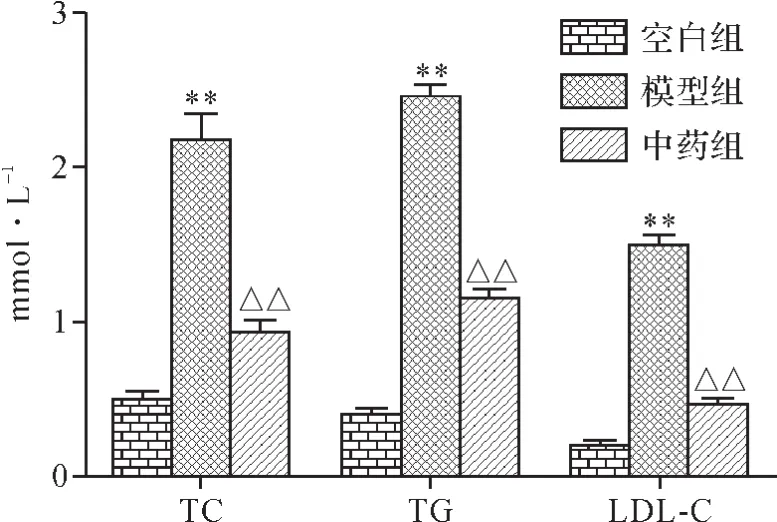
图6 各组大鼠血清TC、TG、LDL-C水平比较Fig.6 Comparison of serum TC,TG and LDL-C levels in each group
2.7.3 各组大鼠肝组织TNF-α、p53、IL-17水平比较 与空白组比较,模型组大鼠肝组织TNF-α、p53、IL-17水平显著升高,差异具有统计学意义(P<0.01);与模型组比较,中药组大鼠肝组织TNF-α、p53、IL-17水平显著降低,差异具有统计学意义(P<0.01)。见图7。

图7 各组大鼠肝组织TNF-α、p53、IL-17水平比较Fig.7 Comparison of TNF-α, p53 and IL-17 levels in liver tissue in each group
3 讨论
NAFLD不仅可以导致肝功能障碍残疾和死亡,还与代谢综合征、动脉硬化性心血管疾病、2型糖尿病及结直肠肿瘤等密切相关[9]。现代医学对NAFLD的治疗方法仍以改变生活方式及药物治疗为主,近年来针对NAFLD的药物研究仍未取得突破性进展,而中医药在NAFLD治疗方面具有独特优势。根据NAFLD的临床表现特点,历代医家将其归属于 “肝癖”“胁痛”“积聚”“肥气”“痰浊”等范畴,病因病机当责之嗜食肥甘厚味,肥甘之品易伤脾气,脾失健运,津液输布障碍,痰湿壅滞,三焦气化不利,湿浊内停愈甚,痰湿内蕴于肝,故发为本病,治当化气利水。五苓散具有利水渗湿、温阳化气之功用,方中泽泻甘淡,直走水腑,助肾与膀胱利水渗湿;二苓淡渗,通调水道,增强利水渗湿之力;白术燥湿,健脾助土,既可彰益土制水之效,又可奏输津四布之功;桂枝辛温,宣通阳气,蒸化三焦以行水,既外解太阳之表,又内助膀胱气化。五药合用,使水行气化,表解脾健,蓄水留饮自除。因此,为了深入了解五苓散的药理作用机制,本研究基于网络药理学对五苓散治疗NAFLD的潜在机制予以探讨,并进行动物实验验证,以期为临床应用提供实验依据。
本研究首先通过筛选挖掘出五苓散治疗NAFLD的核心靶点27个,进一步行化合物-疾病-靶点调控网络分析显示,β-谷甾醇、二氢槲皮素、3β-乙酰氧基苍术酮、常春藤皂甙元等药物有效成分能作用于网络中的多个靶点;前列腺素内过氧化物合酶2(prostaglandin G/H synthase 2,PTGS2)、 类视黄醇X受体α(retinoid X receptor alpha,RXRA)等靶点也能与多个药物有效成分形成作用关系,提示五苓散治疗NAFLD作用机制复杂多样,非通过单一靶点起效,具有多成分、多靶点的优势,PPI网络亦证实五苓散与NAFLD各靶点之间关系密切,研究结果可信度较高,参考价值较大。
通过对核心靶点进行GO功能富集分析及KEGG通路富集分析,初步预测出五苓散通过脂质反应、ADH活性等功能途径及TNF信号通路、p53信号通路、IL-17信号通路等多条通路途径发挥治疗NAFLD的作用。NAFLD病理过程中,大量脂质在肝细胞内沉积,IR则可通过促进胰岛素分泌过多,进而加快脂肪分解,导致脂肪在肝细胞内蓄积,与脂质代谢紊乱密切相关,是NAFLD发生发展的重要危险因素[10]。血清酶水平可反映各种肝病的肝细胞酶活性变化,ADH大量存在于肝脏内,可导致肝细胞内脂肪堆积、过氧化物产生增多、肠-肝轴代谢毒素增多,进而引发肝脏炎症,促进NAFLD发生发展[11]。ADH活性与肝细胞损伤严重程度相关,NAFLD患者的ADH活性显著高于健康人。研究证实NAFLD患者TNF-α表达水平显著增加,TNF-α可通过促进游离脂肪酸合成,导致脂肪肝;通过诱导炎性因子的释放,参与脂质过氧化及氧化应激过程,诱发肝脏炎症反应;还可通过激活细胞因子,调节细胞增殖、分化、坏死或凋亡,对脂类代谢过程产生影响[12]。p53作为肿瘤抑制因子,研究表明p53信号通路对于NAFLD的发生发展具有重要作用[13],既可调控肝细胞凋亡,又可调节肝组织氧化应激及脂质代谢,还可调节肝细胞衰老过程;此外p53信号通路与IR、炎症反应、细胞周期阻滞等也联系密切[14-15]。IL-17作为炎症介质,可诱导其他炎症因子、基质金属蛋白酶与单核细胞趋化蛋白质过度表达,从而引起炎性细胞浸润和组织损伤;同时可参与中性粒细胞的增殖、成熟和趋化,以发挥免疫调节功能[16]。IL-17与NAFLD发病的关系主要包括IR、氧化应激、核因子-κB(nuclear factor-κB,NF-κB)信号通路的激活及肝内巨噬细胞表达等方面[17]。
为了验证网络药理学分析结果,本研究进一步研究了五苓散对NAFLD模型大鼠肝组织病理学形态、血清脂质代谢水平、肝组织TNF-α、p53、IL-17表达水平的影响,结果表明五苓散能够降低NAFLD模型大鼠脂质代谢水平,抑制肝组织TNF-α、p53、IL-17表达,抑制炎症反应和减少细胞变性以保护肝细胞,从而达到治疗目的。
综上所述,五苓散治疗NAFLD具有多成分、多靶点、多途径的特点,其主要通过脂质反应、ADH活性等功能途径以及TNF信号通路、p53信号通路、IL-17信号通路等多条信号通路发挥作用,以起到控制NAFLD发生、发展的作用;进一步经动物实验证实,五苓散能够减轻NAFLD模型大鼠脂质代谢紊乱,调控肝组织TNF-α、p53、IL-17表达水平可能是其作用机制之一。本研究结果为后续研究五苓散治疗NAFLD的作用机制提供了实验依据,也为未来探讨中医药科学性提供了研究方法。
