葡萄行内覆盖对土壤细菌群落结构的影响
2020-12-02徐国前张军翔
刘 思 徐国前 张军翔
(1 宁夏大学农学院,宁夏 银川 750021;2 宁夏大学葡萄酒学院,宁夏 银川 750021)
土壤微生物是反映土壤质量的重要指标,能对土壤环境变化迅速做出反应[1],直接影响土壤有机质、土壤团粒结构的形成,在土壤生态系统的稳定性及多样性上有着不可替代的作用[2-4]。宁夏贺兰山东麓产区葡萄园长期采用清耕的土壤管理方法,使葡萄园土壤完全裸露,导致夏季土壤温度过高,土壤干燥,不利于土壤微生物的生长和团粒结构的形成[5],这对于土壤生态脆弱的地区,无疑是雪上加霜。此外,葡萄在冬季修剪中产生大量枝条,冬剪葡萄枝条中含有丰富的N、P、K元素和大量的生物质能源,是土壤养分的重要来源,而这些枝条多被丢弃或焚烧。如何经济有效的将这些有机资源应用到葡萄园是宁夏贺兰山东麓产区急需解决的重要问题。
枝条还田作为一种新型的土壤管理措施,目前在果园已有应用。研究表明,修剪枝条还田能为土壤微生物提供丰富碳源,有利于土壤微生物的繁殖[6]。另外,枝条覆盖还田能降低地表蒸发量[7-8],达到改善土壤含水量的作用,并且能促进有机物的分解,提高土壤的养分含量[9-10]。宁夏玉米栽培面积广,玉米秸秆产生量大,葡萄园多将玉米秸秆进行还田,而葡萄冬剪枝条多被丢弃或焚烧,未得到有效的利用。在该产区的土壤和气候条件下,葡萄冬剪枝条还田对土壤微生物群落影响的研究也尚不明确。因此,本研究将葡萄冬剪枝条覆盖在葡萄园行内,同时设置玉米秸秆覆盖处理,并以清耕为对照,利用高通量测序技术测定土壤细菌群落结构,以期了解葡萄冬剪枝条覆盖对土壤细菌群落结构的影响,从而为推广应用葡萄冬剪枝条覆盖提供理论支持。
1 材料与方法
1.1 试验材料与试验地概况
试验地位于宁夏贺兰山东麓金山子产区的兰山云昊酒庄葡萄园(38°43′N,106°05′E),土壤类型为砾石土,主要栽培品种为欧亚种酿酒葡萄赤霞珠(CabernetSauvignon),于2013年定植,行株距4 m×0.8 m,南北行向,单篱架栽培,“厂”字形整形。
1.2 试验设计
试验设置3个处理,选择树体生长健壮,无病虫害,树势相对一致的植株,分别于2017年4月和2018年4月连续2年将粉碎的葡萄枝条和玉米秸秆分别覆盖在葡萄行内,分别为葡萄枝条覆盖处理(GC)和玉米秸秆覆盖处理(CS),粉碎程度均为2~3 cm的片状碎屑,覆盖厚度4 cm,宽度120 cm,以清耕为对照(CK),每个处理3行葡萄,每行200 m。各处理葡萄的夏季肥水、修剪、病虫害等管理措施均保持一致。
2018年10月3日,从3个处理的9个葡萄行内进行土样采集。每个行内随机选取3个点,用剖面刀从0~60 cm土层内取土,约200 g。其中,约10 g土放入无菌离心管中,并置于液氮内速冻,然后置于-80℃冰箱中保存,用于土壤细菌总DNA的提取;另一部分土样风干过筛,用于测定土壤理化性状。
1.3 测定项目与方法
1.3.1 土壤细菌总DNA的提取 土壤细菌总DNA的提取,按照FastDNA Spin Kit for Soil(美国MP)试剂盒按说明书进行操作。提取的DNA经琼脂糖凝胶电泳检测DNA样品的完整性,然后将提取的DNA溶液置于-80℃保存。
1.3.2 细菌高通量测序 以DNA为模板进行PCR扩增,引物为16S rRNA V3区带有Barcode的特异性引物342F(5’-CCTACGGGAGGCAGCAG-3’)和518R(5’-ATTACCGCGGCTGCT-3’)。PCR反应体系为TaKaRa ex Taq 0.25 μL,10×buffer 2.5 μL,dNTPs 2 μL,上下游引物各1 μL,gDNA(5 ng·μL-1) 3 μL,水15.3 μL。反应条件:94℃预变性5 min;94℃变性30 s, 58℃退火30 s,72℃延伸1 min,30个循环;72℃补充延伸5 min。PCR产物用2%的琼脂糖电泳检测,然后利用Ion Plus Fragment Library Kit建库试剂盒(美国life公司)对混合样品进行文库构建,通过86952 Qubit(上海费尔伯罗)检测文库浓度,Agilent 2200(安捷伦,中国)质检。质检合格后用IonS5测序仪(美国life公司)进行测序。
1.3.3 土壤理化性状测定 土壤碱解氮的测定采用碱解扩散法,速效磷的测定采用钼锑抗比色法,速效钾的测定采用原子吸收分光光度计法,有机质的测定采用重铬酸钾容量法[11],pH值采用PHS-3C酸度计(上海雷磁)测定。
1.4 数据处理
用Fast-QC(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)软件对测序数据的质量进行整体评估,去除低质量序列后,采用Usearch软件去除测序结果中的嵌合体序列(Chimera Sequence),然后得到可以用于后续分析的序列。采用QiiME算法中的Uclust聚类策略对所有序列进行聚类,并选取其中具有代表性的16S序列划分操作分类单元(operational taxonomic unit,OTU),利用Silva数据库(https://www.arb-silva.de/)对测序结果进行比对分析,并对分析结果进行Alpha多样性分析;采用IBM SPSS Statistics 19软件进行方差分析和相关性分析;采用Duncan’s检验进行多重差异显著分析。
2 结果与分析
2.1 测序数据分析
图1为3种处理序列数与其所代表的OTU数目构建的稀释性曲线,结果表明,GC、CS和CK的有效序列分别为103 653、103 152、104 033条。3种处理的土壤样品随序列量的增加,OTU数目不断上升,但有趋于平缓的趋势,这说明有些物种未被测定出来,但土壤微生物样品有效序列一般为60 000~70 000条就基本涵盖绝大部分物种信息。此外,结合表1可知,不同覆盖处理的覆盖率值均大于86%,说明所测数据合理,能基本反应土壤微生物群落组成。
由图2可知,3种处理共有2 376个OTU,其中CS的OTU数目最多,为1 974个,GC有1 929个,CK只有1 838个,这说明CS的土壤微生物类群最丰富,CK的土壤微生物类群最少。另外,GC、CS和CK共有的OTU数为1 523个,占总OTU数的64.1%,表明3种处理的土壤微生物类群大部分是一致的,但整体来看,各处理之间还存在差异,其中GC与CS共有的OTU数为1 667个,与CK共有的OTU数为1 596, 说明GC与CS的土微生物类群一致性较高,与CK的土微生物类群一致性较低。
根据测序分析得到的物种注释信息进行Alpha多样性分析。由表1可知,GC和CS的ACE指数、Chao1指数均大于CK,说明2种覆盖处理增加了土壤微生物数量,但差异不显著,而CS的Shannon指数最大、Simpson指数最小、CK的Shannon指数最小,Simpson指数最大,且两处理之间均达到了差异显著水平,说明CS的土样微生物群落多样性最高,CK的土样微生物群落多样性最低。

图1 相似度为97%条件下不同土壤样品的稀释曲线Fig.1 Eoch of different soil samples dilution curves on the condition of 97% similarity

图2 属水平下细菌物种韦恩图Fig.2 The Venn map of bacterial community at genus level

表1 不同覆盖处理土壤样品微生物多样性指数分析Table 1 Analysis of microbial diversity index in the soil samples with different covering treatments

图3 不同覆盖处理土壤样品中细菌门组成Fig.3 Relative abundances of microbial phyla in different covering treatments
2.2 细菌群落结构分析
所有处理检测到的细菌分属于56个门,219个纲,536个目,981个科,2 376个属。图3为门水平上各处理细菌的分类,CS和GC土壤中变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和绿弯菌门(Chloroflexi)细菌相对丰度大于10%,是土壤中的优势菌落;而CK土壤中只有变形菌门、酸杆菌门、放线菌门和绿弯菌门细菌相对丰度大于10%。3种处理细菌相对丰度含量最多的均为变形菌门,分别在CS、GC和CK中占细菌相对丰度的25.5%、21.2%和14.3%;其次是酸杆菌门,分别在CS、GC和CK中占细菌相对丰度的19.0%、19.2%和12.5%。CS和GC中相对丰度第三的是放线菌门,第四是疣微菌门;而CK中相对丰度第三的是绿弯菌门,第四是放线菌门。另外,CS、GC和CK中细菌相对丰度大于1%的主要细菌门类分别有10、9和8个。
对各处理组间在丰度上有显著差异的物种进行线性判别分析(linear discriminant analysis,LDA)。如图4所示,由内至外辐射的不同圆圈层分别代表了由门至属的分类级别。各个节点代表该水平下的一个物种分类,该物种丰度越高节点越大。其中,黄色节点为无显著差异的物种。差异物种生物标记物则跟随分组进行着色,如红色节点表示在CS中起到重要作用的微生物类群。结果表明,CS中优势菌主要有7种,分别为芽胞杆菌科(Bacillaceae)、Gemmatimonadaceae、硫还原菌科(Desulfurellaceae)、噬纤维菌科(Cytophagaceae)、乳杆菌科(Lactobacillaceae)、理研菌科(Rikenellaceae)和Alistipes,而GC中只有一种优势菌为拟杆菌科(Bacteroidaceae),这说明CS和GC均可以提高土壤微生物多样性,但以CS效果最好。
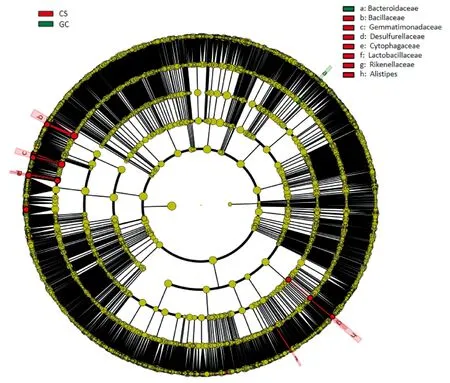
图4 不同覆盖处理土壤样品中细菌优势菌种分析Fig.4 Analysis of dominant bacterial species in soil samples with different covering treatments
2.3 葡萄园土壤细菌菌落与土壤理化性质
不同覆盖处理土壤理化性质如表2所示,该葡萄园土壤为碱性(pH值均大于8.2),不同覆盖处理间pH值差异不显著。与CK相比,CS和GC显著提高了土壤含水量,其中以GC提升效果较好,其土壤含水量为36.3%;另外,CS和GC也显著提高了土壤碱解氮、速效磷和有机质的含量,2种覆盖处理中以CS提升效果较好,分别较CK增加了32.0%、37.8%和36.9%。但不同处理间土壤速效钾含量差异不显著。
由表3可知,变形菌门丰度与碱解氮、有机质含量呈显著或极显著正相关;酸杆菌门丰度与pH值呈显著负相关;放线菌门丰度与速效磷、有机质含量呈显著正相关;疣微菌门丰度与土壤理化性状无显著相关性;而绿弯菌门丰度与有机质含量呈显著负相关。
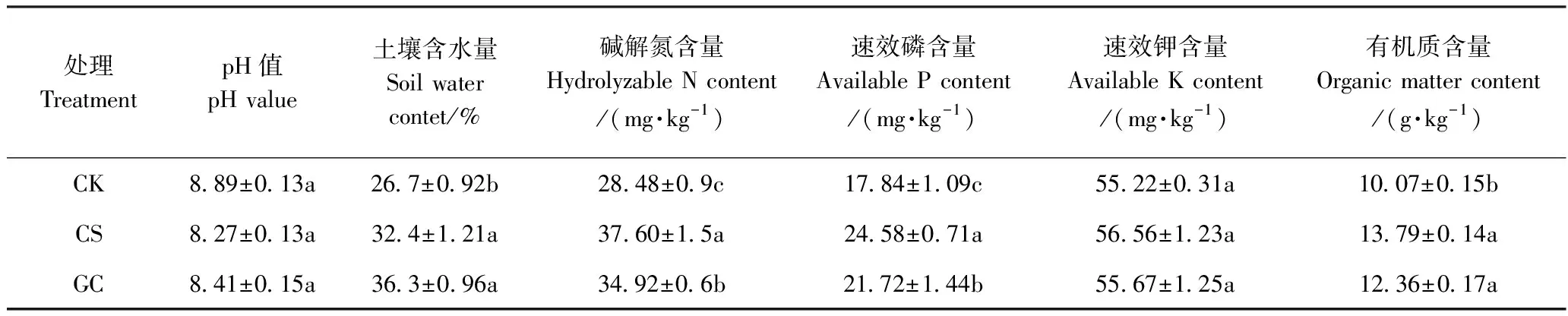
表2 不同覆盖处理土壤理化性质Table 2 Soil physical and chemical properties with different mulching treatments
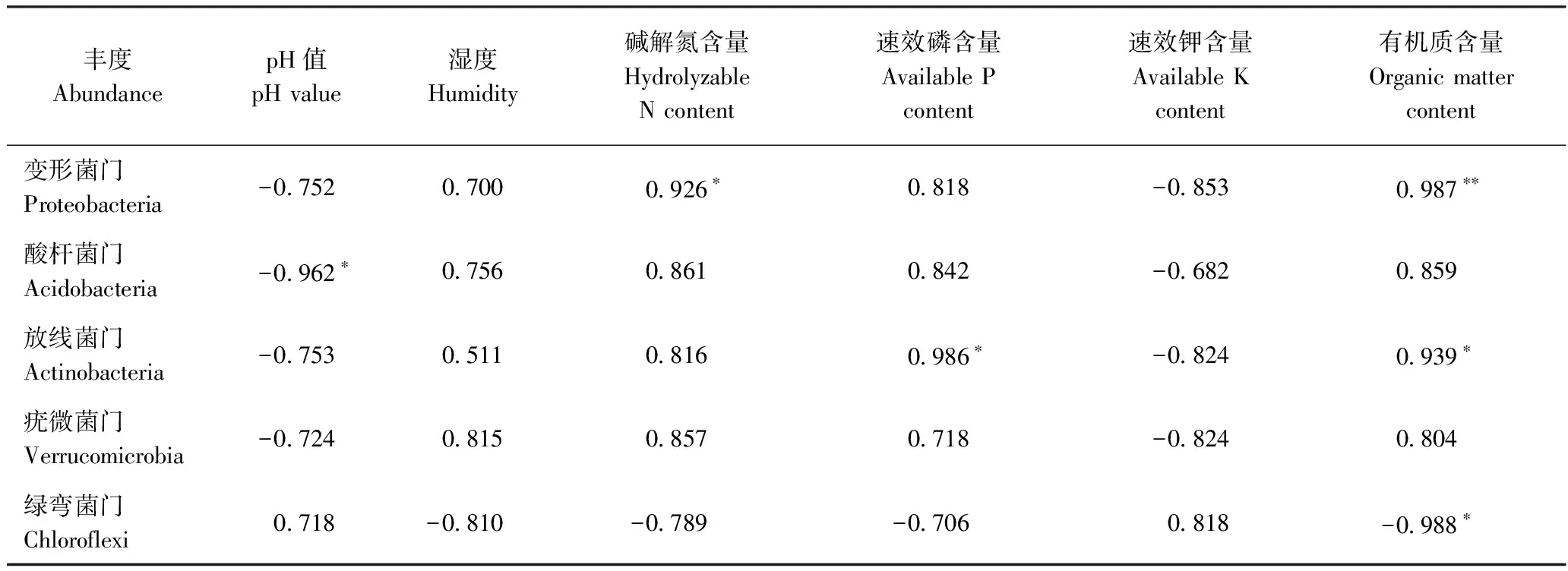
表3 细菌菌落与土壤理化性状的相关关系Table 3 Correlation between bacterial and soil physical and chemical properties
Note:*and**indicate the correlation was significant and extremely significant at 0.05 and 0.01 level, respectively.
3 讨论
土壤微域生态环境由植物、土壤微生物和土壤三者共同作用而成。土壤微生物群落结构多样性在维持生态系统功能上有着重要作用[12-14]。研究表明,土壤有机质的降解、转化和养分的循环都是在土壤微生物的参与下完成的[15],且土壤微生物随土壤环境的改变而改变,能及时反映土壤的肥力状况,并最终影响植物的生长[16-18]。本试验结果表明,宁夏贺兰山东麓产区葡萄园覆盖葡萄枝条和玉米秸秆均可以提高土壤微生物菌落的丰度和多样性。3种处理中变形菌门、酸杆菌门、放线菌门和绿弯菌门均为优势菌群,说明土壤虽然有不同的覆盖处理,但处于相同生境中的土壤微生物类群具有相似性,这与刘洋等[19]的研究结果相似。而在优势菌群丰度上3种处理存在明显差异,与CK相比,CS和GC分别提高了土壤变形菌门、酸杆菌门和放线菌门的丰度,这可能是由于葡萄园覆盖显著提高了土壤有机质含量,而变形菌门和放线菌门与有机质含量呈显著或极显著正相关[20],即土壤有机质含量越高变形菌门丰度越高[21]。另外,葡萄园覆盖降低了土壤pH值,而酸杆菌门具有嗜酸性,其丰度受pH值影响,土壤pH值降低有利于其生长[22-23]。但与CK相比,CS和GC降低了土壤绿弯菌门的丰度,这可能是由于绿弯菌门是一类利用二氧化碳,并通过光合作用产生能量的细菌,这种特性使得绿弯菌门在有机质含量较低的土壤中具有优势[24]。
利用LDA分析发现,2种覆盖处理显著增加的优势菌群大部分为有益微生物,如芽胞杆菌科在土壤中具有固氮作用[25];硫还原菌科对土壤硫循环具有重要作用[26];噬纤维菌科是一种纤维素分解菌,具有较强的分解纤维素能力;而拟杆菌科相对丰富度与有效磷含量呈显著正相关[27-28]。此外,这些微生物在改善果实品质方面也具有重要作用[29],如芽孢杆菌是植物促生菌,可提高果树叶绿素含量,从而提高果实可溶性糖和可溶性蛋白的含量[30]。
4 结论
本研究通过对宁夏贺兰山东麓葡萄园不同材料覆盖下土壤细菌群落结构的分析可知,在宁夏贺兰山东麓产区的土壤和气候条件下,葡萄枝条覆盖和玉米秸秆覆盖均提高了土壤细菌的多样性,主要增加了土壤中变形菌门、酸杆菌门和放线菌门等细菌群落的丰度。这些细菌在提高土壤养分方面具有一定作用。2种覆盖处理中以玉米秸秆覆盖较好,但考虑到葡萄园冬季修剪产生大量的枝条,提供了充足的覆盖材料,因此葡萄枝条覆盖也具有较高的可行性。
