不同氮高效玉米品种对氮素的吸收转运和代谢研究
2020-12-02韩金玲姚丹丹周印富王文颇吴振兴
王 健 韩金玲 杨 敏 姚丹丹 周印富 王文颇 吴振兴 杨 晴,*
(1 河北科技师范学院农学与生物科技学院,河北 秦皇岛 066600; 2 浙江省农业科学院玉米与特色旱粮研究所,浙江 金华 322100)
氮是植物生长发育所必需的营养元素[1]。氮肥作为农业生产中重要的外源投入品为作物增产增收做出了巨大贡献。然而,由于土壤淋溶、微生物消耗和反硝化作用等原因导致氮肥利用率显著下降[2-3]。据报道,中国的氮肥利用效率平均约为30%,西方发达国家平均约为50%~60%[4]。流失的氮肥会对周围的生态系统造成严重破坏,最终影响人类健康[5]。玉米的籽粒产量形成以及籽粒蛋白质含量与氮肥的合理施用及氮代谢调控过程紧密相关[6-7]。因此,合理利用氮肥是实现玉米绿色高效丰产的重要举措。
玉米籽粒氮素大部分来自营养器官中氮素的花后再转运[8]。研究表明,玉米吐丝后氮素向籽粒的转运量显著增加,同时,生育后期的氮素转运量直接决定着玉米的氮素利用效率和收获指数[9]。不同玉米品种吐丝前后的氮素同化能力存在较大差异,这种差异表现在不同品种对氮素的吸收、利用、转运和再分配上[10-11]。晁晓乐等[12]研究表明,随着施氮量的增加,低氮高效型玉米品种潞玉19的氮肥利用效率呈降低趋势。Yan等[13]研究表明,相较于掖单13,先玉335在吐丝后的干物质生产能力更强,秸秆氮素转移效率更高,因此籽粒拥有更高的氮含量。屈佳伟等[14]研究表明,在低氮或适量施氮条件下,相较于氮低效品种内单314,氮高效品种郑单958表现出较高的氮素吸收效率。可见,不同基因型品种的氮素利用效率存在较大差异。针对不同玉米品种的氮素积累、转运及氮素利用率,前人已从品种、基因型、遗传特性等方面进行了大量报道[15-16]。但有关不同氮高效型品种的氮素吸收及转运机制鲜有报道。本研究拟以低氮高效型玉米品种京农科728和高氮高效型玉米品种先玉335为试材,采取大田试验和温室盆栽试验,设置不同的施氮水平,并以冀东地区生产施肥量为对照,探讨减氮条件下玉米植株的氮素吸收转运效率、氮素同化途径关键酶活性和基因表达量在不同生育时期的演变特征,解析不同氮素需求品种氮肥高效利用的生理调控机制及遗传特征,为全力推进化肥减量增效及高效氮利用玉米品种的栽培与选育提供理论依据。
1 材料与方法
1.1 试验材料与试验地概况
试验于2018—2019年在河北科技师范学院昌黎试验站(40°40′N,118°95′E)进行。该区位于河北省东部,属于暖温带、半湿润大陆性气候,年均降水量为638.33 mm,年平均气温11℃,无霜期为186 d。试验地土壤类型为中壤土。2018年土壤理化性质为pH值7.78,含有机质21.54 g·kg-1、全氮1.51 g·kg-1、碱解氮134.67 mg·kg-1、速效磷10.58 mg·kg-1、速效钾85.02 mg·kg-1;2019年土壤理化性质为pH值7.73,含有机质19.08 g·kg-1、全氮1.68 g·kg-1、碱解氮102.35 mg·kg-1、 速效磷23.59 mg·kg-1、速效钾74.10 mg·kg-1。试验材料选取低氮高效型玉米品种京农科728和高氮高效型玉米品种先玉335,购自唐山集强农业科技有限公司,不同氮高效型玉米品种的选取参考周培禄等[17]和王荣焕等[18]的研究结果。
1.2 试验设计
1.2.1 田间试验 于2018—2019年在河北科技师范学院昌黎试验站进行氮肥试验。设置5个处理,NCK(360 kg·hm-2,本地生产施氮量)、N1(120 kg·hm-2,较NCK减氮66.66%)、N2(180 kg·hm-2,较NCK减氮50.00%)、N3(240 kg·hm-2,较NCK减氮33.33%)、N4(300 kg·hm-2,较NCK减氮16.66%)。氮肥以尿素控制,同时配施过磷酸钙(120 kg·hm-2)和氯化钾(45 kg·hm-2),肥料均以基肥方式施入。试验采用完全随机区组设计,3次重复。均采用井水灌溉以防止灌溉水中养分可能带来的干扰,其他同高产栽培管理,严格防治病虫害。玉米成熟采收后,分小区单收、单晒、单称,计算各小区产量。利用大田试验进行氮素含量和氮素代谢相关酶活性的测定。
1.2.2 温室盆栽试验 于2019年在河北科技师范学院昌黎试验场玻璃温室进行盆栽试验。试验处理设置与田间试验相同,每个施氮量处理种植10盆,其中装盆土壤取自昌黎试验站,为田间试验经过施肥处理的0~25 cm土层土壤装盆,土壤类型为中壤土,每盆土壤15 kg,分别于拔节期取第6片叶,大喇叭口期取第8片叶,抽雄吐丝期和灌浆期均取第12片叶,用液氮速冻,置于-80℃冰箱,用于基因表达量的测定。
1.3 测定项目与方法
1.3.1 氮素含量测定 于玉米主要生育期进行群体动态调查和取样,每小区连续选取3株具有代表性的植株,拔节期、大喇叭口期按茎秆、叶片和叶鞘3部分取样,抽雄吐丝期按茎秆、叶片、叶鞘、雄穗和雌穗5部分取样,灌浆期和成熟期按茎秆、叶片、叶鞘、雄穗、苞叶、穗轴和籽粒7部分取样。然后于105℃杀青30 min,80℃烘干至恒重。采用凯氏定氮法[19]测定玉米植株全氮含量。根据公式计算茎秆、叶片氮转运效率和茎秆、叶片氮转运对籽粒氮的贡献率:
茎秆氮转运效率=(吐丝期茎秆氮含量-成熟期茎秆氮含量)/吐丝期茎秆氮含量×100%
(1)
叶片氮转运效率=(吐丝期叶片氮含量-成熟期叶片氮含量)/吐丝期叶片氮含量×100%
(2)
茎秆氮转运对籽粒氮的贡献率=(吐丝期茎秆氮含量-成熟期茎秆氮含量)/成熟期籽粒氮含量×100%
(3)
叶片氮转运对籽粒氮的贡献率=(吐丝期叶片氮含量-成熟期叶片氮含量)/成熟期籽粒氮含量×100%
(4)。
1.3.2 酶活性测定 分别于玉米拔节期、大喇叭口期、抽雄吐丝期、灌浆期和成熟期取玉米叶片鲜样测定氮代谢相关酶活性。根据杨新泉等[20]的方法测定谷氨酰胺合成酶(glutamine synthetase,GS)活性;根据赵世杰等[21]的方法测定硝酸还原酶(nitrate reductase,NR)活性;根据Ozawa等[23]的方法测定亚硝酸盐还原酶(nitrite reductase,NiR)活性;根据Górny等[23]的方法测定谷氨酸合成酶(glutamate synthase,GOGAT)活性;根据王佳[24]的方法测定天冬酰胺合成酶(asparagine synthetase,AS)活性。
1.3.3 基因表达量测定 氮代谢相关酶基因序列通过GeneBank、www.maizegdb.org和www.ncbi.nlm.nih.gov/获得。根据数据库中的基因序列利用Primer Premier 5设计基因引物,在NCBI上进行引物序列比对,保证其专一性,内参基因为GADPH(详见表1)。采用TaqSYBR©Green qPCR测试盒(TaKaRa,日本)进行实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)。反应体系为:10 μL SYBR、0.8 μL上游引物、0.8 μL下游引物、0.4 μL ROX Reference Dye、6 μL 灭菌水,将反应体系混匀后加入2 μL稀释10倍的cDNA模板。反应程序为95℃预变性30 s;95℃变性5 s,60℃扩增30 s,循环40次。采用2-ΔΔct法计算目标基因相对表达量。

表1 引物序列Table 1 Primer sequence
1.4 数据处理与分析
采用Microsoft Excel 2007进行数据整理,采用(SPSS)12.0软件进行SP的Duncan’s新复极差法进行差异显著性分析,采用SigmaPlot 12.5进行作图。
2 结果与分析
2.1 施氮量对玉米氮素利用的影响
2.1.1 施氮量对玉米氮素积累的影响 由表2可知,两品种氮素积累量均随着生育期的推进呈增加趋势。高氮高效型品种先玉335氮素积累量在拔节至抽雄吐丝期呈快速上升趋势,随后缓慢增长,灌浆至成熟期又快速增长;低氮高效型品种京农科728的氮素积累量在拔节至大喇叭口期快速增长,随后缓慢增长,灌浆至成熟期又快速增长。
高氮高效型品种先玉335在各生育时期氮素积累量对施氮量的响应规律存在差异(表2)。拔节期、大喇叭口期和抽雄吐丝期,随着施氮量的增加,先玉335的氮素积累量呈先增加后下降的趋势,其中,在拔节期,N3的氮素积累量最高;在大喇叭口期,N4的氮素积累量最高;在抽雄吐丝期,N2的氮素积累量最高,较NCK提高37.81%,且差异达到显著水平。灌浆期和成熟期,随着施氮量的增加,先玉335的氮素积累量呈双峰曲线,其中,在灌浆期,N4的氮素积累量最高,但各处理间差异未达到显著水平;在成熟期,N4的氮素积累量最高,较NCK显著提高54.87%。随着施氮量的增加,除灌浆期以外,各生育期的氮素积累量大致呈先升高后降低的趋势,其中,在成熟期,N2的氮素积累量最高,且显著高于NCK;在抽雄吐丝期和灌浆期,N3氮素积累量最高,但均与N2差异不显著。
2.1.2 成熟期玉米不同器官氮素分配 由图1可知,成熟期,不同施氮量下,两品种各器官氮素积累量分配规律大致表现为籽粒>叶片>茎秆>穗轴>叶鞘>苞叶>雄穗,其中籽粒为氮素积累的主要器官,高氮高效型品种先玉335中籽粒氮素积累占全株氮素积累量的64.31%~71.09%,低氮高效型品种京农科728中籽粒氮素积累占全株氮素积累量的67.47%~73.17%。
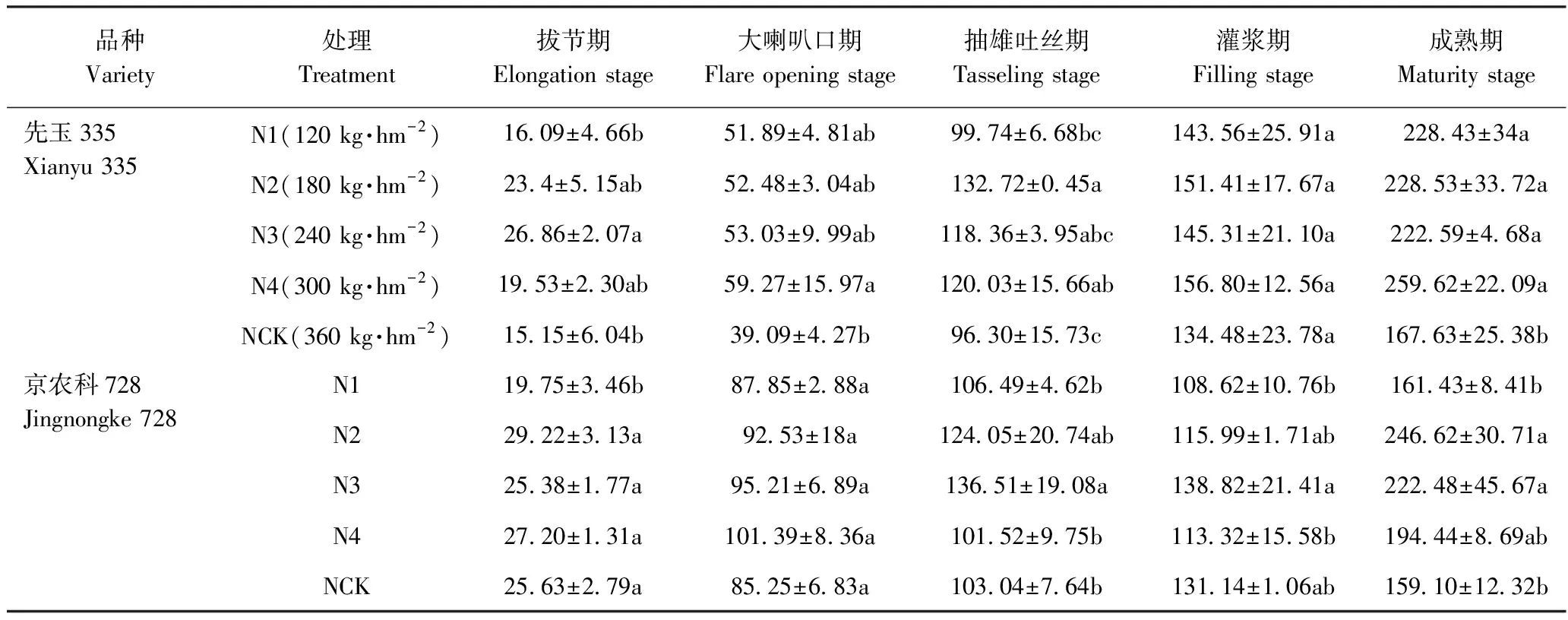
表2 施氮量对玉米不同生育时期氮素氮素积累的影响

图1 施氮量对玉米成熟期各器官氮素积累的影响Fig.1 Effects of nitrogen application rate on nitrogen accumulation in maize organs at maturity stage
在高氮高效型品种先玉335中,与NCK相比,N4显著增加茎秆、叶片和籽粒的氮素积累量(P<0.05);N3显著增加叶鞘和雄穗的氮素积累量(P<0.05)。在低氮高效型品种京农科728中,与NCK相比,N2显著增加茎秆、叶鞘、雄穗和籽粒的氮素积累量(P<0.05);叶片、苞叶和穗轴的氮素积累量在N3达到最大值,且与NCK差异显著(P<0.05)。综上可知,高氮高效型品种先玉335各器官氮素积累量在240~300 kg·hm-2(N3~N4)施氮量之间达到较高水平,低氮高效型品种京农科728各器官氮素积累量在180~240 kg·hm-2(N2~N3)施氮量之间达到较高水平。
2.1.3 施氮量对玉米氮转运效率以及氮转运对籽粒贡献率的影响 养分的转运量和转运效率是表征营养体养分向籽粒转移量的重要指标。由表3可知,随着施氮量的增加,先玉335茎秆的氮转运效率呈先升高后降低的趋势,在N4达到最大值,且显著高于其他各处理;叶片的氮转运效率总体呈上升的趋势,在NCK达到最大值,但与N3、N4差异未达到显著水平。随着施氮量的增加,京农科728茎秆的氮转运效率呈先降低后升高的趋势,在N3达到最小值,且与N1差异达到显著水平;叶片的氮转运效率呈先降低后升高的趋势,在N2达到最小值,与NCK差异达到显著水平。结果表明,低氮高效型品种京农科728茎秆、叶片的氮转运效率明显高于高氮高效型品种先玉335。
随着施氮量的增加,先玉335茎秆氮转运对籽粒的贡献率呈先升高后降低的趋势,N4茎秆氮转运对籽粒的贡献率显著高于NCK;叶片氮转运对籽粒的贡献率总体呈升高的趋势,在NCK达到最大值,但与N3、N4差异未达到显著水平。随着施氮量的增加,京农科728茎秆、叶片氮转运对籽粒的贡献率均呈先降低后升高的趋势。结果表明,低氮高效型品种京农科728叶片氮转运对籽粒的贡献率明显高于高氮高效型品种先玉335。

表3 施氮量对玉米氮转运效率和氮转运对籽粒贡献率的影响

注:A:京农科728;B:先玉335,不同小写字母表示同一时期不同处理间差异显著(P<0.05)。下同。Note: A: Jingnongke 728. B: Xianyu 335. Different lowercase letters indicate significant difference at 0.05 level among treatments at the same. The same as following.图2 施氮量对玉米硝酸还原酶的影响Fig.2 Effects of nitrogen application on nitrate reductase in maize
2.2 氮代谢相关酶活性的测定
2.2.1 硝酸还原酶(NR) 由图2可知,同一施氮水平下,随着生育期的推移,高氮高效型品种先玉335和低氮高效型品种京农科728的NR活性均呈单峰曲线变化,并在大喇叭口期达到最大值,随后开始下降。对同一时期不同施氮量的NR活性进行比较,京农科728在生育前期不同氮处理间的NR活性无显著差异;至灌浆期,N4、NCK的NR活性分别较N2显著提高85.55%和84.87%。而先玉335在拔节期不同氮处理间的NR活性差异不显著,随着生育期的推移,差异逐渐增大;大喇叭口期,N4的NR活性显著高于其他施氮处理;抽雄吐丝期,N3和N4的NR活性显著高于NCK。对不同氮高效型品种间叶片的NR活性进行比较,总体而言,在中低氮水平(N1、N2)下,低氮高效型品种京农科728的NR活性明显高于高氮高效型品种先玉335,在高氮水平(N3、N4)下,先玉335的NR活性明显高于京农科728。
2.2.2 亚硝酸盐还原酶(NiR) 由图3可知,同一施氮水平下,随着生育期的推移,高氮高效型品种先玉335和低氮高效型品种京农科728的NiR活性均呈先双峰曲线的趋势,两品种NiR活性均在大喇叭口期达到最大值。对同一时期不同氮处理的NiR活性进行比较,京农科728的NiR活性在生育后期表现出较大差异,抽雄吐丝期、灌浆期和成熟期,N2的NiR活性显著高于NCK。先玉335在生育前期不同氮处理间的NiR活性无显著差异;至抽雄吐丝期,N4的NiR较NCK显著提高46.32%。对两品种间叶片的NiR活性进行比较,中低氮水平(N1、N2)下,低氮高效型品种京农科728的平均NiR活性明显高于高氮高效型品种先玉335;高氮水平(N3、N4)下,先玉335的NiR平均活性明显高于京农科728。

图3 施氮量对玉米亚硝酸还原酶的影响Fig.3 Effects of nitrogen application on nitrite reductase in maize

图4 施氮量对玉米谷氨酰胺合成酶的影响Fig.4 Effects of nitrogen application on glutamine synthetase in maize
2.2.3 谷氨酰胺合成酶(GS) 由图4可知,同一施氮水平下,不同氮高效型玉米品种的GS活性表现各异。随着生育期的推移,低氮高效型品种京农科728的GS活性呈下降趋势;高氮高效型品种先玉335的GS活性呈先升高后降低的趋势。施氮量对京农科728不同生育时期GS活性的调控存在较大差异,在拔节期,N2的GS活性显著高于NCK;在大喇叭口期,N3的GS活性显著高于其他施氮处理;在抽雄吐丝期,NCK的GS活性最高,且显著高于其他施氮处理;在灌浆期和成熟期,N4的GS活性显著高于NCK。随着施氮量的增加,先玉335的GS活性在各生育时期总体呈先升高后降低的趋势;在拔节期,N2的GS活性显著高于其他施氮处理;在大喇叭口期、灌浆期和成熟期,N3的GS活性显著高于其他施氮处理;在抽雄吐丝期,NCK的GS活性最高,但与N3差异未达显著水平。
2.2.4 谷氨酸合成酶(GOGAT) 由图5可知,施氮量对京农科728不同生育时期GOGAT活性的调控存在较大差异,在拔节期,N2的GOGAT活性显著高于其他施氮处理;在大喇叭口期,N4的GOGAT活性显著高于N1;在抽雄吐丝期,N1的GOGAT活性显著高于其他施氮处理;在灌浆期,N4的GOGAT活性显著高于其他施氮处理;在成熟期,N2的GOGAT活性显著高于其他施氮处理。随着施氮量的增加,高氮高效型品种先玉335的GOGAT活性在各生育时期大致呈先升高后降低的趋势。在拔节期、抽雄吐丝期和灌浆期,N3的GOGAT活性均最高,分别较NCK显著提高31.39%、82.63%和87.53%。

图5 施氮量对玉米谷氨酸合成酶的影响Fig.5 Effects of nitrogen application on glutamate synthase in maize
2.2.5 天冬酰胺合成酶(AS) 如图6所示,同一施氮水平下,随着生育期的推移,两品种的AS活性均呈先降低后升高的趋势。随着施氮量的增加,低氮高效型品种京农科728各生育时期的AS活性总体呈先升高后降低的趋势。在拔节期,N4的AS活性显著高于NCK;在大喇叭口期和成熟期,N2的AS活性显著高于其他施氮处理;在抽雄吐丝期和灌浆期,N3的AS活性显著高于其他施氮处理。施氮量对高氮高效型品种先玉335不同生育时期的AS活性影响存在较大差异,在大喇叭口期、抽雄吐丝期和灌浆期,N2的AS酶活性分别较NCK显著提高62.36%、6.14%和12.17%。

图6 施氮量对玉米天冬酰胺合成酶的影响Fig.6 Effects of nitrogen application on asparagine synthetase in maize
2.3 氮代谢关键酶基因表达量
对氮代谢关键酶基因表达量的测定结果如图7、8所示。相较于拔节期,在大喇叭口期,京农科728和先玉335的NR、GOGAT1、GOGAT2基因相对表达量均显著上调,但京农科728的NR基因相对表达量显著高于先玉335(P<0.05)(图7)。相较于拔节期,在抽雄吐丝期和灌浆期,京农科728中的GS1-3基因相对表达量显著上调(P<0.05);在灌浆期,先玉335的GS1-3基因相对表达量显著上调(P<0.05)(图7)。相较于拔节期,在其他生育期,两品种的GS1-4基因相对表达量均显著下调(P<0.05),但各生育时期下调程度存在差异。随着生育的推进,京农科728的GS1-4基因相对表达量持续下调,灌浆期达到最小值(图8)。相较于拔节期,京农科728在灌浆期的AS1和AS3基因相对表达量显著上调(P<0.05)。相较于拔节期,先玉335在其他生育期的AS1基因相对表达量显著下调(P<0.05),AS2和AS3基因相对数量均未发生显著变化(图8)。
2.4 产量
由表3可知,2018年,各处理低氮高效型品种京农科728的产量在8 158.22~9 725.32 kg·hm-2之间,高氮高效型品种先玉335的产量在9 862.14~11 053.22 kg·hm-2之间。京农科728在N2、N3的产量高于其他施氮处理;先玉335在N4、NCK的产量高于其他施氮处理。2019年,各处理京农科728的产量在9 537.99~11 180.04 kg·hm-2之间,先玉335的产量在9 598.81~12 309.14 kg·hm-2之间。京农科728的产量在N2达到最大值,显著高于N4,但与其他施氮处理间差异未达到显著水平;先玉335的产量在N4达到最大值,较NCK显著提高28.23%,与N2差异未达到显著水平。综上年际间两品种的产量随施氮量变化差异较大。

表3 施肥量对玉米产量的影响Table 3 Effect of nitrogen application on corn yield /(kg·hm-2)

注:不同小写字母表示同一处理不同生育期之间差异显著(P<0.05)。Note: Different lowercase letters indicate significant difference at different growth stage of the same treatment.图7 施肥量对氮代谢关键酶基因相对表达量的影响Fig.7 Effect of nitrogen application on relative expression of key enzyme genes in nitrogen metabolism
3 讨论
氮素是植物细胞的重要组成部分,也是种子成熟和干物质积累的重要限制因子。大量研究表明,植物体内氮素积累量随施氮量的增加呈单峰曲线变化,并最终影响干物质的形成[25-26]。本研究表明,高氮高效型品种先玉335在N3、N4水平下,各生育时期植株的氮素积累高,平均产量达到最大值。N3水平下,玉米成熟期的叶鞘和雄穗中氮素积累量达到最大值;N4水平下,玉米成熟期的茎秆、叶片和籽粒氮素积累量均达到最大值,继续增加施氮量至NCK水平,植株各器官的氮素积累量下降,产量也随之降低。低氮高效型品种京农科728在N2、N3水平下,平均产量达到最大值,各生育期植株的氮素积累量较高。相较于NCK,N2显著增加了玉米成熟期茎秆、叶鞘、雄穗和籽粒的氮素积累量;N3显著增加了玉米成熟期叶片、苞叶和穗轴的氮素积累量。说明,在减氮条件下,京农科728表现出了更好的低氮适应能力。有研究表明,施氮量显著影响玉米产量,产量随着施氮量的增加呈先升高后降低的趋势[27-28]。在N1、N2水平下,京农科728的茎秆表现出了较高的氮素转运效率;而先玉335在N4、NCK水平下叶片和茎秆的氮素转运效率较高。说明,高氮高效型和低氮高效型品种在氮素的需求上存在明显差异,高氮高效型品种在整个生育期氮肥供应不足将限制其生产潜力。本研究结果表明不同氮高效品种对氮素的需求、吸收及转运能力是最终产量形成的重要因素。
植物的氮素吸收受氮代谢途径的调控。在NR的催化作用下,根系将吸收的NO3-转化为NO2-[29]。本研究表明,两品种的NR活性均在大喇叭口期达到最大值,并且低氮型品种京农科728的NR活性在N2水平最高,高氮型品种先玉335在N4水平最高。说明不同氮利用型玉米品种的氮素代谢酶活性与施氮量存在密切关系。在NiR的催化下,NO2-转化为NH4+,NH4+在GS和GOGAT的催化下最终合成氨基酸[30]。本研究表明,京农科728的NiR、GS和GOGAT均在低施氮水平下表现出较高的酶活性。京农科728的GS和AS活性在拔节期达到最大值,并在生育后期能够保持较高水平,说明氮肥的高效利用时期与酶活性时期保持一致。在生育后期,尤其是灌浆至成熟期,先玉335在高施氮量下才能保持高的NiR、GS和GOGAT活性。说明先玉335在生育后期需要大量的氮素供应来完成籽粒形成与灌浆过程。Subedi等[31]也研究表明,从吐丝至成熟期的吸氮量占玉米整个生育期的60%以上。综上可知,对高氮高效型品种先玉335后期氮肥的管控是其增产的关键。
外源氮肥的施用使植株体内多个代谢途径中的多个相关基因发生响应,且不同基因型的玉米品种对施氮水平的响应亦存在差异[29,32-33]。本研究表明,相较于拔节期,在大喇叭口期,京农科782和先玉335的NR基因相对表达量显著上调,同时期NR活性显著升高,大大提升了从拔节至大喇叭口期植株对氮素的吸收同化能力,这与李文龙等[29]的研究结果相似。大量研究已经证实提高NR基因的表达能够显著提高NR活性,进而提升作物对氮素的吸收同化效率[33-34]。本研究表明不同氮高效品种在不同施氮量下NR基因的表达量和酶活性存在差异。NR作为一种底物诱导酶存在一定的阈值,当硝酸盐浓度升高到一定水平之后,NR就不会再被诱导[35]。推测氮高效品种对氮素的吸收调控能力存在差异可能与诱导NR的阈值不同有关。
GS是氮代谢的核心酶之一。He等[36]研究表明,GS1-3和GS1-4在玉米叶片中高度积累,是玉米叶片GS1基因最主要的2个亚型,对氮的供应和分配起着枢纽作用。本研究表明,相较于拔节期,在抽雄吐丝期和灌浆期,京农科728的GS1-3基因相对表达量显著上调;在灌浆期,先玉335的GS1-3基因显著上调;相较于拔节期,两品种在其他生育期的GS1-4基因均显著下调。两品种不同生育时期GS1-3基因相对表达量上调说明相较于GS1-4,GS1-3可能在增加叶片氮转运方面发挥着更加积极的作用。本试验也观察到相较于拔节期,GS1-3在灌浆期叶片的基因表达显著上调,且在玉米生育后期显著上调,有效的维持了玉米生育后期GS的活性水平,从而使玉米在生育后期也能维持较高的氮素吸收和利用能力。
AS与GS在运输含氮分子方面具有联合作用,在氮素迁移阶段,AS会在ATP依赖性反应中催化谷氨酰胺和天冬氨酸合成天冬酰胺[37-39]。玉米AS基因的环境调控机制尚鲜见报道。本研究表明,相较于拔节期,京农科728灌浆期的AS1和AS3基因相对表达量显著上调。相较于其他各生育时期先玉335在拔节期的AS1基因显著上调。说明参与氮代谢的ASs基因担负着特殊功能,不同基因型品种的ASs基因对外源氮素的响应存在显著差异。Wan 等[40]研究表明大豆叶片的AS1基因表达量与AS活性及大豆种子中蛋白质含量呈显著相关性。Li等[41]研究表明,在干旱胁迫下,AS与GS共同在叶片氮素转运过程中发挥着重要的作用。不同氮高效品种的AS基因表达结果证明了AS活性的响应机制在两品种间存在差异。在不同时期调控AS活性可以提高玉米叶片的氮素转运效率。
4 结论
不同基因型品种对氮素的吸收利用存在差异。高氮高效型品种先玉335在施氮量为240~300 kg·hm-2时,平均产量达到最大值,其各生育时期氮素积累量也较高;低氮高效型品种京农科728在施氮量为180~240 kg·hm-2时,平均产量达到最大值,其各生育时期氮素积累量也较高。氮代谢关键酶相关基因对不同氮高效型品种的氮素吸收调控存在显著差异。相较于高氮高效型品种先玉335,低氮高效型品种京农科728对氮更为敏感。本研究为冀东地区不同品种的合理氮肥管控提供了理论依据。
