富含EPA/DHA型结构磷脂的酶法合成条件优化及表征
2020-12-02崔益玮郑振霄戴志远
薛 静 崔益玮 沈 清 郑振霄 戴志远,*
(1浙江工商大学海洋食品研究院,浙江 杭州 310012;2浙江省水产品加工技术研究联合重点实验室,浙江 杭州 310012)
磷脂是细胞膜的重要组成部分,承担了重要的生理功能[1],在食品、化妆品及医药领域具有广泛的应用。以二十碳五烯酸(eicosapentaenoic acid, EPA)和二十二碳六烯酸(docosahexaenoic acid, DHA)为代表的Omega-3长链多不饱和脂肪酸已被证实具有促进视觉系统发育,提高机体免疫力,改善心脏健康和降低心血管疾病发病率等功能,甘油酯型和磷脂型是其主要的天然构型[2-4]。研究表明,磷脂型DHA和EPA相此于甘油酯型和乙酯型具有诸多优势,如磷脂在体内的吸收率远高于被动吸收方式的甘油酯和乙酯,且磷脂型DHA和EPA没有腥味,具有更好的稳定性等[5-7]。随着磷脂型Omega-3脂肪酸受到越来越多的关注,富含EPA/DHA磷脂的制备方法也逐渐成为国内外学者研究的热点。
目前,富含Omega-3脂肪酸的磷脂制备方法主要包括天然提取法[8-9]、微生物发酵法[10]、酶促转化法[11]和化学合成法[12]等。含有EPA和DHA的天然磷脂主要存在于海产动物的卵和肌肉组织中[13-14],其产量和纯度难以满足市场的需求。相比于化学合成法,酶促转化法具有选择性高、条件温和等特点[15],更适合用于制备EPA/DHA型结构磷脂。国内外学者对此展开了大量的研究[16-19],如Li等[17]在无溶剂体系中,采用磷脂酶A1催化大豆磷脂与富含EPA、DHA的乙酯型鱼油发生酯交换反应,最大转化率为30.7%;Li等[18]研究了水分添加量、真空处理等不同因素对酶促合成DHA/EPA型磷脂酰胆碱的影响,结果表明水分添加量高于0.5%时,磷脂酶A1的催化活力明显增强;Marsaoui等[19]研究了不同溶剂体系和添加物对米黑根毛霉(Rhizomucormiehei) 脂肪酶催化大豆卵磷脂与乙酯型EPA和DHA酯交换反应的影响,结果表明随着反应时间的延长,Mg2+和尿素的添加显著提高了EPA和DHA的结合率。然而,多数研究仍以不含EPA和DHA的植物大豆磷脂为合成原料,受限于磷脂酶的专一催化特性,产物磷脂中的DHA/EPA含量仍难以达到较高水平。且大多数研究仅采用薄层色谱(thin-layer chromatography, TLC)和气相色谱(gas chromatography,GC)等对产物磷脂进行总脂肪酸含量的测定,难以准确表征磷脂分子结构在酶反应前后发生的变化。传统的TLC和正相液相色谱(normal-phase high performance liquid chromatography, NP-HPLC)无法与质谱联用,亲水作用色谱(hydrophilic interaction liquid chromatography, HILIC)是专门分离强极性和亲水性化合物的一种方法,具有较好的质谱兼容性,亲水作用色谱-质谱联用(hydrophilic interaction liquid chromatography-mass spectrometry, HILIC-MS)技术亦成为研究磷脂分子结构的有效方法[20]。
本研究以南极磷虾磷脂为原料,以EPA和DHA总结合率为指标,通过响应面法优化富含EPA/DHA型结构磷脂的酶法合成反应参数,进一步提高结构磷脂中EPA和DHA的含量,并采用GC和HILIC-MS技术对其结构进行表征,以期为探索和丰富酶促合成EPA/DHA型结构磷脂的机理和实践提供理论基础。
1 材料与方法
1.1 材料与试剂
南极磷虾油,购自辽渔南极磷虾科技发展有限公司;磷脂酰胆碱(phosphatidylcholines, PC),溶血磷脂酰胆碱(lysophosphatidylcholine, LPC)标准品,购自美国Avanti Polar-Lipids;固定化磷脂酶A1,实验室自制(水分含量1.7%,酶活795 U·g-1);37种脂肪酸标准品,购自上海安谱实验科技股份有限公司;乙酯型鱼油,购自浙江海力生集团有限公司;磷脂酶A1(Lecitase Ultra),购自丹麦诺维信公司;乙腈(色谱纯),购自德国Merck公司;乙醇、盐酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠、氯化钠、乙醚、乙酸、丙酮、三氯甲烷、甲醇、石油醚、无水硫酸钠等均为分析纯,购自国药集团。
1.2 仪器与设备
4000Q-TRAP三重四级杆质谱仪(ESI离子源),美国Applied Biosystems公司;HPLC高效液相色谱系统,美国Waters公司;7890B气相色谱仪,美国Agilent公司;Fresco-21G台式离心机,美国Thermo Fisher公司;Millipore超纯水系统,美国Millipore公司;BSD-YX2200恒温摇床,上海博迅医疗生物仪器股份有限公司。
1.3 试验方法
1.3.1 游离脂肪酸的制备 参考张蒙娜等[21]的方法对乙酯型鱼油中的EPA和DHA进行富集,并采用Garcia等[22]的方法制备游离脂肪酸,充氮密封,低温保存待用。经测定,游离脂肪酸中EPA相对含量为60.63%,DHA相对含量为24.57%。
1.3.2 南极磷虾磷脂的提取 采用Folch等[8]的方法提取南极磷虾总脂,加入一定体积冷丙酮(0℃),5 000 r·min-1离心10 min,弃上清液,收集沉淀并用大量冷丙酮多次洗涤,取上清液滴于洁净玻片上,迅速挥干无油迹后,氮吹干,充氮,低温保存待用。
1.3.3 固定化酶催化合成结构磷脂 称取1 g南极磷虾磷脂于50 mL具塞三角烧瓶中,按试验设计比例加入游离脂肪酸、正己烷和水,充分混匀后加入一定质量的固定化磷脂酶A1,充氮密封,置于恒温空气摇床,200 r·min-1反应24 h后,过滤去除固定化磷脂酶A1,收集反应液。用正己烷多次淋洗固定化磷脂酶A1,收集淋洗液。将淋洗液与反应液混合,并旋蒸脱溶。
1.3.4 响应面试验设计
1.3.4.1 单因素试验 固定正己烷添加量为3 mL,反应时间为24 h,分别研究底物质量比(游离脂肪酸:磷脂,m/m),酶添加量(以反应底物的总质量计),反应温度以及水分添加量(以反应底物的总质量计)4个单因素对磷脂酸解反应的影响。具体操作如下:(1)固定底物质量比为4,酶添加量为15%,反应温度为50℃,研究水分添加量(0.25%、0.50%、0.75%、1.00%、1.25%、1.50%)对磷脂酸解反应的影响。(2)固定底物质量比为4,水分添加量为1.00%,反应温度为50℃,研究酶添加量(5%、10%、15%、20%、25%、30%)对磷脂酸解反应的影响。(3)固定水分添加量为1.00%,酶添加量为20%,反应温度为50℃,研究底物质量比A(2、3、4、5、6、7)对磷脂酸解反应的影响。(4)固定底物质量比为5,水分添加量为1.00%,酶添加量为20%,研究反应温度(40、45、50、55、60℃)对磷脂酸解反应的影响。
1.3.4.2 响应面试验 在单因素试验的基础上,依据Design Expert 8.0软件中的Box-Behnken设计中心组合试验,选取底物质量比A(游离脂肪酸∶磷脂,m/m)、反应温度B和水分添加量C(以反应底物总质量计)3个因素为自变量,以DHA和EPA的总结合率为响应值,进行三因素三水平的中心组合试验,以确定富含EPA/DHA型结构磷脂最佳酶反应参数。响应面因素及水平见表1。

表1 响应面因素与水平表Table 1 Levels and factors of response surface methodology (RSM)
1.3.5 反应产物的TLC检测 参考Zhao等[23]的方法对反应产物进行TLC检测,并做适当修改。取100 mg脱溶后的反应产物溶解于1 mL三氯甲烷中,毛细管点样于TLC硅胶板上,以三氯甲烷∶甲醇∶乙酸∶水(75∶40∶8∶3,v/v/v/v)为展开液,碘蒸气显色。
1.3.6 GC测定脂肪酸组成 将TLC硅胶板上对应的结构磷脂条带刮下,并加入5 mL 0.5 mol·L-1氢氧化钾-甲醇溶液,于65℃水浴30 min,冷却后加入2 mL 14%三氟化硼-甲醇溶液,于65℃水浴5 min,超声提取10 min后加入2 mL正己烷,振摇后用2 mL饱和氯化钠淋洗上层,取上层用无水硫酸钠脱水,过滤待测。
GC条件:HP-88毛细管色谱柱(30 m×0.25 mm,0.20 μm);升温程序:初温70℃保持1 min,以4℃·min-1升至180℃,保持5 min;再以3℃·min-1升至230℃,保持5 min,进样口温度250℃,分流比30∶1,进样量1 μL,载气流速1 mL·min-1。采用峰面积归一化法分析各脂肪酸组分的相对含量。每组样品重复测试3次。
1.3.7 HILIC-MS测定磷脂结构 最优条件下反应结束后,取一定量脱溶后的反应混合物,采用氯仿-甲醇溶液(2∶1,v/v)进行稀释,以0.2 μm有机滤膜过滤后静置用于质谱分析。
液相条件:色谱柱:Cosmosil HILIC色谱柱(4.6 mm×250 mm,2.5 μm);流动相A:超纯水(20 mmol·L-1甲酸铵,18 mmol·L-1甲酸);流动相B:乙腈(18 mmol·L-1甲酸)。梯度洗脱程序[24]:0 min(95% B),3 min(95% B),18 min(70% B),23 min(50% B),28 min(50% B),29 min(95% B),32 min(95% B)。流量0.6 mL·min-1;进样量2 μL。
质谱条件:电喷雾离子源ESI负离子模式;离子源电压(IS)4.5 kV;毛细管温度500℃;气帘气(CUR)25 psi;雾化气(GS1)24 psi;辅助气(GS2)30 psi;扫描范围400~1 000 m/z[25]。采用峰面积归一化法分析各磷脂分子种组分的相对含量。每组样品重复测试3次。
1.4 数据处理
采用Analyst Software v1.6.3软件进行数据采集,采用Lipid View 1.2进行磷脂分子种鉴定,采用Excel 2010和Origin 8.0软件进行数据分析和图表制作。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 水分添加量对磷脂酸解反应的影响 由图1可知,水分添加量为0.25%~1.00%时,EPA/DHA结合率随着水分添加量的增加而增加,但随着水分含量的继续增加,EPA/DHA结合率逐渐下降。分析原因可能是在较低水分活度下,磷脂酶的构象过于“刚性”而无法发挥催化活力,而磷脂酶由于兼具水解和酯化的双重催化活性,当体系中的水分过高时,加速了水解副反应的发生,从而导致EPA/DHA结合率下降。因此,选定水分添加量为1.00%进行下一步的优化。
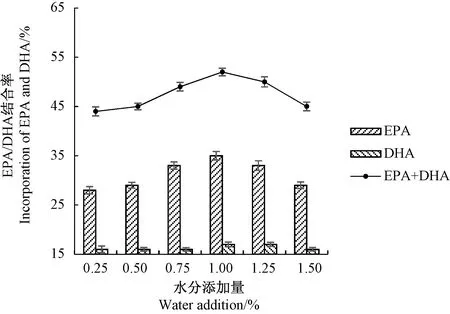
图1 水分添加量对磷脂酸解反应的影响Fig.1 Effect of water addition on the acidolysis reaction
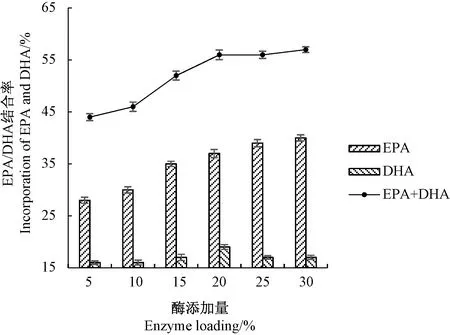
图2 酶添加量对磷脂酸解反应的影响Fig.2 Effect of enzyme loading on the acidolysis reaction
2.1.2 固定化酶添加量对磷脂酸解反应的影响 由图2可知,随着酶添加量的增加,EPA/DHA结合率整体呈上升趋势,当酶添加量超过20%时,EPA/DHA结合率的增幅减缓,这与Zhao等[23]的研究结果基本一致。分析原因,可能是由于酶促反应的速度取决于酶和底物生成的中间复合物的浓度,随着磷脂酶含量的逐渐增加,其活性基团不断增多,中间物浓度不断增加,酶促反应加速;而由于受底物浓度限制,中间复合物达到饱和后,酶促反应趋于平衡,继续增加酶添加量,反应速率变化不大。从酶的利用角度出发,选择固定酶添加量为20%进行后续优化。
2.1.3 底物质量比对磷脂酸解反应的影响 由图3可知,随着底物质量比中游离脂肪酸含量的增加,DHA/EPA结合率呈先上升后缓慢下降的趋势。这可能是由于随着酶促反应的进行,原料磷脂sn-1位上的非目标脂肪酸链被替换下来,导致底物中的EPA和DHA被逐渐稀释,目标脂肪酸链与磷脂的接触率降低,不利于反应的进行,因此适当增大游离脂肪酸的比例有助于提高目标脂肪酸链与磷脂的接触率。但随着游离脂肪酸含量的继续增加,底物浓度已趋于饱和,一方面,底物黏度的增大阻碍了酶与底物之间的充分接触,另一方面,游离脂肪酸中残存的水分增加了体系中的水分含量,从而致使结合率不增反减。因此,选择底物质量比为5进行后续优化试验。
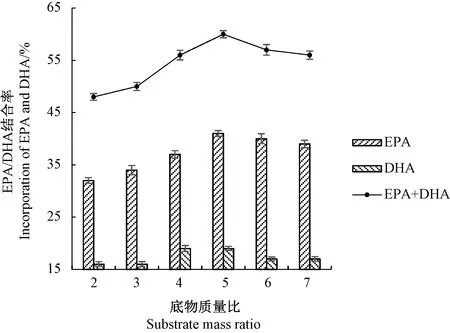
图3 底物质量比对磷脂酸解反应的影响Fig.3 Effect of substrate mass ratio on the acidolysis reaction
2.1.4 反应温度对磷脂酸解反应的影响 由图4可知,随着反应温度的升高,EPA/DHA结合率呈先增加后减小的趋势。分析原因可能是,在较低温度下,磷脂酶A1的水解活性高于酯化活性,催化反应更趋向于朝着水解的方向进行;随着反应温度的升高,酶催化酯化的活性增强,反应体系黏度降低,底物与酶的接触更加充分,从而促进了EPA/DHA和磷脂的结合。当反应温度超过酶的最适温度时,酶的活性将受到抑制,甚至丧失活性,从而表现为DHA/EPA结合率降低。Garcia等[22]研究认为固定化磷脂酶A1在50~60℃之间可催化获得最高转化率,这与本研究结果一致。因此,选定55℃为酶催化磷脂酸解反应的最佳反应温度。
2.2 响应面试验结果分析
2.2.1 响应面试验结果 响应面试验设计及结果见表2。
2.2.2 响应面回归模型的方差分析 对表2所得结果进行回归建模分析,并对所得回归模型做方差分析及显著性检验,结果如表3所示。最终得到回归方程为:

图4 反应温度对磷脂酸解反应的影响Fig.4 Effect of temperature on the acidolysis reaction

表2 响应面试验设计与结果Table 2 The Box-Behnken design and results
EPA/DHA结合率=63.64+0.79A+0.59B-1.57C-0.30AB-0.53AC+0.025BC-3.15A2-6.05B2-2.57C2。
模型F值为107.28,P值<0.000 1,差异极显著;模型失拟项F值为2.49,P值为0.199 5>0.05,不显著;从拟合方程的相关系数可见,多元二次方程拟合相关系数高于0.90,拟合的回归模型可用来预测响应值与反应参数之间的关系。由表3可知,A、B、C、A2、B2和C2的P值均小于0.05,说明A(底物质量比)、B(反应温度)、C(水分添加量)的主效应显著,对试验结果具有显著影响,其中水分添加量(C)是影响EPA/DHA结合率的最主要因素。

表3 二项式回归模型方差分析结果Table 3 Model-fitting results and analysis of variance
Note:*indicates significant difference at 0.05 level. **indicates extremely significant difference at 0.01 level.

图5 底物质量比与反应温度对EPA/DHA结合率影响的响应面图与等高线图Fig.5 Response surface and its contour plots for the interactive effect of substrate mass ratio and temperature on the level of incorporation of EPA and DHA
2.2.3 响应面交互作用分析结果 根据回归方程绘制响应值EPA/DHA结合率与3个因素的等高线及响应面图。由图5可知,当反应温度和底物质量比处于较低水平时,EPA/DHA结合率随着二者的增加而明显提高,当继续增加至较高水平时,EPA/DHA结合率随之缓慢下降。结合表3数据,A(底物质量比)和B(反应温度)对EPA/DHA结合率具有显著影响,两者相比,A(底物质量比)对EPA/DHA结合率的影响较大,而两者的交互作用不显著。同理,结合图6~7和表3可知,A(底物质量比)和C(水分添加量)之间的交互作用,以及B(反应温度)和C(水分添加量)之间的交互作用均不显著。
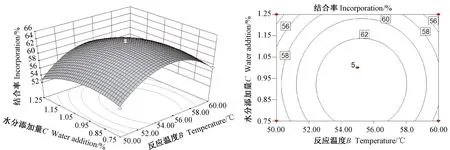
图6 反应温度与水分添加量对EPA/DHA结合率影响的响应面图与等高线图Fig.6 Response surface and its contour plots for the interactive effect of temperature and water addition on the level of incorporation of EPA and DHA

图7 底物质量比与水分添加量对EPA/DHA结合率影响的响应面图与等高线图Fig.7 Response surface and its contour plots for the interactive effect of substrate mass ratio and water addition on the level of incorporation of EPA and DHA
通过对上述试验结果的分析,确定回归模型预测的最佳反应参数:底物质量比5.15,反应温度55.22℃,水分添加量0.92%,此条件下预测EPA/DHA结合率为63.97%。
2.2.4 验证试验结果 为了验证模型的准确性,在上述最优条件下进行3次平行试验。考虑试验的可操作性,将反应温度调整为55.2℃,试验结果见表4。试验组平均值与预测值相对误差小于1%,说明通过响应面优化得到的工艺参数具有较高的可行性。
表4 响应面模型验证试验结果Table 4 The validation test results of the response surface mode /%
2.3 原料磷脂及结构磷脂的结构分析
2.3.1 脂肪酸组成分析 由图8和表5可知,原料磷脂中含量最高的脂肪酸为EPA,其次为C16:0、DHA和C18:1;结构磷脂中含量最高的脂肪酸为EPA,其次为DHA、C16:0和C18:1。对比磷脂反应前后的脂肪酸组成发现,经过酸解反应,结构磷脂中的EPA和DHA等高不饱和脂肪酸含量显著增加,而C14:0、C16:0以及C18:1等饱和脂肪酸和低不饱和脂肪酸含量显著降低。
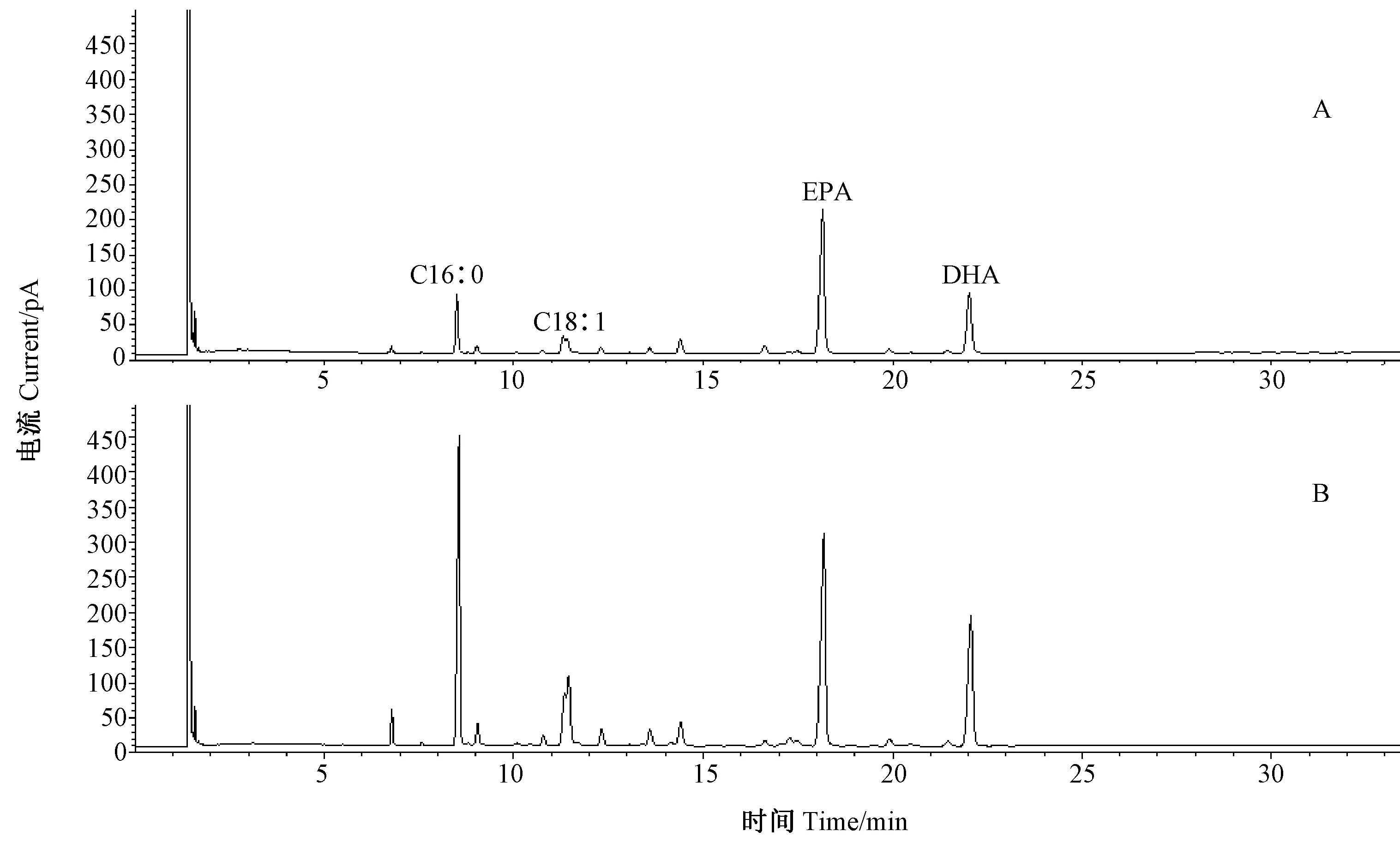
注:A:结构磷脂;B:原料磷脂。Note:A: Structured phospholipids. B: Raw phospholipids material.图8 原料磷脂和结构磷脂气相色谱图谱Fig.8 The GC chromatography of structured phospholipids and raw phospholipids material

表5 原料磷脂和结构磷脂主要脂肪酸组成Table 5 The composition of main fatty acids in raw phospholipids material and structured phospholipids
2.3.2 磷脂分子种组成分析 原料磷脂和结构磷脂的PC和LPC质谱图见图9~10。结果表明,原料磷脂PC组分的m/z多集中在796.9~852.9之间,且m/z 824.7和m/z 850.8等峰丰度较大;LPC组分的m/z多集中在540.7~612.5之间,m/z 540.7和m/z 586.6等峰丰度较大。结构磷脂的PC和LPC组分的m/z分布较原料磷脂发生明显偏移,其中,PC组分m/z多集中在808.9~898.8之间,且m/z 870.9和m/z 896.8等峰丰度较大;LPC组分丰度较高的峰为m/z 586.7、m/z 612.7和m/z 526.8。
由LipidView软件进行定性分析,并通过归一化法对已鉴定的磷脂分子进行相对含量测定,结果见表6。原料磷脂和结构磷脂中共鉴定出PC分子46种,LPC分子20种。其中,PC组分的C原子总数为32~44个,双键数为0~12个;LPC组分的C原子总数为14~22个,双键数为0~6个。
原料磷脂的PC亚类中,36:5(16:0/20:5)、38:6 (16:0/22:6&18:1/20:5)和34:1(16:0/18:1)等分子种的相对含量较高,分别占17.57%、12.54%和6.47%;LPC亚类中,16:0(16:0/0:0)、20:5 (20:5/0:0)、18:1 (18:1/0:0)和22:6(22:6/0:0)等分子种的相对含量较高,分别占30.72%、16.68%、11.69%和10.28%。此外,还检测到40:10(20:5/20:5)、42:11(20:5/22:6)和44:12(22:6/22:6)等接近满饱和度的PC分子种,但相对含量较低,仅占1.87%、4.43%和1.29%。
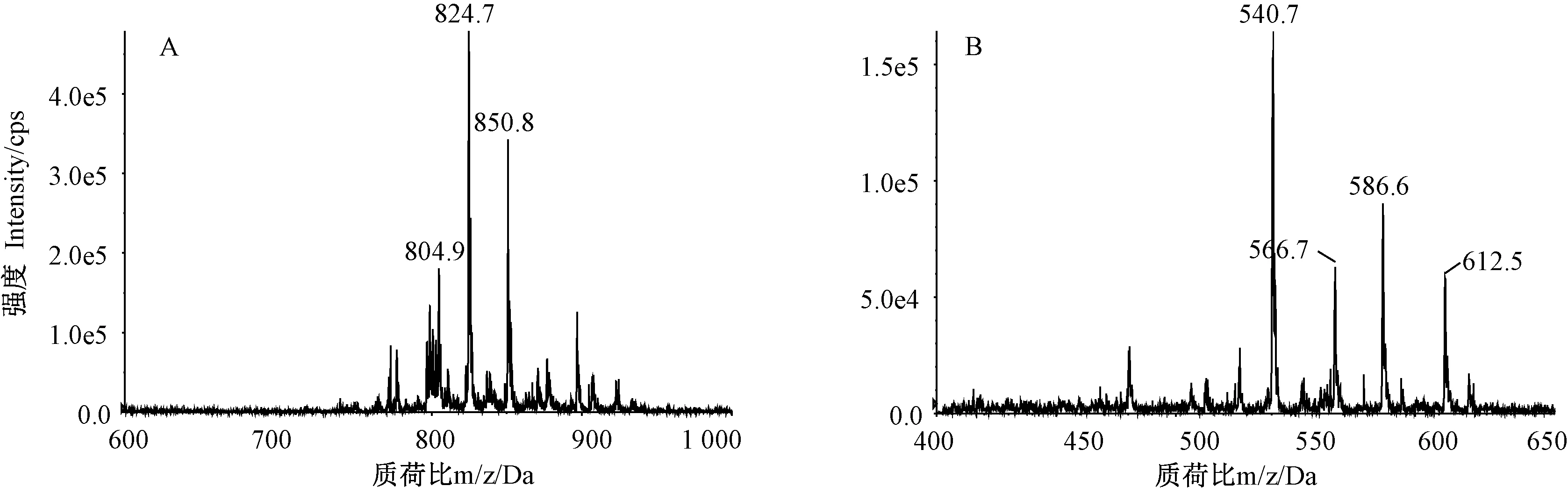
注:A:PC组分质谱图;B:LPC组分质谱图。Note: A: Mass spectra of PC. B: Mass spectra of LPC.图9 原料磷脂质谱图Fig.9 Mass spectra of raw phospholipids material
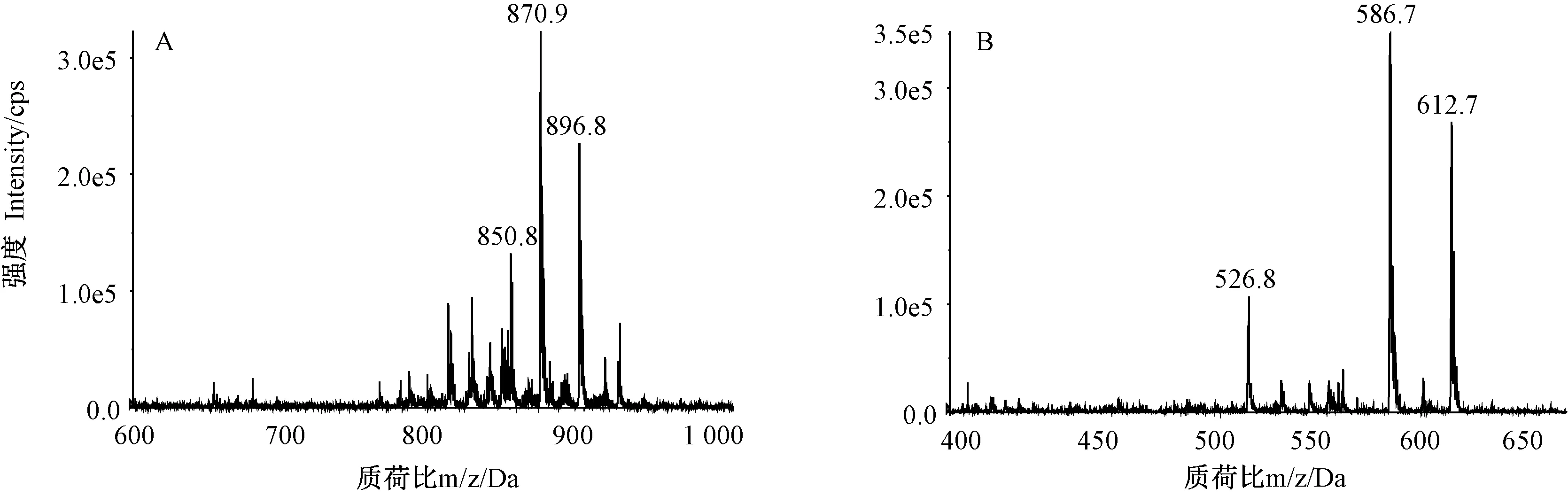
注:A:PC组分质谱图;B:LPC组分质谱图。Note: A: Mass spectra of PC. B: Mass spectra of LPC.图10 结构磷脂质谱图Fig.10 Mass spectra of structured phospholipids

表6 原料磷脂和结构磷脂分子种组成分析Table 6 Analysis of molecular species composition of raw phospholipids material and structured phospholipids

表6(续)
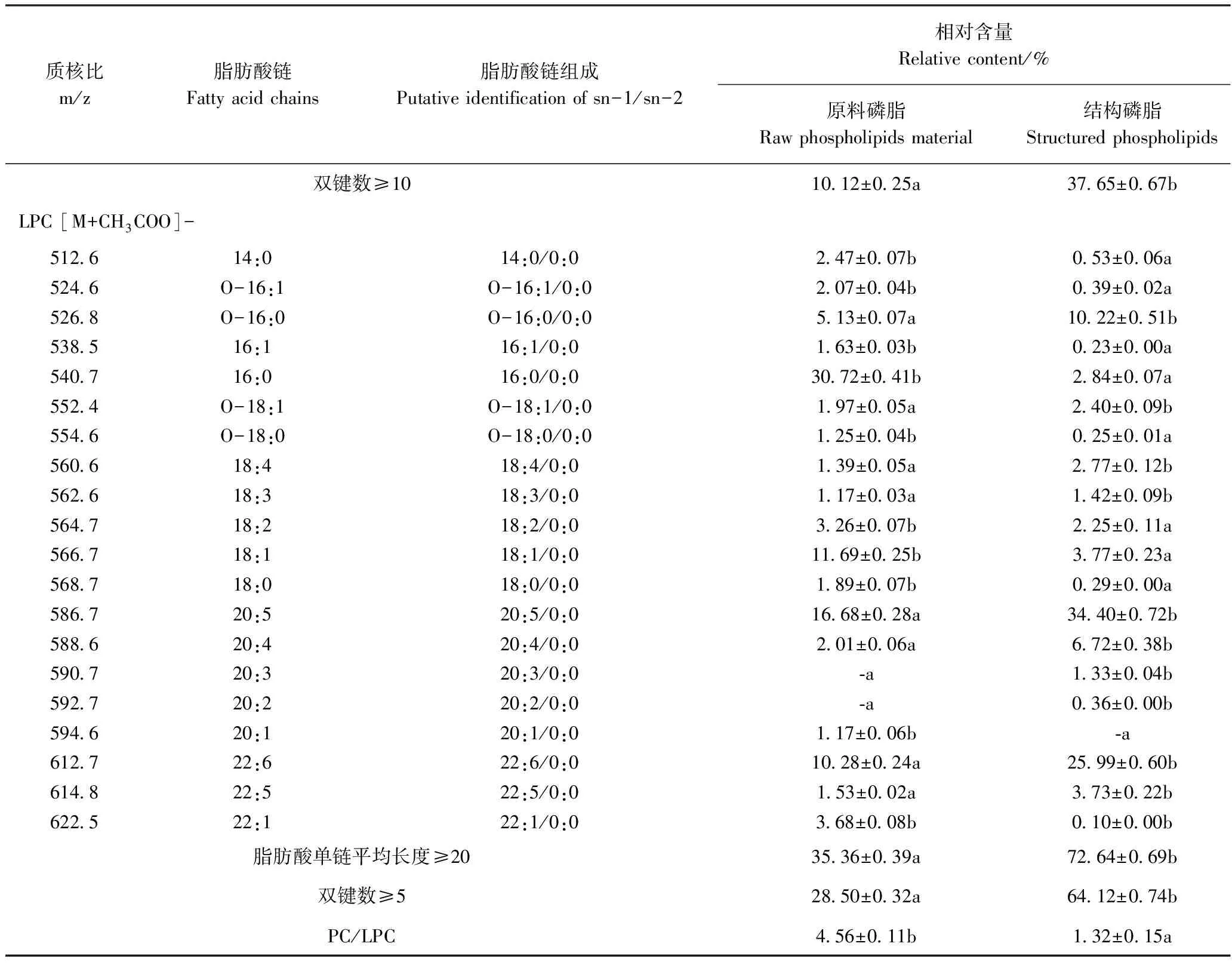
表6(续)
结构磷脂的PC亚类中,36:5(16:0/20:5)、38:6 (16:0/22:6&18:1/20:5)和34:1(16:0/18:1)等分子种的相对含量较原料磷脂显著下降,而40:10(20:5/20:5)和42:11(20:5/22:6)等分子种的相对含量较原料磷脂提高了16.59和8.35个百分点,分别占18.46%和12.78%;LPC亚类中16:0(16:0/0:0)和18:1 (18:1/0:0)等分子种的相对含量较原料磷脂显著下降,而20:5(20:5/0:0)和22:6(22:6/0:0)分子种的相对含量较原料磷脂提高了17.72和15.71个百分点,分别占34.40%和25.99%。
以脂肪酸单链平均长度≥20作为磷脂分子长链脂肪酸相对含量的参考,以双键数≥5和双键数≥10作为磷脂分子中高不饱和脂肪酸相对含量的参考,对比磷脂反应前后的差异发现,结构磷脂的PC和LPC组分中脂肪酸单链平均长度≥20的分子种的相对含量分别为54.24%和72.64%,较原料磷脂分别提高了33.12和37.28个百分点;结构磷脂的PC组分中双键数≥5和双键数≥10的分子种相对含量分别为93.48%和37.65%,较原料磷脂分别升高了24.89和27.53个百分点;结构磷脂的LPC组分中双键数≥5的分子种相对含量为64.12%,较原料磷脂提高了35.62个百分点;此外,PC/LPC显著下降,说明经酶催化酸解反应,磷脂的组成发生了显著变化,磷脂中的部分PC转变为LPC。
综上,经过酶催化酸解反应后,结构磷脂中脂肪酸链的长度和不饱和程度均发生了显著变化,其脂肪酸链中具有更多的长链高不饱和脂肪酸EPA和DHA。
3 讨论
3.1 富含EPA/DHA型磷脂酶合成反应条件优化
为制备富含EPA/DHA型磷脂,国内外学者展开了大量的研究。其中大多数研究采用不含EPA/DHA的大豆卵磷脂和不同酰基供体形式的EPA/DHA为反应原料,但由于磷脂酶专一催化的特性,产物磷脂中的EPA/DHA含量难以获得进一步提升。南极磷虾是富含天然磷脂的优质资源[27-28],具有较高的深度开发和应用价值。本研究从南极磷虾油中提取磷脂,经测定其EPA和DHA含量分别为25.32%和15.31%,这与孙甜甜等[29]的研究结果基本一致。研究认为,Omega-3多不饱和脂肪酸易结合在磷脂的sn-2位[30],而sn-1位脂肪酸通常为饱和脂肪酸或低不饱和脂肪酸。利用磷脂酶A1的sn-1位专一催化活性,催化南极磷虾磷脂sn-1位脂肪酸链与EPA/DHA进行交换,并最大程度保留sn-2位EPA/DHA,将成为进一步提高磷脂中EPA/DHA含量的新途径。
本研究在单因素试验的基础上,采用响应面法分析了水分添加量、底物质量比和反应温度与EPA/DHA结合率的关系。结果显示,3个因素对EPA/DHA结合率均有显著影响,其中水分添加量对EPA/DHA结合率的影响极显著。李响[31]研究表明,水分添加量对产物中EPA/DHA结合率、PC、LPC和甘油磷脂酰胆碱(glycerophosphorylcholine, GPC)含量均具有显著影响,其中水分添加量是影响DHA/EPA结合率和产物组成的最主要因素,最优水分添加量为1.28%。Li等[18]采用响应面法优化了固定化酶A1催化合成DHA/EPA型磷脂的最优反应参数,得出最佳水分添加量为1.1 wt%。本研究与前人研究基本一致,但水分添加量的最优值存在一定差异,这可能是因为大豆卵磷脂和南极磷虾磷脂原料以及反应体系存在差别。由于南极磷虾磷脂本身含有一定量的EPA/DHA,适当降低水分添加量可避免磷脂原料中固有的EPA/DHA发生过度水解,故本试验确定的最优水分添加量较前人报道偏低。水解反应是完成酶催化磷脂酸解反应过程中不可避免的副反应[32],适当的添加水分可以促使磷脂水解产生溶血磷脂,而溶血磷脂作为酯交换反应的中间体可以促进酯交换反应的进行[33]。因此,适宜的水分添加量是制备富含EPA/DHA型磷脂的关键。
3.2 原料磷脂和结构磷脂的表征
经分析,实验室自制南极磷虾磷脂的主要成分为PC和LPC(总含量>90%),还存在少量的磷酯酰乙醇胺(phosphatidylethanolamine, PE),这与胡劼等[34]的研究结果一致。因此,本试验以PC和LPC为主要研究对象。
结合气相色谱和液相质谱试验数据以及前人的研究成果[20,24-26]综合分析可知,原料磷脂的sn-1位脂肪酸主要为C16:0、C18:1、C14:0、C18:0等,而EPA和DHA等高不饱和脂肪酸主要位于磷脂的sn-2位,由此推测含量较高的PC亚类的结构依次为36:5(16:0/20:5)、38:6(18:1/20:5&16:0/22:6)和34:1 (16:0/18:1),LPC亚类依次为16:0(16:0/0:0)、20:5(20:5/0:0)、18:1(18:1/0:0)和22:6 (22:6/0:0)。由于磷脂酶A1专一作用于磷脂分子的sn-1位酯键,可首先水解PC分子的sn-1位脂肪酸生成sn-2-LPC[35],并催化后者与高不饱和脂肪酸进行酯化反应,从而提高磷脂中高不饱和脂肪酸的含量。另一方面,sn-2-LPC可经酰基转移作用转换为sn-1-LPC[36],后者在磷脂酶A1的催化下可进一步水解生成GPC,从而导致磷脂得率以及EPA/DHA含量下降。由于EPA和DHA为脂肪酸链长度≥20,双键数≥5的高不饱和脂肪酸,由此推测原料磷脂在磷脂酶A1催化作用下的理论产物主要为一系列双键数≥5的PC和LPC分子种,其中亦包含部分双键数≥10的PC分子种,如40:10(20:5/20:5)、42:11(20:5/22:6)、44:12(22:6/22:6)等。脂肪酸单链平均长度≥20可作为磷脂分子长链脂肪酸相对含量的参考,而双键数≥5和双键数≥10可作为磷脂分子中高不饱和脂肪酸相对含量的参考,以上参数是判断酯交换反应效果的有力指标。表6数据也说明,在磷脂酶A1的催化作用下,磷脂分子中的中长链饱和脂肪酸和低不饱和脂肪酸与反应底物中的长链高不饱和脂肪酸发生了高效的交换。
此外,以PC/LPC作为水解程度的参考,对比磷脂反应前后的差异发现,结构磷脂的PC/LPC较原料磷脂显著降低,进一步证实了磷脂水解反应的发生。这一现象与Kim等[37]和李响[31]的研究结果基本一致。Kim等[37]研究表明,随着Omega-3多不饱和脂肪酸结合率的提高,PC含量明显降低。李响[31]采用核磁共振波谱仪对最终产物磷脂的组成进行了分析,结果发现随着反应的进行,PC逐渐转化为LPC(57.7%)和GPC(25.8%)。研究表明,LPC的乳化性、渗透性、表面活性等性能均优于普通磷脂[38],其在食品、畜牧、医药等行业具有重要的开发利用价值[39-40]。
4 结论
本研究采用响应面法对富含EPA/DHA型结构磷脂的酶法合成反应参数进行了优化,得到最佳反应条件为:底物质量比5.15,反应温度55.22℃,水分添加量0.92%,酶添加量20%,正己烷3 mL,反应时间24 h,所得结构磷脂中EPA/DHA结合率高达64.35%。通过对磷脂反应前后的结构变化进行表征,证实了以sn-2位富含EPA/DHA的磷脂为原料,结合具有sn-1位专一催化活性的磷脂酶A1,制备富含EPA/DHA型磷脂(包括溶血磷脂)具有一定的可行性。本研究为制备富含EPA/DHA型结构磷脂提供了新的思路,但本研究尚未对反应产物的贮藏特性及功能活性等进行验证,今后将继续开展结构磷脂的分离纯化技术及功能活性等研究,以制备满足不同需求的磷脂产品。
