宫颈鳞癌患者单一人乳头瘤病毒感染型别分布及发病年龄的研究
2020-12-02耿建祥李淑锋顾冬梅候进军
陈 晔,黄 健,耿建祥,蔡 博,李淑锋,顾冬梅,仇 玮,候进军,赵 雪
0 引 言
宫颈癌是一种危害我国女性身心健康的主要妇科恶性肿瘤。宫颈癌组织学诊断类型主要有宫颈鳞状细胞癌(squamous cell carcinoma,SCC)和宫颈腺癌(adenocarcinoma,ADC),以及其他少见的宫颈腺鳞癌、宫颈小细胞癌和宫颈未分化癌等。其中宫颈鳞癌约占80%~85%,宫颈腺癌约占10%~15%[1-4]。近年来,我国宫颈癌的发病率呈现出上升且年轻化的趋势。我国国家癌症中心2019年发表的数据显示:2015年我国宫颈癌新增病例约10万人,死亡人数约3万人[5]。宫颈鳞癌是目前病因明确的恶性肿瘤,高危型人乳头瘤病毒(high-risk human papillomavirus, HR-HPV)持续性感染是其主要病因。因HPV感染率、感染型别以及各型别感染的年龄分布在不同的种族和不同的地域存在着差异性,以致HPV感染越来越引起人们的关注。为进一步分析以江苏省为主的区域性宫颈鳞癌患者的单一HPV感染型别分布与发病年龄的状况,本文回顾性分析851例单一HPV型别感染宫颈鳞癌患者的临床病理资料,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析1978年11月至2019年6月江苏省无锡市锡山人民医院、安徽省安庆市第一人民医院和第二人民医院、安徽省当涂县人民医院、浙江省宁波市鄞州人民医院、山东省临沂市肿瘤医院、河南省商城县人民医院、江苏省南京市妇幼保健院、南京市六合区人民医院和六合区中医院、南京市大厂医院、南京市中医院、南京市江宁区人民医院、南京市梅山医院、镇江市第一人民医院、镇江市丹徒区人民医院、杨中市人民医院、徐州市中医院、徐州市妇幼保健院、新沂市人民医院、邳州市人民医院、射阳县人民医院、大丰市人民医院、常熟市第一人民医院、常熟市中医院、金湖县人民医院、靖江市人民医院、盐城市第一人民医院、兴化市人民医院、昆山市第一人民医院、扬州市洪泉医院、江苏大学附属医院病理科的病理组织学诊断为宫颈鳞癌患者1125例资料,其中单一HPV型别感染者851例。851例患者中,年龄为23~90岁,平均(56.5±5.4)岁,其中20~29岁7例(0.82%),30~39岁79例(9.28%),40~49岁289例(33.96%),50~59岁239例(28.09%),60~69岁153例(17.98%),70~79岁65例(7.64%),80~89岁18例(2.12%),90~99岁1例(0.12%)。
1.2 方法从宫颈鳞癌石蜡组织中提取HPV DNA,采用聚合酶链式反应与基因芯片检测技术对患者的癌组织行23种HPV检测。由1位病理科副主任医师和1位主治医师根据WHO(2003年)妇科肿瘤组织学的分类标准进行复片,并复习其临床病理资料。
1.2.1 仪器与试剂PCR仪为美国Life Technology公司生产的ABI7500型,高速冷冻离心机为德国eppendorf公司生产的5810 R型,分子杂交仪为江苏省兴化市分析仪器厂生产的FYY-3型,-20 ℃冰箱由青岛海尔有限公司生产。HPV基因分型检测试剂盒由亚能生物技术(深圳)有限公司提供。显色液须新鲜配制,使用时所需浓度加蒸馏水配制。
1.2.2 标本的采集先去除每例石蜡组织周边多余的石蜡,将其石蜡组织切成4 μm厚的切片,切3~5片石蜡组织即可。用专用的镊子轻轻夹取,放入小离心管中,切第2例石蜡组织前,用次氯酸钠溶液擦刀片及镊子各3次。
1.2.3 DNA的提取将切下的石蜡组织片放入1.5 mL离心管中,加入裂解液150 μL,充分振荡混匀,放入金属浴中加热100 ℃ 10 min,立刻13 000 r/min离心10 min,离心半径7 cm。取中间层DNA溶液待用。PCR扩增、杂交、孵育和显色按说明书进行规范操作。每份标本显色后,根据膜芯片上的各个型别位点杂交信号的有无,来判断结果。低危型:6、11、42、43、81、83型,其他型别均为高危型。
1.3 观察指标因我国从2009年开展对农村妇女宫颈癌的筛查工作,将农村妇女宫颈癌的筛查的年龄划定在35~64岁的女性作为筛查对象,故以65岁为界分为2组进行比较各单一HPV感染型别检出率,再进行各主要单一HPV型别年龄段分布(以10岁作为一个年龄段)之间的比较。
2 结 果
2.1 宫颈鳞癌患者HPV感染型别检出率及<65岁和≥65岁者单一HPV感染型别检出率比较1125例宫颈鳞癌患者中,单一HPV感染型别检出率为75.64%(851/1125),均为高危型HPV感染;多种HPV感染型别者185例(其中二型感染者146例,三型感染者30例,四型感染者3例,五型和六型感染者各2例,七型和九型感染者各1例),多种型别检出率为16.44%(185/1125)。单一HPV感染型别者中高危型HPV前8位依次是16型为69.80%(594/851)、18型为7.52%(64/851)、58型为5.99%(51/851)、52型为3.53%(30/851)、33型为3.41%(29/851)、31型为3.29%(28/851)、59型为2.35%(20/851)、45型为1.06%(9/851)。851例宫颈鳞癌患者的单一HPV感染型别2组年龄检出人数及百分比见表1。
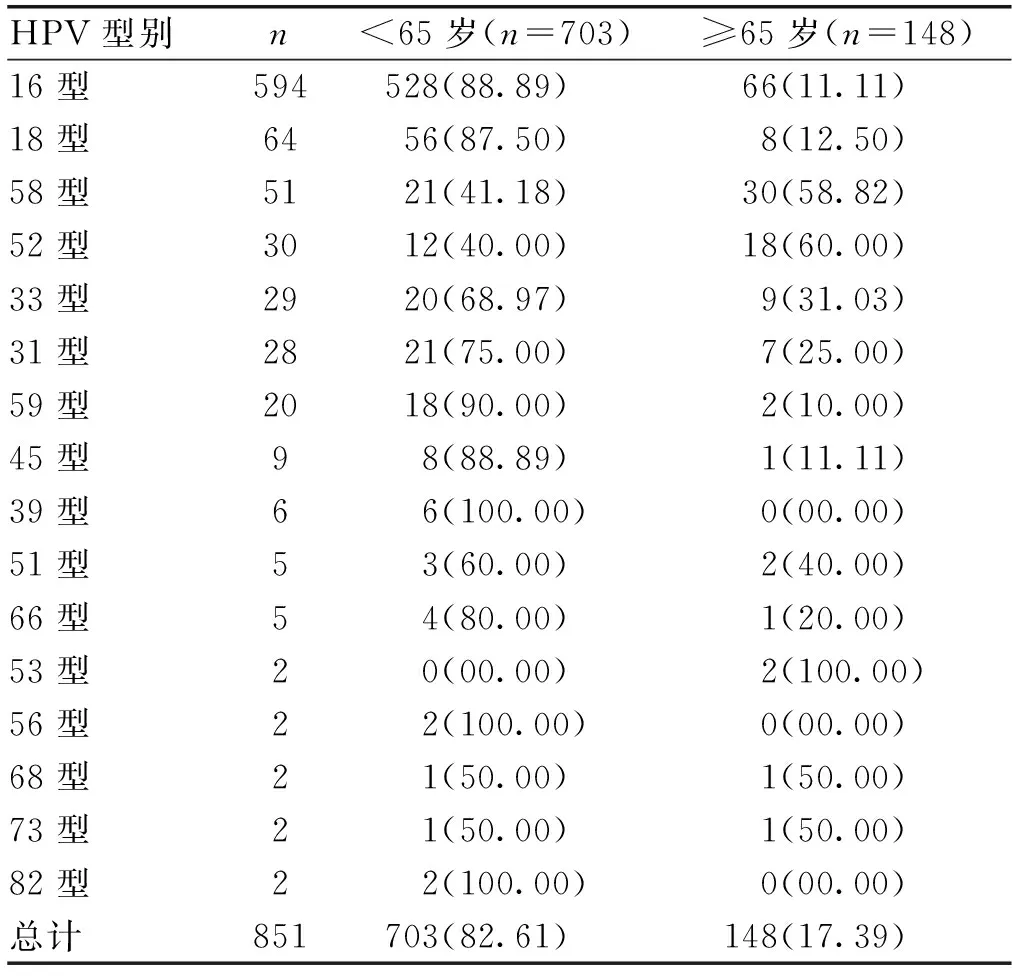
表1 851例宫颈鳞癌患者的单一HPV感染型别2组年龄检出人数及百分比[n(%)]
2.2 宫颈鳞癌患者的前7位单一HPV感染型别的平均年龄及前8位不同年龄段单一HPV感染型别的分布状况851例宫颈鳞癌患者的单一HPV感染型别前7位的平均年龄依次是:16型感染者为50.76岁,18型感染者为52.23岁,59型感染者为55.70岁,33型感染者为56.69岁,31型感染者为56.93岁,52型感染者为66.27岁,58型感染者为66.57岁。前8位单一HPV感染型别各年龄段分布百分比见表2。其他8种单一HPV感染型别共26例,分别为39型6例、51型5例、53型2例、56型2例、66型5例、68型2例、73型2例、82型2例。

表2 851例宫颈鳞癌患者的前8位不同年龄段单一HPV感染型别分布百分比(%)
2.3 宫颈鳞癌患者各单一HPV感染型别不同年龄段分布的比较宫颈鳞癌患者单一HPV感染型别在年龄段分布上的比较显示,16型与52型、16型与58型、18型与52型、18型与58型、45型与52型、45型与58型这6组型别之间比较,在年龄段上差异有统计学意义(P<0.01),提示这5种单一HPV感染型别之间在年龄段的分布上明显不同。宫颈鳞癌患者单一HPV感染型别在年龄段之间的比较:30~39岁和40~49岁分别与60~69岁、70~79岁和80~89岁比较,50~59岁和60~69岁与70~79岁和80~89岁比较,≤29岁与80~89岁比较,不同的HPV感染型别在年龄段分布上有明显的差异性(P<0.05),提示这11组年龄段之间比较,单一HPV感染型别分布有明显不同。
3 讨 论
宫颈癌的主要致病因素与HR-HPV的持续性感染密切相关,因此,HR-HPV检测已成为宫颈癌筛查的一个主要手段。由于不同的HR-HPV型别致宫颈癌的风险度不一样,其分布的年龄段及比例也不一样。因此,弄清楚不同的HR-HPV型别的致癌风险排序以及不同年龄段的分布状况,可为妇产科医师提供临床宫颈癌的防治策略。由于不同的HR-HPV型别致宫颈鳞癌的分型数据库的建立都是以宫颈鳞癌组织标本检出的分型结果作为评判标准的,因此,宫颈鳞癌的不同HR-HPV感染型别不同年龄段分布情况也应依据宫颈鳞癌组织的HPV分型检测结果来进行分析。6、11、42、43、81、83型等低危型HPV一般不单独出现在宫颈癌组织中,只是与HR-HPV以混合感染的方式存在于宫颈癌组织中,宫颈鳞癌的发生与16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82型等HR-HPV感染相关联[3,6]。目前,致宫颈癌风险度最高的两种HR-HPV型别分别是HPV16型和18型。由于不同的HR-HPV型别致宫颈鳞癌风险度以及年龄段分布不同,了解其规律有助于临床医师更好地对HPV感染患者的患癌风险进行个体化预判。因此,弄清楚主要的HR-HPV致癌风险度及不同年龄段分布状况,对我国宫颈鳞癌的防治及HPV预防性疫苗的研制都具有循证医学的意义。
从HPV的分类及生物学特征来分析单一HPV型别感染前7位宫颈鳞癌患者平均年龄,根据HPV的属种分类原则,同一种的HPV型别之间会有一样的或者相似的分子特点和致病属性。a-PV属第7种中有HPV的18、39、45、59、68、70型6个成员,占本文单一HPV感染型别前8种的3个型别,其中18型平均年龄52.23岁,比我国较常见的59型平均年龄55.70岁低3.47岁,提示18型致癌力不但排名第二位,平均年龄较低,是此组最强的型别,且易侵袭年龄偏小的女性;a-PV属第9种中有HPV的16、31、33、35、52、58、67型7个成员,占本文单一HPV感染型别前8种的5个型别,其中16型平均年龄50.76岁,比18型平均年龄小1.47岁,也比我国常见的31、33、52和58型的平均年龄56.93岁、55.24岁、66.27岁和66.57岁小4.48~15.81岁。我国崔剑峰等[7]报道宫颈鳞癌的多中心的研究表明单一18型平均年龄为40.7岁,16型平均年龄为48.6岁,其他型别平均年龄为55.3岁。与本研究的宫颈鳞癌平均年龄比较,16型和18型平均年龄都较小,后者比前者平均年龄更年轻,且18型比16型平均年龄更小,与本研究的结果不一样,这可能与两研究所采用的检测试剂,标本获取的地域、时间及数量不同有关。
妇产科医师在临床工作中要把a-PV属第7种和第9种中的HPV各型别作为关注的重点,其中16型是本研究中常见7个型别中致癌力排名第一位,平均年龄最低,是2组中致癌力最强的型别,且最易侵袭年龄较小的女性。因此,妇产科医师首先要对宫颈病变的患者行HPV分型检测,接着确定此患者为持续性感染者后来评估不同HR-HPV感染型别的年龄风险度,对16型感染的患者从23~88岁年龄段的都应该给予关注,重点是40~49岁、50~59岁两个高发病年龄段的患者,宫颈鳞癌发病年龄峰值为40~49岁;对18型感染者从29~69岁年龄段的给予关注,关注的重点是50~59岁、40~49岁、60~69岁3个高发病年龄段的患者,宫颈鳞癌发病年龄峰值为50~59岁;对58型感染者从44~87岁年龄段的给予关注,关注的重点是70~79岁、60~69岁、50~59岁、80~89岁4个高发病年龄段的患者,宫颈鳞癌发病年龄峰值为70~79岁;对52型感染者从44~90岁年龄段的给予关注,关注的重点是70~79岁、60~69岁、50~59岁3个高发病年龄段的患者,宫颈鳞癌发病年龄峰值为70~79岁;其他较常见3种HR-HPV感染型别与发病年龄的关系见表2;本研究提示16型感染者30岁以下,70岁以上发病率较低,18型感染者40岁以下发病率较低,70岁以上无发病者,58型感染者44岁以下无发病者,86岁以上无发病者,52型感染者44岁以下无发病者,80岁以上发病率较低。由此可见,HR-HPV感染型别与患者发病年龄段及风险度存在着差异性。
在2009年美国阴道镜及宫颈病理学会(ASCCP)的增补版中已明确提出对HPV16型、18型阳性的妇女,建议立即行阴道镜检查[8-10]。由于HPV16型、18型为高致癌型HPV,在女性宫颈病变筛查中HPV分型检测极具必要性。本研究排除多型别HPV感染对型别分析存在着一些干扰因素,从单一HPV感染型别来分析,HPV16型感染率为69.80%,HPV18型感染率为7.52%,HPV58型感染率为5.99%,HPV52型感染率为3.53%,HPV33型感染率为3.41%,HPV31型感染率为3.29%,HPV59型感染率为2.35%。单一16型与18型感染率比较,差异有统计学意义(P<0.05),单一18型与58型感染率比较,差异无统计学意义(P>0.05),按照HPV16型、18型阳性的妇女,建议直接做阴道镜检查的原则,鉴于我国HPV感染的国情单一HPV58型和52型感染女性,尤其是44岁以上的妇女,也应建议直接做阴道镜检查。因此,我国应该把a-PV属第7种和第9种的HPV感染的患者作为重点关注的对象。因不同的HPV型别在宫颈鳞癌患者中的致癌力以及侵袭患者发病年龄段不尽相同,对宫颈鳞癌前病变患者行HR-HPV分型检测,不但可给临床妇产科医师提供宫颈高度病变治疗前后的型别对比,也可提供不同HPV型别感染与患者发病年龄段致癌风险度的判断和评估。
我国从2009年开展对农村妇女宫颈癌的筛查工作,将农村妇女宫颈癌的筛查的年龄划定在35~64岁的女性作为筛查对象[3,11,12]。依据本研究宫颈鳞癌患者中各主要单一HPV型别感染的年龄段分布情况来看,宫颈鳞癌患者中感染了单一HPV16型、18型、45型、59型年龄在<65岁以下者,接近90%,而≥65岁者在10%~12.5%之间;感染了单一HPV31型和33型年龄在<65岁以下者,在70%左右,而≥65岁者在25%~31%之间;而感染了单一HPV52型和58型年龄在<65岁以下者,在40%~41%之间,而≥65岁者在59%~60%之间。有研究提示,从年龄分布看,HPV16型35岁以下女性中的感染率更高,而HPV52、58型在60岁以上的妇女中更多见[13]。通过宫颈鳞癌患者中HPV感染型别与年龄分布特点分析,我国在行农村妇女宫颈癌筛查时,应该首先采用我国常见高危型HPV作为分型初筛,这样可以针对女性筛查的高危HPV的型别进行分流,16型和18型感染者建议行p16/ki-67双染检查,阳性者行阴道镜检查。HPV31型和33型感染者行p16/ki-67双染检查,如双染检查阴性,1~2年追踪复查,阳性者均行阴道镜检查,HPV52型和58型感染者,如双染检查阴性,2~3年追踪复查,阳性者均行阴道镜检查。由于HPV31型和33型及HPV52型和58型感染者存在着HPV感染年龄和宫颈鳞癌发病年龄延迟现象(≥65岁者在25%~60%之间),因此,临床妇产科医师对这4种HPV型别感染者更应行高年龄段的随访和追踪复查工作。
总之,本文研究提示HPV16型是致宫颈鳞癌风险度最高的一个型别,发病率峰值尤其突出,其次是HPV18型、58型、52型、33型、31型、59型、45型。HPV16型和18型更易致病年龄较小的女性群体,而HPV58型和52型则更易致病年龄较大的女性群体。单一16型的致癌高峰年龄段为40~49岁,提示满足上述条件患者应引起足够重视,尽早联合细胞学检查,pp16/ki-67双染等手段进行分流;而单一58型的致癌高峰年龄段为70~79岁,提示HPV58型感染患者患癌年龄延迟现象,临床应延长对此类患者的随访追踪。现阶段检测HR-HPV已成宫颈病变筛查的一个主要手段。随着对宫颈癌致癌机制的深入研究,宫颈病变的筛查策略从原来的以单一细胞学为基础的筛查转变为以HR-HPV为基础的多种筛查手段并存的阶段,这也给我国妇产科医师带来了新的挑战。对持续性HR-HPV感染阳性患者的病变风险评估及分流判读尤其重要。因此,宫颈癌筛查的关注点除了宫颈病变防治外,也要重视HR-HPV阳性患者的风险度的判断和预测,也就是说,妇产科医师首先对女性受检者行HPV分型检测,并判断不同型别HPV致癌的风险度,同时结合患者的年龄做出年龄风险度的预判。因p16/ki-67双染能够提供HR-HPV检测阳性患者行阴道镜分流的同时,对于宫颈病变风险预测均有很好的临床应用价值。目前,宫颈HR-HPV分型检测、细胞学检查和p16/ki-67双染(宫颈病变筛查分流标记物)检测已组合使用作为宫颈病变筛查加分流进入临床,对提高临床妇产科的宫颈癌筛查的检出率具有十分重要的作用[14-18]。
