马来酸依那普利有关物质的合成
2020-12-01于立国孙光祥朱怡君
于立国, 孙光祥, 王 兵, 朱怡君
(上海医药集团 常州制药厂有限公司,常州 213018)
马来酸依那普利(Enalapril,1),化学名为N-[(S)-1-乙氧羰基-3-苯丙基]-L-丙氨酰-L-脯氨酸顺丁烯二酸盐,是由默克公司研制开发的第二代血管紧张素转化酶(ACEI)抑制剂[1],1985年美国FDA批准上市,临床上用于治疗高血压和充血性心力衰竭,由于其降压效果确切,副作用小,长期用药不产生耐受性,其已被用作一线降压药而广泛应用[2]。
马来酸依那普利的合成工艺[3-5]包括:3-苯甲酰丙烯酸乙酯和L-丙氨酸经不对称Miachel加成制得N-[(S)-1-乙氧羰基-3-氧代苯丙基]-L-丙氨酸,该化合物经Pd/C还原得N-[(S)-1-乙氧羰基-3-苯丙基]-L-丙氨酸,再经三光气作用和L-脯氨酸缩合、成盐(Scheme 1)。
化学药物的杂质[6]是指存在于化学药物中的无治疗作用或影响药物稳定性、疗效,甚至对人体健康有害的物质。因此杂质合成研究在药物质量研究控制中占有重要地位,需对原料药进行全面的杂质谱[7]研究和控制,本文在欧洲药典10.0基础上,结合马来酸依那普利合成工艺和马来酸依那普利片[8]稳定性,对有关物质B、C、D和H的来源进行推测和合成研究,对马来酸依那普利原料药和制剂一致性评价具有指导意义。其中,杂质B是合成马来酸依那普利最直接起始物料,有可能残留在成品中;杂质C和D既是工艺副产物,亦是降解杂质,C主要是在碱性条件下酯基水解生成,酸性条件下分子内脱水环合成双酮杂质D;杂质H可能是起始物料2中含有环己基类似物或是在还原3时苯基还原成环己基,再一直衍生传递至成品形成,其结构均经1H NMR和MS(ESI)确证。
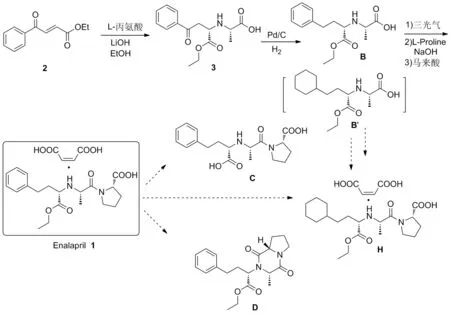
Scheme 1
1 实验部分
1.1 仪器与试剂
YRT-3型熔点仪;Bruker-500 MHz型核磁共振仪(TMS为内标); SPD-20AD型高效液相色谱仪;Q-TOF型质谱仪。
1,常州制药厂有限公司;其余所用试剂均为分析纯。
1.2 合成
(1)N- [(S) -1-乙氧羰基-3-苯丙基]-L-丙氨酸(B)的合成
在250 mL单口瓶中加入L-丙氨酸4.45 g(50 mmol, 1.04 eq.),氢氧化锂一水合物2.1 g(50 mmol, 1.04 eq.),纯化水(4 mL),乙醇(135 mL),升温至75 ℃,反应30 min,降温待用。
在500 mL三口瓶中加入苯甲酰丙烯酸乙酯9.8 g(48 mmol, 1 eq.),无水乙醇(100 mL),降温至0~-5 ℃,滴加上述L-丙氨酸锂盐溶液,加毕反应15 min(TLC检测)。加入浓盐酸(4 mL)调节pH 值为4~5,固体逐渐析出,室温搅拌过夜。抽滤,滤饼用乙醇(2×30 mL)洗涤,50 ℃鼓风干燥得类白色固体36.6 g,收率47.1%。
在250 mL三口瓶中依次加入无水乙醇(100 mL)、浓硫酸(2 mL),35 g(17 mmol,1 eq.),10% Pd/C催化剂0.5 g(10%wt),氮气和氢气分别置换3 次后,35 ℃反应5 h(TLC检测)。抽滤,减压浓缩,加入水(50 mL)和二氯甲烷(50 mL),分液,用二氯甲烷(2×50 mL)萃取,合并有机相,无水硫酸钠干燥,浓缩得到固体,用溶液(乙醇/水=1/1,V/V)重结晶,得到白色固体B2.5g, 收率52.5%, HPLC纯度100.0%, m.p.150~153 ℃[9];1H NMR(CDCl3, 400MHz)δ:1.25~1.29(t, 3H), 1.45~1.47(d, 3H), 2.02~2.17(m, 2H), 2.68~2.72(m, 2H), 3.38~3.43(q, 1H), 3.58~3.61(t, 1H), 4.16~4.22(q, 2H), 6.57(s, 2H), 7.11~7.13(d, 2H,J=8 Hz), 7.15~7.17(d, 1H,J=8 Hz), 7.20~7.24(t, 2H,J=8 Hz); MS(ESI)m/z: 280{[M+H]+}。
(2)N-[(S)-1-羧基-3-苯丙基]-L-丙氨酰-L-脯氨酸(C)的合成
250 mL三口瓶中依次加入纯化水(100 mL),氢氧化钠4 g(100 mmol, 5 eq.),110g(20 mmol, 1 eq.), 25~30 ℃反应6 h(TLC检测)。水解液直接硅胶柱层析(用0.5 N氨水10 L洗脱)纯化,收集pH 2~12范围内的洗脱液,浓缩后加入3 N HCl调节至pH至2.5~3,固体析出,抽滤,滤饼用无水乙醇(20 mL)洗涤,60 ℃干燥4 h得类白色固体C5 g,收率70.7%, HPLC纯度100.0%, m.p.148~152 ℃[10];1H NMR(DMSO-d6, 400MHz)δ: 1.53~1.54(d, 3H), 1.74~1.76(m, 1H), 2.25~2.26(m, 2H), 2.27~2.29(m, 2H), 2.31~2.35(m, 1H), 2.73~2.81(m, 2H), 3.45~3.48(t, 1H), 3.59~3.65(t, 2H), 4.26~4.31(m, 1H), 4.48~4.52(m, 1H), 7.15~7.17(d, 2H,J=8 Hz), 7.23~7.25(d, 1H,J=8 Hz), 7.26~7.28(t, 2H,J=8 Hz); MS(ESI)m/z: 347.1{[M-H]-}。
(3)4N- [(S) -1′-乙氧羰基-3′-苯丙基]-3S-甲基-2,5-二酮-6S-H-1,4-二氮杂双环[4,3,0]壬烷(D)的合成
(4)N-[(S)-1-乙氧羰基-3-环己基丙基]-L-丙氨酰-L-脯氨酸马来酸盐(H)的合成
在100 mL氢化加压罐中依次加入14.9 g(10 mmol, 1 eq.),无水乙醇(50 mL),冰醋酸(50 mL),催化剂PtO22.5 g(50% wt)[12],氮气和氢气分别置换3 次后,40 ℃, 5 MPa加压还原24 h(TLC检测)。抽滤,滤液浓缩,残余经硅胶柱层析(洗脱剂: 二氯甲烷/甲醇=20/1~10/1,V/V)纯化得无色油状液体1.9 g,乙酸乙酯中与马来酸成盐得类白色固体H2 g,收率 40.0%, m.p.155~157 ℃;1H NMR(CDCl3, D2O, 400MHz)δ: 0.85~1.32(m, 11H, -C6H11), 1.49~1.51(m, 3H, CH3), 1.66(s, 3H, CH3), 1.68(m, 2H, CH2), 1.90~2.01(m, 2H, CH2), 2.16~2.37(m, 4H, CH2, CH2), 3.48~3.58(m, 2H, CH2), 3.59~3.72(m, 1H, CH), 4.04~4.06(m, 1H, CH), 4.25~4.28(m, 2H, CH2), 4.49~4.52(m, 1H, CH), 6.29(s, 2H, CH=CH); MS(ESI-)m/z: 381.3{[M-H]-}。
探讨了马来酸依那普利原料药及制剂中可能产生的四种杂质B、C、D和H的形成原因,对产品质量和工艺优化改进均有指导意义。
在杂质B合成中,还原剂Pd/C用量为10%,较文献用量大大降低(文献[9]约80%);不仅精制纯度较高,而且工艺优化中可大幅降低成本,为“4+7”带量采购提供竞争力。
在杂质C合成中,以普通硅胶柱层析纯化替代离子柱纯化[10],操作简便,经乙醇精制,所得产品纯度达到99.9%以上。
在杂质H合成中,参照专利但加倍PtO2用量,使苯环能完全转化,通过碘熏进行监测;并用柱层析纯化革除HPLC制备,操作简便且降低成本,所得油状物首次采用马来酸成盐,精制所得白色固体纯度优异(大于99.9%)。
基于马来酸依那普利制备工艺对其可能存在的杂质进行来源分析,首次系统报道了关键的4个杂质B、C、D和H的合成,纯度均大于99.9%,其结构均经1H NMR和MS(ESI)确证。
