卡马西平致重型药疹并HLA-B*1502基因阴性1例报道
2020-12-01康健捷刘俊花罗晓媛陈胡林邓兵梅杨红军
康健捷,刘俊花,罗晓媛,陈胡林,邓兵梅,杨红军
1 病例资料
患者,男,58岁,因“双下肢麻木无力伴二便障碍”入院,磁共振示颈胸段脊髓内异常信号,血清APQ4 抗体阳性,抗髓鞘碱性蛋白(myelin basic protein,MBP)抗体及抗髓鞘少突胶质细胞糖蛋白(myelinoligodendrocyteglycoprotein,MOG)抗体阴性,诊断为视神经脊髓炎谱系疾病(APQ4 抗体阳性)。给予甲泼尼龙冲击治疗后,患者双下肢麻木乏力症状有所好转,甲泼尼龙片持续减量至8mg/d维持治疗,同时服用碳酸钙D3 片1 片/d、兰索拉唑片15 mg/d(患者曾服用多年)。患者双下肢发作性痉挛性疼痛,每天发作约40~50 次,每次持续2~10 min。在该患者HLA-B*1502基因检测结果为阴性后,给予卡马西平(国产)0.1g3 次/日治疗,服药第2 天起患者双下肢痉挛性疼痛完全缓解。第29天患者出现面部潮红、眼睛发红,第30天上肢和躯干出现少量红色斑疹,第31 天全身出现广泛性红色斑疹,并发热至38.5℃,第32 天患者到皮肤科就诊,考虑为卡马西平所致药物性皮炎,急查血常规、肝肾功能,结果显示患者嗜酸性粒细胞增多,白细胞8.66×109/L[正常(4~10)×109/L]、嗜酸性粒细胞(eosinophilia,EO)1.108×109/L[正常(0.02~0.5)×109/L]、EO%12.8%(正常0.5%~5%),肝、肾功能正常。立即停用卡马西平,并给予氯雷他定(10 mg po)、地塞米松10 mg(ivgtt qd×8 d)和维生素C 2g(ivgtt qd×8 d)抗过敏及补液治疗。第40 天患者面部、鼻腔和阴囊皮肤和粘膜出现大量鳞屑,第42 天患者双手皮肤大量脱屑,呈鳞片状,第50天患者皮肤和粘膜基本停止脱屑(图1),患者自述皮疹发病全程无皮肤瘙痒和疼痛。
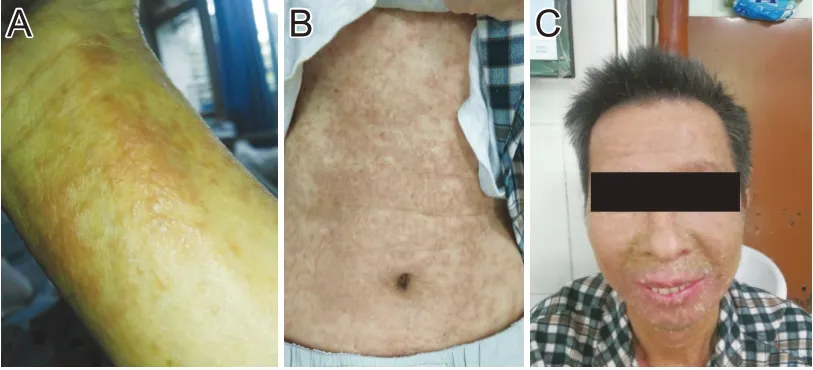
图1 患者皮疹
2 讨论
本例患者确诊为视神经脊髓炎谱系疾病(APQ4 抗体阳性),脊髓损害导致双下肢痉挛性疼痛发作频繁,给予卡马西平第2天起患者双下肢痉挛性疼痛完全缓解,继续服用卡马西平0.1 g 3次/日治疗,第29 天开始陆续出现皮肤、粘膜皮疹和脱屑,伴有发热,实验室检查结果显示嗜酸粒细胞绝对值和比例显著升高。停用卡马西平并促进药物排泄,给予抗过敏治疗后,皮疹逐渐消退。经皮肤科会诊诊断为药物性皮炎(重症型),患者自诉既往无药物过敏病史,长期服用兰索拉唑片、碳酸钙D3片,服用卡马西平29 d 后出现皮疹,出现皮疹前2月内无新加其他药物,根据用药史及药物致敏潜伏期,可排除兰索拉唑片、碳酸钙D3 片引起药疹,考虑为卡马西平所致重型药疹。临床上将病情严重、死亡率较高的 Stevens-Johnson 综合征(Stevens-Johnson syndrome,SJS)、中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN)、剥脱性皮炎、药物超敏反应综合征(drug hypersensitivity syndrome,DHS)称为重型药疹,且该重型药疹诱发药物主要为抗癫痫药及抗代谢药,如卡马西平及别嘌呤醇等较常见。研究显示过敏性皮炎与个体对卡马西平的代谢异常有关[1-4]。卡马西平进入体内后主要通过肝脏CYP3A4 酶代谢,产生活性代谢产物10,11-环氧化卡马西平,如果某些个体内CYP3A4 酶活性增强,将使10,11-环氧化卡马西平产生过多造成其浓度过高,从而与体内的大分子物质结合成为免疫原,重型药疹是通过药物或其他抗原引起人类组织相容性复合物限制性表达,从而激发细胞毒性T 细胞引起的特定变应性反应。研究显示,卡马西平诱发的SJS/TEN 型的重型药疹与用药剂量无明显相关性[5,6],这点同其他变态反应与药物剂量无关一样。该患者服用卡马西平的剂量为每日0.3 g,属于中等剂量。SJS和TEN在临床上被认为是同一种疾病的不同表现形式,SJS 表现为严重渗出性多形性红斑,累及黏膜,进一步发展出现水疱、皮肤黏膜溃疡及表皮剥脱、TEN 等。表皮剥脱少于体表面积10%为SJS,大于30% 为TEN,介于10%~30%者为SJS 与TEN共存,除皮肤黏膜的变化外,SJS/TEN也常伴发热、结膜出血以及心肾等多脏器全身性损害,疾病进展较快,若未得到及时处理,严重者可致死。SJS 除了会转化为TEN外,还可转化为剥脱性皮炎及DHS。
散在的病例报道荟萃分析显示,卡马西平所致的皮肤过敏反应是一种特异性反应,属于迟发性全身性过敏反应,90%以上的严重皮肤反应发生在服药后的前2月,潜伏期2~60 d,中位数为13 d,服用卡马西平的前2月重型药疹的发生风险在1/1 000~10/1 000[5],该患者在服用卡马西平第29 天开始陆续出现皮肤、粘膜皮疹,与既往报道一致。据统计数据显示卡马西平所致的皮肤过敏反应存在明显的种族差异,在主要是高加索人群的国家中每10 000 名新用药者估计发生1~6 例,但在中国、泰国、东南亚地区等亚裔系其他国家,卡马西平严重皮肤不良反应发生率高10 倍。SJS 发病率约为每百万人1.2~7 例,男性多于女性。另外奥卡西平是卡马西平的衍生物,二者存在交叉过敏,且卡马西平的不良反应发生率较奥卡西平高。针对服用奥卡西平出现皮肤不良反应的13例病例分析结果显示:奥卡西平所致重症药疹发生时间最快出现在用药1 d 后,最迟为连续用药40 d后,大多数分布在14 d 内[7]。2018 年2 月临床药物基因组实施联盟(CPIC)指南发布关于人白细胞抗原(human leukocyte antigen,HLA)基因变异与卡马西平及奥卡西平致特定的皮肤不良反应相关。HLA-B*1502 阳性与卡马西平致SJS/TEN 型的重型药疹百分百相关,在东南亚及中国等国家和地区超过90%的CBZ 诱发SJS/TEN 患者均为HLA-B*1502 阳性,但仍有近10%为HLA-B*1502 阴性,其主要变异基因位点有HLA-B*1511、B*1521、B*1558、B*1508、B*4001及B*4601。Song等[8]报道卡马西平的另一个可能相关基因位点为HLA-A*3101。文献报道13例服用奥卡西平发生SJS 的患者中,共8例进行基因型测定,其中HLA-B*1502 阳性6 例,HLA-B*1518/ HLA-B*4001阳性2 例[7]。该患者在服用卡马西平前已进行HLA-B*1502 基因检测,结果显示阴性,在服用卡马西平29 d出现迟发性重型药疹,笔者推测该患者可能存在HLA-B*1502 以外的易感基因阳性。
在神经专科疾病中,卡马西平是治疗癫痫、三叉神经痛、糖尿病神经病变引起的疼痛、脊髓损害所致肢体痉挛性疼痛、神经性肌强直等疾病的主要用药[9,10],应用广泛,疗效确切,而重型药疹是卡马西平罕见、严重的不良反应之一,其潜伏期短、进展迅速、病情重。所以,神经专科和康复专科医务工作者对卡马西平所致的皮肤过敏反应应高度重视。用药前应严格掌握适应证,详细询问药物过敏史。因为在中国卡马西平严重皮肤不良反应发生率较其他国家相对偏高,而HLA-B*1502 基因检测阳性与卡马西平致SJS/TEN 型的重型药疹百分百相关,超过90%的CBZ 诱发SJS/TEN 患者均为HLA-B*1502 阳性,所以推荐在处方卡马西平/奥卡西平之前,应常规对患者进行HLA-B*1502基因型检测,检测结果为阳性者应当避免使用卡马西平/奥卡西平,而对于HLA-B*1502基因型检测阴性的患者,在服用卡马西平/奥卡西平时仍然不能忽视皮肤过敏的不良反应。应做好用药前宣教,详细向患者告知规范用药的重要性、可能出现的不良反应及如何自行观察,以引起患者的高度重视。在临床使用过程中应定期复诊、检查皮肤粘膜情况并注意监测血常规、肝功能和肾功能等。卡马西平诱发的重型药疹,其预后与药物的类型及剂量无关,而受药物使用时间的影响较大,一旦发生,治疗的关键在于早诊断并及时停药,同时进行综合治疗。研究显示,早期足量使用皮质激素能尽快控制病情发展,缩短炎症期,从而提高治愈率、缩短疗程,同时予葡萄糖酸钙、抗组胺药、维生素C等改善症状,保护内脏功能(护肝药等),保证液体量及热量供给,广谱抗生素的应用预防和治疗感染及败血症,炉甘石洗剂外用缓解症状,加强皮肤和黏膜护理,避免继发感染,避免接触其他过敏原[11]。
目前,临床上可通过检测HLA-B*1502 基因指导芳香族类抗癫痫药物卡马西平的使用,但在使用药物前对患者进行相关基因检测尚未引起临床医师的足够重视,若HLA-B*1502 基因阴性提示不容易药物过敏的患者更不会得到医师的密切关注,但仍有发生严重不良反应的可能,甚至危及生命。临床医师应加强对基因检测必要性的认识和对重型皮疹的警惕。需要密切观察皮肤、粘膜情况并注意监测血常规、肝肾功能等。
