基于PI3K/Akt/GSK3β信号通路的芥子酸抗Aβ1-42致PC12细胞损伤的机制研究
2020-11-30薛迪刘宇超贾永明汪娜刘学伟
薛迪 刘宇超 贾永明 汪娜 刘学伟

摘 要 目的:基于磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)/糖原合成激酶3β(GSK3β)信號通路探讨芥子酸(SA)抗β淀粉样蛋白1-42(Aβ1-42)致PC12细胞损伤的作用机制。方法:将大鼠PC12细胞随机分为对照组、Aβ组(Aβ1-42 2 μmol/L)、Aβ+SA组(Aβ1-42 2 μmol/L +SA 100 μmol/L)、Aβ+SA+LY组[Aβ1-42 2 μmol/L +SA 100 μmol/L+LY294002(PI3K抑制剂)10 μmol/L]、Aβ+LY组(Aβ1-42 2 μmol/L+LY294002 10 μmol/L)、LY组(LY294002 10 μmol/L)。除对照组、LY组外,其余各组细胞均以Aβ1-42复制损伤模型。培养24 h后,使用显微镜观察各组细胞的形态,采用MTT法检测各组细胞的存活率;采用Western blotting法检测各组细胞PI3K、p-PI3K、Akt、p-Akt、GSK3β、p-GSK3β蛋白的表达情况。结果:与对照组比较,Aβ组细胞数量变少、部分突触断裂消失,其存活率以及p-PI3K/PI3K、p-Akt/Akt、p-GSK3β/GSK3β比值均显著降低(P<0.05或P<0.01)。与Aβ 组比较,Aβ+SA组细胞变圆、突触变多,其存活率以及p-PI3K/PI3K、p-Akt/Akt、p-GSK3β/GSK3β比值均显著升高(P<0.05)。与Aβ+SA组比较,Aβ+SA+LY组细胞部分突触断裂,其存活率以及p-PI3K/PI3K、p-Akt/Akt、p-GSK3β/GSK3β比值均显著降低(P<0.05);Aβ+LY组细胞碎片较多,其存活率虽有下降但差异无统计学意义,且p-PI3K/PI3K、p-Akt/Akt、p-GSK3β/GSK3β比值亦无明显变化(P>0.05)。单独给予 LY294002对PC12细胞的形态、存活率以及p-PI3K/PI3K、p-Akt/Akt、p-GSK3β/GSK3β比值均无显著影响(P>0.05)。结论:SA可能通过激活PI3K/Akt/GSK-3β信号通路对Aβ1-42诱导的PC12 细胞损伤发挥保护作用。
关键词 芥子酸;β淀粉样蛋白;磷脂酰肌醇-3-激酶/蛋白激酶B/糖原合成激酶3β信号通路;PC12细胞
中图分类号 R285 文献标志码 A 文章编号 1001-0408(2020)20-2519-05
DOI 10.6039/j.issn.1001-0408.2020.20.16
ABSTRACT OBJECTIVE: To investigate the mechanism of sinapic acid (SA) against PC12 cell injury induced by Amyloid β1-42 protein (Aβ1-42) based on PI3K/Akt/GSK3β signaling pathway. METHODS: PC12 cells of rats were randomly divided into control group, Aβ group (Aβ1-42 2 μmol/L), Aβ+SA group (Aβ1-42 2 μmol/L+SA100 μmol/L), Aβ+SA+LY group [Aβ1-42 2 μmol/L+SA 100 μmol/L+LY294002 (PI3K inhibitor) 10 μmol/L], Aβ+LY group (Aβ1-42 2 μmol/L+LY294002 10 μmol/L) and LY group (LY294002 10 μmol/L). Except for control group and LY group, the cells of other groups were replicated the damage model with Aβ1-42. After 24 hours of culture, the morphology of cells was obsened in each group with a microscope, and MTT assay was adopted to determine the cell viability of PC12 cells in each group. Western blotting assay was used to detect the expression of PI3K, p-PI3K, Akt, p-Akt, GSK3β and p-GSK3β in cells of each group. RESULTS: Compared with control group, the number of cells decreased and some synaptic breaks disappeared in Aβ group while cell viability, ratio of p-PI3K/PI3K, p-Akt/Akt and p-GSK3β/GSK3β in Aβ group were decreased significantly (P<0.05 or P<0.01). Compared with Aβ group, the cells became round and synapses became more in Aβ+SA group while cell viability, the ratio of p-PI3K/PI3K, p-Akt/Akt and p-GSK3β/GSK3β were increased significantly (P<0.05). Compared with Aβ+SA group, some synaptic breaks occurred in Aβ+SA+LY group while cell viability, the ratio of p-PI3K/PI3K, p-Akt/Akt and p-GSK3β/GSK3β were decreased significantly (P<0.05); Aβ+LY group had more cell debris, and the cell viability was decreased, but the difference was not significant, and the ratio of p-PI3K/PI3K, p-Akt/Akt and p-GSK3β/GSK3β had no significant change (P>0.05); LY294002 alone had no significant effect on morphology, cell viability and the ratio of p-PI3K/PI3K, p-Akt/Akt or p-GSK3β/GSK3β (P>0.05). CONCLUSIONS: SA may play a protective role against PC12 cell injury induced by Aβ1-42 through activating PI3K/Akt/GSK-3β.
KEYWORDS Sinapic acid; β-amyloid protein; PI3K/Akt/GSK3β signaling pathway; PC12 cell
阿尔茨海默病(Alzheimers disease,AD)是一种以进行性认知功能障碍为主要临床表现的神经退行性疾病[1]。AD患者的主要病理特征为β淀粉样蛋白(β-amyloid protein,Aβ)沉积形成的老年斑、Tau蛋白过度磷酸化引起的神经原纤维缠结(Neurofibrillarytangles,NFTs)和神经细胞缺失[2]。已有研究显示,向大鼠脑内注射Aβ后,可引起其记忆障碍及神经损伤;此外,AD患者大脑中也存在Aβ异常沉积和大量的神经细胞损伤,提示Aβ诱导的神经细胞损伤可能为AD发生的重要原因[3-4]。研究表明,Aβ的主要成分Aβ1-42具有神经毒性作用,可致神经细胞损伤,从而引发神经系统发生退行性病变[4-5]。
磷脂酰肌醇-3-激酶/蛋白激酶B(PI3K/Akt)信号转导通路是调控神经细胞分化、存活、凋亡的通路之一,也是调节受损神经细胞修复、促进神经细胞存活的重要信号通路[6]。LY294002是一种能够阻断上述信号传导的蛋白激酶抑制剂,可对细胞中的PI3K信号通路发挥特异性抑制作用,并可抑制PI3K/Akt信号途径,如抑制Akt磷酸化等,从而对下游靶蛋白的表达进行调节[7]。糖原合成激酶3β(GSK3β)是Akt的重要底物,其活性受Akt的负调节,并与Tau蛋白的过度磷酸化密切相关,同时Aβ的生成和沉积亦能导致Tau蛋白的过度磷酸化[8-9]。已有研究显示,Aβ的神经毒性与PI3K/Akt/GSK3β信号通路相关[10-11],因此找到可调节PI3K/Akt/GSK3β信号通路相关位点的靶向药物以对抗Aβ的神经毒性,可能成为防治AD的有效方法之一。研究发现,芥子酸(Sinapic acid,SA)可减轻Aβ1-42诱导的小鼠海马体CA1区神经细胞的损伤,使红藻氨酸引起的小鼠海马体神经细胞损伤得到改善,并能够显著减轻链脲佐菌素诱导的大鼠记忆缺陷并抑制神经细胞变性,且呈一定的剂量依赖性[12-13]。基于此,本研究以Aβ1-42诱导大鼠PC12细胞制备AD细胞病理模型,并以LY294002为参照,探讨SA的神经细胞保护作用及该作用与PI3K/Akt/GSK3β信号通路的潜在关系,以期为临床治疗AD提供新的思路。
1 材料
1.1 仪器
Series 8000型CO2培養箱(美国Thermo Fisher Scientific公司);DL-CJ-2NDII型AIRTECH-超净工作台(北京东联科技有限公司);M200 PRO型多功能酶标仪(瑞士Tecan公司);CKX41-A32PH型倒置显微镜(日本Olympus公司);5804R型离心机(德国Eppendorf公司);165-8001型电泳仪、1703811型电转仪、Gel Doc XR型凝胶成像系统(美国Bio-Rad公司);S11-6-S型恒温水浴锅(上海跃进医疗器械有限公司);LDZH-200KBS型高压蒸汽灭菌器(上海申安医疗器械厂)。
1.2 药品与试剂
SA对照品(上海源叶生物科技有限公司,批号:S30697,纯度:≥97%);Aβ1-42蛋白(北京博奥森生物技术有限公司,批号:bs-0107p);胎牛血清(美国BI公司,批号:04-007-1A);RPMI培养基(美国HyClone公司,批号:SH30809.01);LY294002对照品(美国AbMole公司,批号:15447-36-6,纯度:100%);胰蛋白酶(批号:TB150)、青链霉素混合液(100×,批号:P1400)、MTT试剂(批号:M8180)、脱脂奶粉(批号:D8340)均购自北京索莱宝科技有限公司;RIPA细胞裂解液(批号:P0013B)、PMSF蛋白酶抑制剂(100×,批号:P1005)、BCA蛋白浓度试剂盒(100×,批号:P0010S)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液(5×,批号:P00151)、特超敏ECL化学发光试剂盒(批号:P0018AS)均购自上海碧云天生物技术有限公司;磷酸酶抑制剂(100×,北京康为世纪生物科技有限公司,批号:CW2383S);Tween-20、SDS、过硫酸铵(APS)、四甲基乙二胺(TEMED)、甘氨酸、二甲基亚砜(DMSO)均购自美国Sigma公司;预染蛋白标志物(加拿大Fermentas公司,批号:26616);小鼠PI3K单克隆抗体(批号:60225-1-Ig)、小鼠Akt单克隆抗体(批号:60203-2-Ig)、兔GSK3β多克隆抗体(批号:15113-1-AP)均购自武汉三鹰生物技术有限公司;兔p-PI3K单克隆抗体(批号:4228)、兔p-Akt单克隆抗体(批号:4060)、兔p-GSK3β 单克隆抗体(批号:9323)购自美国CST公司;小鼠β-actin 单克隆抗体(批号:TA-09)、辣根过氧化物(HRP)标记的山羊抗兔IgG二抗(批号:122826)、HRP标记的山羊抗小鼠IgG二抗(批号:122011)均购自北京中杉金桥生物技术有限公司;其余试剂均为分析纯,水为超纯水。
1.3 细胞
大鼠肾上腺髓质嗜铬细胞瘤细胞PC12由中国科学院上海细胞生物研究所提供。
2 方法
2.1 细胞培养
将PC12细胞接种于含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI培养基中,并置于 37 ℃、5%CO2培养箱中培养(培养条件下同),每 2~3 d 换液1次。
2.2 分组
根据课题组前期MTT试验结果,确定Aβ1-42的最适浓度为2 μmol/L,SA的浓度为100 μmol/L;根据文献报道,处理神经细胞时,LY294002的最适浓度为10 μmol/L[14]。将细胞随机分为对照组、Aβ 组(Aβ1-42 2 μmol/L)、Aβ+SA组(Aβ1-42 2 μmol/L+SA 100 μmol/L)、Aβ+SA+LY组(Aβ1-42 2 μmol/L+SA 100 μmol/L+LY294002 10 μmol/L)、Aβ+LY组(Aβ1-42 2 μmol/L+LY294002 10 μmol/L)、LY组(LY294002 10 μmol/L)。
2.3 PC12细胞的形态观察和存活率检测
采用倒置显微镜观察并采用MTT法检测。收集对数生长期的PC12细胞按5×104个/mL接种至96孔板中,每孔100 mL,按照“2.2”項下方法分组,每组设置6个复孔。继续培养24 h后,Aβ+SA+LY组、Aβ+LY组、LY组先加入LY294002 10 μmol/L孵育1 h;除对照组和LY组外,其余4组分别加入Aβ1-42 2 μmol/L处理24 h以复制损伤细胞模型;随后,Aβ+SA组和Aβ+SA+LY组加入SA 100 μmol/L,继续培养24 h,置于倒置显微镜观察其形态并拍照。每孔加入 MTT溶液(5 mg/mL)10 μL,继续培养4 h,小心吸去孔内培养液,每孔加入 DMSO 150 μL,低速振荡10 min,以酶标仪于570 nm波长处检测吸光度(OD)值,并按如下公式计算细胞存活率:细胞存活率(%)=样品组OD均值/对照组OD均值×100%。上述试验重复3次。
2.4 PC12中细胞PI3K、p-PI3K、Akt、p-Akt、GSK3β、p-GSK3β蛋白表达水平的检测
采用Western blotting法检测。收集对数生长期的P12细胞,按“2.3”项下方法分组、造模、给药。培养24 h后,以2 000 r/min离心10 min收集细胞,加入含胰蛋白酶、磷酸酶抑制剂的RIPA裂解液,于冰上裂解后,以12 000 r/min离心20 min,收集上清液即得细胞总蛋白;采用BCA法测定总蛋白含量,于水浴中煮沸5 min制备所需的变性蛋白样品;采用10%SDS-PAGE进行恒流电泳(电流:60 mA),在恒压电(电压:75 V,时间:2 h)以湿转法转膜,于37 ℃下以5%脱脂奶粉封闭 1 h,加入PI3K、Akt、GSK3β一抗(稀释比例均为1 ∶ 800)和p-PI3K、p-Akt、p-GSK3β一抗(稀释比例均为1 ∶ 600),于4 ℃孵育过夜;采用三羟甲基氨基甲烷盐酸盐(TBST)溶液清洗3次,每次 5 min,加入二抗(稀释比例均为1 ∶ 1 000;HRP标记的山羊抗兔IgG二抗对应GSK3β、p-PI3K、p-Akt、p-GSK3β抗体,HRP标记的山羊抗小鼠IgG二抗对应PI3K、Akt、β-actin抗体),于 37 ℃下反应 1 h,用TBST溶液清洗3次,每次5 min;以ECL显色后,使用凝胶成像系统曝光成像,采用Image Lab 4.0.1图像分析软件检测蛋白条带灰度值,以目的蛋白与内参蛋白(β-actin)条带灰度值的比值来表示其相对表达量,并以p-PI3K/PI3K、p-Akt/Akt、p-GSK3β/GSK3β的比值表示PI3K、Akt、GSK3β蛋白的磷酸化水平。上述试验重复3次。
2.5 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料以x±s表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
3 结果
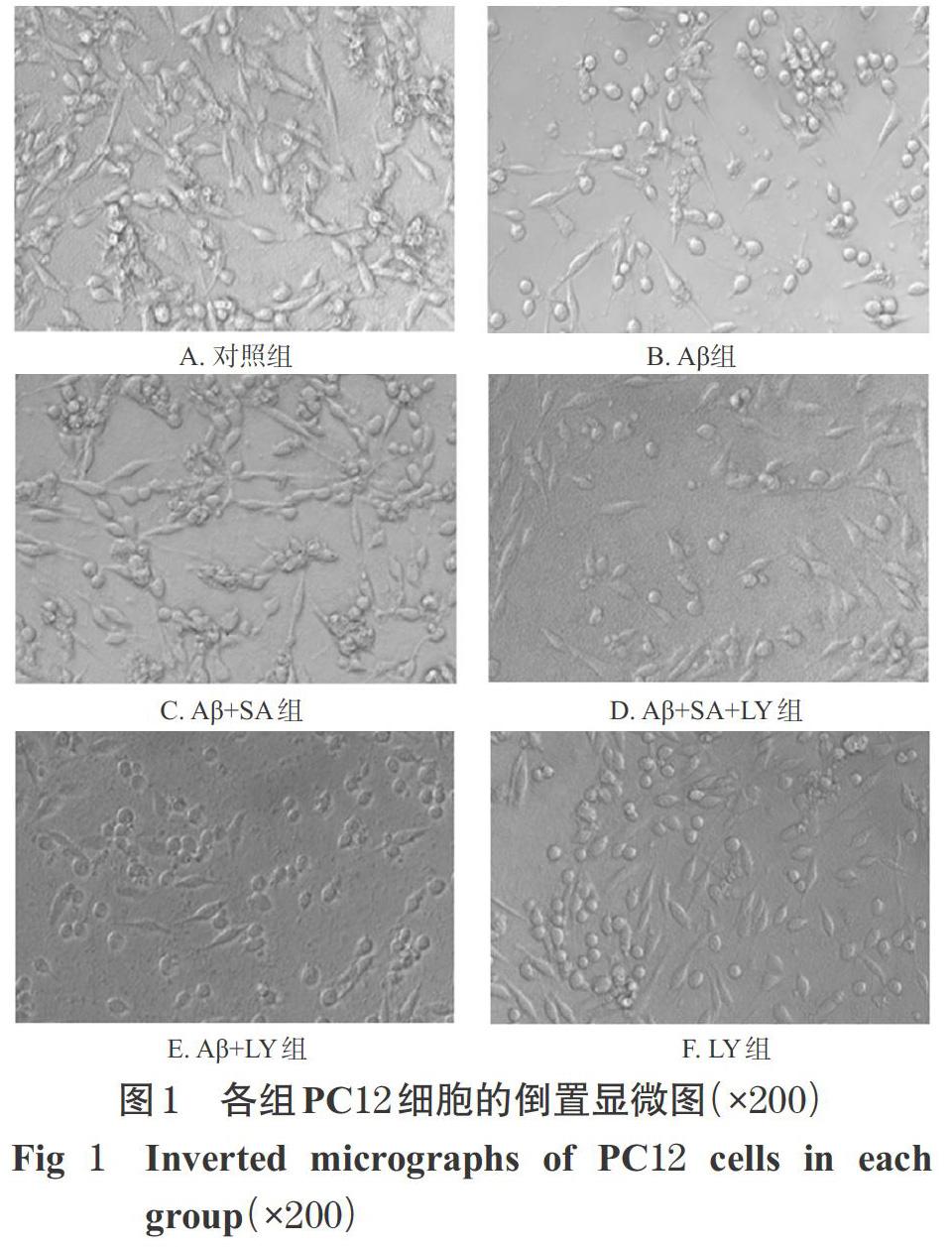
3.1 各组细胞的形态
对照组细胞形态饱满、细胞密集且连接紧密、折光性好。与对照组比较,Aβ组细胞突触变少、部分突触断裂消失、细胞变少且细胞间连接较松;与Aβ组比较,Aβ+SA组细胞变圆、突触增多;与Aβ+SA组比较,Aβ+SA+LY组细胞形态较不规则、部分突触损伤断裂、细胞光圈变弱,Aβ+LY组细胞碎片较多;LY组细胞与对照组比较无明显差异,详见图1。
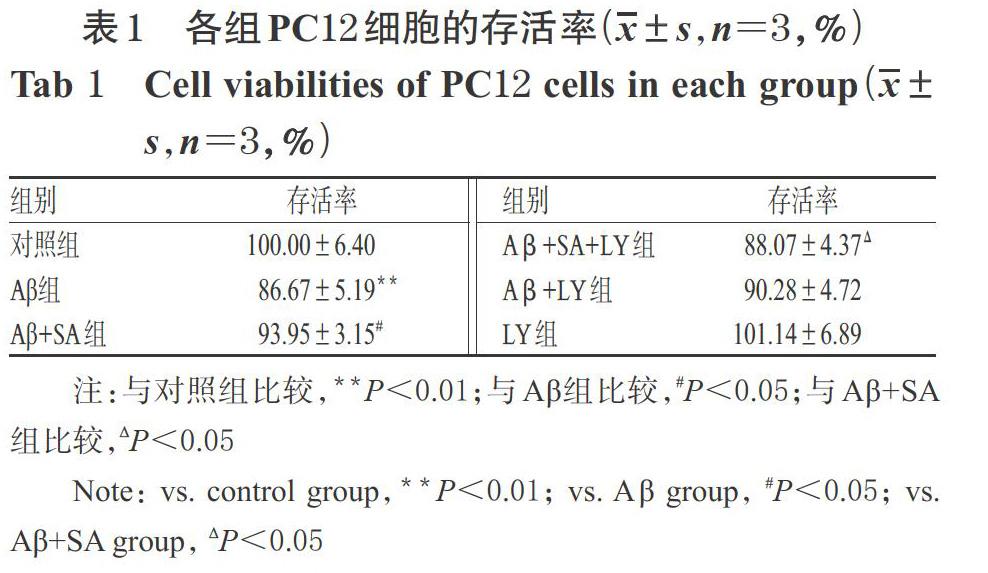
3.2 各组细胞的存活情况
与对照组比较,Aβ 组细胞的存活率显著降低(P<0.01);与Aβ 组比较,Aβ+SA 组细胞的存活率显著升高(P<0.05);与Aβ+SA 组比较,Aβ+SA+LY组细胞的存活率显著降低(P<0.05),而Aβ+LY 组细胞的存活率虽有下降,但组间比较差异无统计学意义(P>0.05);同时,单独给予 LY294002对PC12细胞的存活率无显著影响(P>0.05),详见表1。
3.3 各组PC12细胞PI3K、p-PI3K、Akt、p-Akt、GSK3β、p-GSK3β蛋白水平
与对照组比较,Aβ 组细胞中p-PI3K/PI3K、p-Akt/Akt、p-GSK3β/GSK3β比值均显著降低(P<0.05或P<0.01);与Aβ组比较,Aβ+SA 组细胞中p-PI3K/PI3K、p-Akt/Akt、p-GSK3β/GSK3β比值均显著升高(P<0.05);与Aβ+SA组比较,Aβ+SA+LY 组细胞中p-PI3K/PI3K、p-Akt/Akt、p-GSK3β/GSK3β比值均显著降低(P<0.05),而Aβ+LY组细胞上述指标并无显著变化(P>0.05);同时,单独使用LY294002对PC12细胞的存活率无显著影响(P>0.05),详见图2、表2。
4 讨论
AD的病因复杂,发病机制尚不清楚,目前的研究认为主要与以下几个因素有关:Aβ聚集、Tau蛋白过度磷酸化、胆碱能神经细胞损伤、基因突变、炎症因子增加、衰老、氧化应激以及钙代谢紊乱等[15]。研究发现,AD患者的脑内有老年斑沉积,而Aβ是构成老年斑的主要成分,因此目前认为Aβ的异常沉积是AD主要的发病机制之一[16]。SA是一种天然的羟基肉桂酸,其相对分子量小,具有较高的亲脂性,容易透过血脑屏障到达中枢神经系统[17]。有研究发现,SA能抑制氰化钾(KCN)导致的小鼠缺氧和记忆障碍,对改善记忆功能有一定的效果[18];同时,SA及其衍生物芥子碱(Sinapine)也对氧化应激诱导的AD、共济失调和帕金森病等神经退行性疾病有一定的治疗作用[19]。另有研究发现,SA与阿魏酸、香豆酸、咖啡酸等相互作用,具有抗焦虑和改善记忆力的功效[20]。本研究结果验证了Aβ1-42能够诱导PC12细胞损伤,而SA能够拮抗Aβ1-42诱导的这种损伤,说明SA具有神经细胞保护作用。本研究还发现,PI3K特异性抑制剂LY294002可逆转SA拮抗Aβ1-42致PC12细胞损伤及神经保护作用,提示SA对神经细胞的保护作用可能与PI3K信号通路有关。
PI3K是细胞内信号转导的重要激酶之一,由调节亚基p85和催化亚基p110 两个结合位点构成。当受到细胞外刺激信号分子作用时,p85发生磷酸化,并解除了对p110的抑制,从而激活PI3K[21]。Akt是PI3K的下游直接靶点,在PI3K信号转导通路中具有承上启下的重要作用,Akt可在Ser473位点发生磷酸化,使Akt被激活,而许多保护机制的激活取决于Akt的磷酸化,如神经保护作用[22-23]。活化的Akt能够启动PI3K/Akt信号通路下游级联反应,进一步磷酸化下游的GSK3β[24]。在最新研究中发现,GSK3β的神经毒性可直接导致神经细胞的凋亡,诱导AD的发生;然而GSK3β磷酸化水平的增高则可抑制GSK3β的活性,减轻神经细胞的损伤[25]。另有研究表明,SA可通过PI3K/Akt/GSK3β下游的p38丝裂原活化蛋白激酶/环磷腺苷效应元件结合蛋白(MAPK/CREB)信号通路,启动3T3-L1脂肪细胞褐变,提示SA可参与PI3K/Akt/GSK3β信号通路的调控[26]。本研究结果显示,Aβ1-42可显著降低PC12细胞中PI3K、Akt、GSK3β的磷酸化水平,SA能够回调Aβ1-42诱导的上述蛋白的磷酸化;而LY294002可逆轉SA对PI3K、Akt、GSK3β磷酸化水平的回调作用。这说明SA对Aβ1-42致细胞损伤的保护作用可能是通过活化PI3K,使其下游靶点蛋白Akt磷酸化,从而使下游底物GSK3β发生磷酸化,进而激活PI3K/Akt/GSK3β信号通路来实现的。
综上所述,本研究发现SA对Aβ1-42诱导的PC12细胞损伤具有保护作用,其机制可能与其激活PI3K/Akt/GSK3β信号通路有关。由于AD的发病机制复杂,涉及多种信号转导通路,本研究只检测了PI3K、Akt、GSK3β,未检测PI3K/Akt信号通路的其他蛋白,如B淋巴细胞瘤-2基因相关启动子(Bad)、哺乳动物雷帕霉素靶蛋白(mTOR)、胱天蛋白酶3(Caspase-3)等[26],因此还有待于进一步研究加以证实。
参考文献
[ 1 ] OSSENKOPPELE R,PIJNENBURG YAL,PERRY DC,et al. The behavioural/dysexecutive variant of Alzheimers disease:clinical,neuroimaging and pathological features[J]. Brain,2015,138(9):2732-2749.
[ 2 ] REVETT TJ,BAKER GB,JHAMANDAS J,et al. Glutamate system,amyloid β peptides and tau protein:functional interrelationships and relevance to Alzheimers disease pathology[J]. J Psychiatry Neurosci,2013,38(1):6-23.
[ 3 ] WU XG,WANG SS,MIAO H,et al. Scutellaria barbata flavonoids alleviate memory deficits and neuronal injuries induced by composited Aβ in rats[J]. Behav Brain Funct,2016. DOI:10.1186/s12993-016-0118-8.
[ 4 ] LAMBERT MP,VELASCO PT,CHANG L,et al. Monoclonal antibodies that target pathological assemblies of Aβ[J]. J Neur,2007,100(1):23-35.
[ 5 ] SHEN WX,CHEN JH,LU JH,et al. TGF-β1 protection against Aβ1-42-induced neuroinflammation and neurodegeneration in rats[J]. Int J Mol Sci,2014,15(12):22092- 22108.
[ 6 ] PENG MY,LING XM,SONG RX,et al. Upregulation of GLT-1 via PI3K/Akt pathway contributes to neuroprotection induced by dexmedetomidine[J]. Front Neurol,2019. DOI:10.3389/fneur.2019.01041.
[ 7 ] GHARBI SI,ZVELEBIL MJ,SHUTTLEWORTH SJ,et al. Exploring the specificity of the PI3K family inhibitor LY294002[J]. Biochem J,2007,404(1):15-21.
[ 8 ] JIANG W,LUO T,LI S,et al. Quercetin protects against okadaic acid-induced injury via MAPK and PI3K/Akt/GSK3β signaling pathways in HT22 hippocampal neurons[J]. PLoS One,2016. DOI:10.1371/journal.pone. 0152371.
[ 9 ] LAFERLA FM,TINKLE BT,BIEBERICH CJ,et al. The Alzheimers A beta peptide induces neurodegeneration and apoptotic cell death in transgenic mice[J]. Nat Genet,1995,9(1):21-30.
[10] XIAN YF,LIN ZX,MAO QQ,et al. Isorhynchophylline protects PC12 cells against beta-amyloid-induced apoptosis via PI3K/Akt signaling pathway[J]. Evid Base Complement Alternat Med,2013. DOI:10.1155/2013/163057.
[11] KLYUBIN I,CULLEN WK,HU NW,et.al. Alzheimers disease Aβ assemblies mediating rapid disruption of synaptic plasticity and memory[J]. Mol Brain,2012. DOI:10.1186/1756-6606-5-25.
[12] LEE HE,KIM DH,PARK SJ,et al. Neuroprotective effect of sinapic acid in a mouse model of amyloid β1-42 protein- induced Alzheimers disease[J]. Pharmacol Biochem Behav,2012,103(2):260-266.
[13] KIM DH,YOON BH,JUNG WY,et al. Sinapic acid attenuates kainic acid-induced hippocampal neuronal damage in mice[J]. Neuropharmacology,2010,59(1/2):20-30.
[14] SHAHMOHAMADY P,EIDI A,MORTAZAVI P,et al. Effect of sinapic acid on memory deficits and neuronal degeneration induced by intracerebroventricular administration of streptozotocin in rats[J]. Pol J Pathol,2018,69(3):266-277.
[15] LIN JJ,YU J,ZHAO JY,et al. Fucoxanthin,a marine carotenoid,attenuates β-amyloid oligomer-induced neurotoxicity possibly via regulating the PI3K/Akt and the ERK pathways in SH-SY5Y cells[J]. Oxid Med Cell Longev,2017. DOI:10.1155/2017/6792543.
[16] MANTZAVINOSA V,ALEXIOU A. Biomarkers for Alz- heimers disease diagnosis[J]. Curr Alzheimer Rse,2017, 14(11):1149-1154.
[17] HARDY J,SELKOE DJ. The Amyloid hypothesis of Alz- heimers disease:progress and problems on the road to therapeutics[J]. Science,2002,297(5580):353-356.
[18] KARAKIDA F,IKEYA Y,TSUNAKAWA M,et al. Cerebral protective and cognition-improving effects of sinapic acid in rodents[J]. Biol Pharm Bull,2007,30(3):514- 519 .
[19] CHEN CY. Sinapic acid and its derivatives as medicine in oxidative stress-induced diseases and aging[J]. Oxid Med Cell Longev,2016. DOI:10.1155/2016/3571614.
[20] RYU JH,KIM SY,JANG CG,et al. Anxiolytic and memory-improving composition causing no side effects compri- sing phenylpropanoid compounds including cinnamic acid,p-courmaric acid,caffeic acid,ferulic acid and sinapic acid:Korea,KR740566-B1[P]. 2008-09-29.
[21] HOFMANN BT,J?CKER M. Activation of PI3K/Akt signaling by N-terminal SH2 domain mutants of the p85α regulatory subunit of PI3K is enhanced by deletion of its C-terminal SH2 domain[J]. Cell Signal,2012,24(10):1950-1954.
[22] TATO I,BARTRONS R,VENTURA F,et al. Amino acids activate mammalian target of rapamycin complex 2(mTORC2)via PI3K/Akt signaling[J]. J Biol Chem,2011,286(8):6128-6142.
[23] GRIFFIN RJ,MOLONEY A,KELLIHER M,et al. Activation of Akt /PKB,increased phosphorylation of Akt substrates and loss and altered distribution of Akt and PTEN are features of Alzheimers disease pathology[J]. J Neurochem,2005,93(1):105-117.
[24] YAO YJ,WANG YM,KONG L,et al. Osthole decreases tau protein phosphorylation via PI3K/AKT/GSK-3β signaling pathway in Alzheimers disease[J]. Life Sci,2019,15(1):16-24.
[25] NISBET RM,POLANCO JC,ITTNER LM,et al. Tau aggregation and its interplay with amyloid-β[J]. Acta Neuropathol,2014,129(2):207-220.
[26] BAE IS,KIM SH. Sinapic acid promotes browning of 3T3- L1 adipocytes via p38 MAPK/CREB pathway[J]. Biomed Res Int,2020. DOI:10.1155/2020/5753623.
(收稿日期:2020-04-04 修回日期:2020-08-04)
(編辑:罗 瑞)
