血清CD62P、HMGB1和IMA与急性脑梗死神经元损伤和预后的相关性
2020-11-30周蓓群王琰萍郝亚南沈宇婓
周蓓群 王琰萍 郝亚南 沈宇婓
[摘要] 目的 分析血清P選择素(CD62P)、高迁移率族蛋白B1(HMGB1)、缺血修饰白蛋白(IMA)与急性脑梗死神经元损伤和预后的相关性。 方法 选取2017年9月~2019年9月在我院神经内科收治的急性脑梗死患者150例为观察组,根据NIHSS评分分为轻度组42例、中度组72例、重度组36例,根据脑梗死后3个月改良Rankin评分分为预后良好组86例与预后不良组64例,收集所有患者一般资料及实验室检查指标,比较各组血清CD62P、HMGB1、IMA水平变化。 结果 观察组患者合并高血压、糖尿病例数及TG、TC、LDL-C水平明显高于对照组,差异有统计学意义(P<0.05)。观察组患者血清CD62P、HMGB1、IMA水平明显高于对照组,差异有统计学意义(P<0.01)。轻、中、重度三组间血清CD62P、HMGB1、IMA水平比较,差异有统计学意义(P<0.01),血清CD62P、HMGB1、IMA水平在三组间呈逐渐升高的趋势。以观察组患者NIHSS评分为因变量,血清CD62P、HMGB1、IMA水平为自变量,多元线性回归分析结果显示,血清CD62P、HMGB1、IMA水平升高与急性脑梗死患者神经功能受损呈明显正相关(P<0.05)。预后不良组患者血清CD62P、HMGB1、IMA水平明显高于预后良好组,差异有统计学意义(P<0.01)。结论 CD62P、HMGB1、IMA在急性脑梗死患者血清中呈明显高水平,三指标可在一定程度上反映急性脑横死患者神经元损伤程度,并有助于判断患者预后状况,具有一定的临床应用价值。
[关键词] CD62P;HMGB1;IMA;急性脑梗死;神经元损伤;预后;相关性
[中图分类号] R743.3 [文献标识码] B [文章编号] 1673-9701(2020)27-0054-04
[Abstract] Objective To analyze the correlation of serum cluster of differentiation 62 platelet(CD62P), high mobility group B1(HMGB1) and ischemia modified albumin(IMA) with neuronal injury and prognosis in patients with acute cerebral infarction. Methods A total of 150 patients with acute cerebral infarction treated in neurology department of our hospital from September 2017 to September 2019 were selected as the observation group, and were divided into the mild group(n=42), the moderate group(n=72) and the severe group(n=36) according to the NIHSS score. According to the modified Rankin score at 3 months after cerebral infarction, the good prognosis group had 86 patients, and the poor prognosis group had 64 patients. The general information and laboratory indexes of all patients were collected, and the level changes of serum CD62P, HMGB1 and IMA in each group were compared. Results The number of patients combined with hypertension and diabetes and levels of TG, TC and LDL-C in the observation group were significantly higher than those in the control group, with statically significant differences(P<0.05). The levels of serum CD62P, HMGB1 and IMA in the observation group were significantly higher than those in the control group, with statically significant differences(P<0.01). There were statically significant differences in levels of serum CD62P, HMGB1 and IMA among the mild group, the moderate group and the severe group(P<0.01), and the levels of serum CD62P, HMGB1 and IMA among the three groups were gradually increased. The NIHSS score in the observation group was regarded as dependent variable and the levels of serum CD62P, HMGB1 and IMA as independent variables when performing multiple linear regression, and the result showed that there was positive correlation between the increased of serum CD62P, HMGB1 and IMA levels and the nerve function damage in patients with acute cerebral infarction(P<0.05). The levels of serum CD62P, HMGB1 and IMA in the poor prognosis group were significantly higher than those in the good prognosis group, with statically significant differences(P<0.01). Conclusion The levels of serum CD62P, HMGB1 and IMA in patients with acute cerebral infarction are significantly high, can reflect the degree of neuronal injury in patients with acute cerebral infarction to a certain extent, and is conducive to judging the prognosis, which has certain clinical application value.
[Key words] CD62P; HMGB1; IMA; Acute cerebral infarction; Neuronal injury; Prognosis; Correlation
急性脑梗死又称缺血性脑卒中,是指脑血供突然中断后导致的脑组织坏死,常由多种不同原因引起的局部腦供血障碍,使管腔狭窄甚至闭塞,导致相应及邻近供血部位脑缺血缺氧,并伴有偏瘫、失语等相应部位的临床症状和体征[1]。急性脑梗死发病机制极其复杂,高血压病、冠心病、高脂血症、吸烟、饮酒等是其发生的主要危险因素,该病病情进展速度较快,起病不久后出现意识障碍,甚至脑疝、死亡,部分患者治疗后神经功能恢复不理想,目前急性脑梗死缺乏临床评价指标,血清学指标的检测可在脑梗死患者的诊断和治疗中发挥重要作用[2-3]。血清P选择素(Platelet-selectin-CD62P,CD62P)是临床测量血小板活化程度的重要指标,其可通过影响血小板聚集促进继发性血栓形成,进而促进脑梗死的病情进展[4]。高迁移率族蛋白B1(High mobility group protein B1,HMGB1)是一种重要的促炎因子,参与脓毒症、缺血再灌注损伤等多种疾病病理过程,与组织损伤后修复及炎症反应等过程关系密切[5]。缺血修饰白蛋白(Ischemia modified albumin,IMA)为一种高灵敏度的缺血性病变标志物,在心肌缺血发生5~10 min可迅速升高,有利于缺血性疾病的早期诊断[6]。本研究旨在分析血清CD62P、HMGB1、IMA与急性脑梗死神经元损伤和预后的相关性,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年9月~2019年9月在我院神经内科收治的急性脑梗死患者150例为观察组,本研究经医院医学伦理委员会批准进行。纳入标准:①所有患者均符合中华医学会神经病学分会制定的《中国急性缺血性脑卒中诊治指南2014》中的诊断标准[7];②所有患者均在入院后经CT、MRI确诊为急性脑梗死;③首次发病,发病至治疗时间<5 h;④年龄≤80岁;⑤入院时存在神经功能缺损体征;⑥患者及家属均知情同意参与本研究。排除标准:①合并心理衰竭、呼吸衰竭、肝肾功能衰竭等严重内科疾病者;②近半年有输血史、手术史、创伤者;③合并恶性肿瘤、脑血管动脉瘤、感染性疾病、自身免疫系统疾病者;④1个月内使用过抗炎、抗免疫抑制剂及激素药物者;⑤强直性脊柱炎、类风湿性疾病者;⑥病历资料缺失或随访失联者。其中男88例,女62例,年龄55~80岁,平均(66.23±8.35)岁,根据美国国立研究院卒中量表(National institutes stroke scale,NIHSS)评分评价患者入院第1天神经功能缺损程度,1~4分为轻度组(42例)、5~15分为中度组(72例)、16分及以上为重度组(36例);根据改良Rankin评分表对患者出院后3个月生活能力进行评分,评分≤2分者为预后良好组86例,评分>2分者为预后不良组64例。另选取同期来我院体检的健康人群150例为对照组,其中男82例,女68例,年龄52~79岁,平均(65.16±8.53)岁,排除既往有脑梗死病史、活动性出血病史、急性心肌梗死病史、血液病史或任何部位血栓者。
1.2 方法
①收集所有患者年龄、性别、身高、体重、体质量指数(Body mass index,BMI)等一般资料,通过询问患者或家属记录有无吸烟史、饮酒史、高血压、糖尿病等既往病史,常规实验室全自动生化法检测三酰甘油(Triglyceride,TG)、总胆固醇(Total cholesterol,TC)、低密度脂蛋白胆固醇(LDL cholesterol,LDL-C)、高密度脂蛋白胆固醇(HDL cholesterol,HDL-C)水平。②所有患者入院后均在24 h内收集晨起空腹肘静脉血5 mL,室温静置30 min,经1500 r/min离心15 min,取上清液于冻存管中置于-80℃冰箱保存备用。采用酶联免疫吸附法检测血清CD62P、HMGB1水平变化,采用白蛋白-钴离子法检测IMA水平变化。CD62P、HMGB1试剂均购于美国R&D公司,IMA试剂盒购于上海西塘公司。
1.3 统计学方法
本研究数据均采用SPSS20.0统计学软件进行分析,所有计量资料采用(x±s)表示,采用独立样本t检验,采用方差分析进行多组间均数的比较,计数资料均用[n(%)]表示,采用χ2检验,多元线性回归分析血清CD62P、HMGB1、IMA水平与神经功能受损的相关性,P<0.05为差异有统计学意义。
2 结果
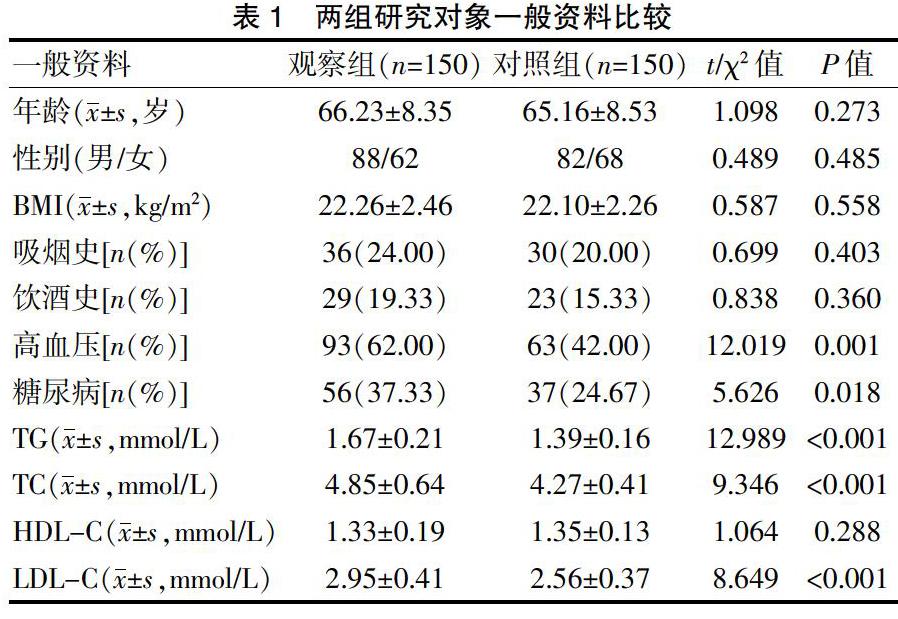
2.1 两组研究对象一般资料比较
观察组患者合并高血压、糖尿病例数及TG、TC、LDL-C水平明显高于对照组,差异有统计学意义(P<0.05)。见表1。
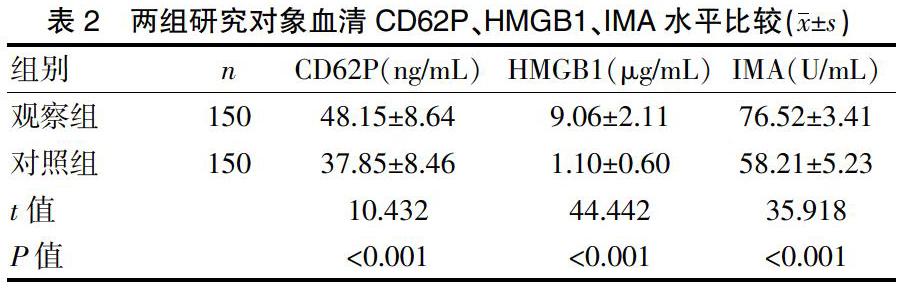
2.2 两组研究对象血清CD62P、HMGB1、IMA水平比较
观察组患者血清CD62P、HMGB1、IMA水平明显高于对照组,差异有统计学意义(P<0.01)。见表2。
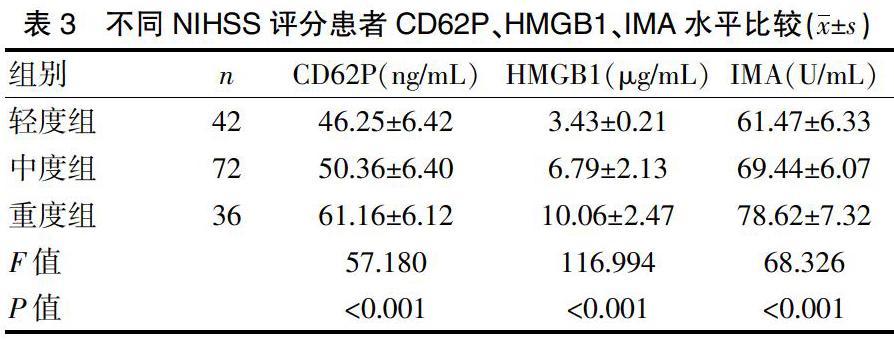
2.3 不同NIHSS评分患者血清CD62P、HMGB1、IMA水平比较
轻、中、重度三组间血清CD62P、HMGB1、IMA水平比较,差异有统计学意义(P<0.01),血清CD62P、HMGB1、IMA水平在三组间呈逐渐升高的趋势。见表3。
2.4 血清CD62P、HMGB1、IMA水平与神经功能受损的相关性
以观察组患者NIHSS评分为因变量,血清CD62P、HMGB1、IMA水平为自变量,多元线性回归分析结果显示,血清CD62P、HMGB1、IMA水平升高与急性脑梗死患者神经功能受损呈明显正相关(P<0.05)。见表4。
2.5 脑梗死后3个月不同预后患者血清CD62P、HMGB1、IMA水平比较
预后不良组患者血清CD62P、HMGB1、IMA水平明显高于预后良好组,差异有统计学意义(P<0.01)。见表5。
3 讨论
急性脑血管病疾病是导致全球残疾、死亡的主要原因之一,急性脑梗死是指血液中栓子随血液流入脑动脉,造成该区域脑供血障碍,当缺血持續8~10 min时,缺血中心区发生急性神经元坏死,神经元将遭受不可逆转的损伤,终至细胞不可逆死亡[8-9]。目前临床治疗急性脑梗死主要采用早期溶栓、高压氧疗法及对症处理等,可有效控制患者病情和促进脑供血恢复,但仍有25%~75%患者存在复发的风险[10]。目前临床学者在研究脑梗死神经功能损伤机制的同时,也在积极寻找可用于早期预测脑梗死病情及预后的生物标志物。
CD62P为血小板活化的特异性标志物,为细胞黏附分子选择素家族中的一员,具有启动、放大血栓形成的重要作用,此外其还可促进炎症因子及相关炎症信号通路的激活,从而影响脑组织的损伤,促进脑血管痉挛和脑血流灌注异常,在动脉粥样硬化形成及发展过程中具有重要作用[11-12]。另外,在非活化内皮细胞膜上CD62P有一定量的表达,其可在内皮细胞被刺激时从Weibel-palada体转移到细胞表面,黏附于多形核白细胞和单核细胞,与血小板表面的质膜融合,并在血浆中呈高表达,并在血小板活化10 min后表达达到高峰[13]。因此,CD62P对血栓性疾病的检测具有一定的参考价值。Morel等[14]通过研究发现,CD62P在脑梗死急性期表达水平明显高于健康人群,且已证实与脑梗死程度有关。HMGB1是一种核蛋白,可诱导细胞因子分泌和激活炎症细胞,其在真核细胞中广泛表达,具有调节基因转录、参与DNA重组等功能[15]。近年来HMGB1被认为是一种迟发性炎症介质,在类风湿关节炎、败血症等炎症性疾病中起着炎症介质的作用,若过度炎症反应则可导致缺血区梗死面积增大和脑卒中损伤加重。正常情况下神经细胞和胶质细胞可分泌少量HMGB1,脑缺血缺氧导致细胞损伤坏死后,其可被立即释放到细胞外,引起全身炎症级联反应,导致HMGB1在短时间内迅速升高[16-17]。Tayman等[18]通过观察HMGB1水平在急性脑梗死患者不同病情、不同梗死面积时的表达发现,其为一定程度预测急性脑梗死患者病情严重程度及进展的生化指标之一。IMA是由人血清白蛋白流经缺血组织产生,是血液中最丰富的多功能蛋白,其与铜、钴等多种金属元素有很强的结合能力,临床可通过分析白蛋白与钴离子的结合状况测出IMA浓度变化[19]。IMA在心源性和非心源性缺血状态下均可升高,在心肌细胞发生缺血4~6 min内迅速升高,可作为评估缺血性疾病早期严重程度的特异性指标[20]。
本研究显示,急性脑梗死患者血清CD62P、HMGB1、IMA水平明显高于健康人群,且随着患者病情的加重,三指标表达明显增高,这提示相关细胞因子的表达与急性脑梗死患者病情密切相关,其相关原因可能与血清CD62P、HMGB1、IMA水平可导致血小板聚集、加重炎症反应进而促进脑梗死病情进展有关。此外本研究结果显示,血清CD62P、HMGB1、IMA水平与急性脑梗死患者神经功能受损呈明显正相关(P<0.05),且预后不良组患者血清CD62P、HMGB1、IMA水平明显高于预后良好组(P<0.01),进一步提示了三指标表达与神经元损伤程度及预后不良有一定的相关性。
综上所述,CD62P、HMGB1、IMA在急性脑梗死患者血清中呈现明显高水平,三指标可在一定程度上反映急性脑梗死患者神经元损伤程度,并有助于判断患者预后状况,具有一定的临床应用价值。
[参考文献]
[1] Aizawa Y,Nakai T,Saito Y,et al. Calcified amorphous tumor-induced acute cerebral infarction[J]. International Heart Journal,2018,59(1):240-242.
[2] 徐耀铭,齐晓飞,王姝瑶,等.急性脑梗死早期进展相关危险因素的临床研究[J]. 中风与神经疾病杂志,2018, 35(6):548-549.
[3] 贺雯,高尚,宋海燕,等.Hcy、RD、NSE与急性缺血性脑卒中的相关性研究[J].中国煤炭工业医学杂志,2015,(12):2017-2024.
[4] Sut C,Tariket S,Aloui C,et al. Les concentrés de plaquettes d'aphérèse versus les mélanges de concentrés plaquettaires:Focus sur sCD40L et sCD62P[J]. Transfusion Clinique Et Biologique,2017,24(3):331-332.
[5] Sarsu SB,Erbagci AB,Ulusal H,et al. The place of calprotectin,lactoferrin,and high-mobility group Box 1 protein on diagnosis of acute appendicitis with children[J].Indian Journal of Surgery,2017,79(2):131-136.
[6] Murat zgür Kl,Cem Emir Güldoan,Ilhan Balamir,et al. Ischemia modified albumin as a predictor of the severity of acute appendicitis[J]. American Journal of Emergency Medicine,2017,35(1):92-95.
[7] 中華医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[8] 李琳琳,杨清成.急性脑梗死溶栓治疗方法研究进展[J].中华卫生应急电子杂志,2019,5(3):177-181.
[9] Bong JB,Kang HG,Choo IS.Acute cerebral infarction after pyrethroid ingestion[J]. Geriatrics & Gerontology International,2017,17(3):510-511.
[10] 黄文胜,梁华忠.急性脑梗死溶栓治疗研究进展[J].内科,2019,14(1):62-64,70.
[11] 杨旭,刘平,李宗平,等.急性脑梗死患者血浆6k-PGF1α、CD62P、TXB2水平变化特点及临床意义分析[J].中国医师杂志,2019,21(8):1205-1208.
[12] 李恒.血清APN、NSE、IL-6、CD62P与急性脑梗死病情变化的关系[J].实验与检验医学,2019,37(2):152-154.
[13] Miodrag Vucic,Zoran Stanojkovic,Ana Antic,et al.Evaluation of platelet activation in leukocyte-depleted platelet concentrates during storage[J]. Bosn J Basic Med Sci,2018,292(28):11631-11637.
[14] Morel A,Rywaniak J,Bijak M,et al. Flow cytometric analysis reveals the high levels of platelet activation parameters in circulation of multiple sclerosis patients[J]. Molecular and Cellular Biochemistry,2017,430(1):69-80.
[15] Kang R,Bartlett DL,Billiar TR,et al. Intracellular HMGB1 as a novel tumor suppressor of pancreatic cancer[J].Cell Reserch,2017,27(7):916-932.
[16] Su Z,Ni P,She P,et al. Bio-HMGB1 from breast cancer contributes to M-MDSC differentiation from bone marrow progenitor cells and facilitates conversion of monocytes into MDSC-like cells[J]. Cancer Immunology Immunotherapy,2017,66(3):391-401.
[17] Yamamoto T,Tajima Y. HMGB1 is a promising therapeutic target for acute liver failure[J]. Expert Review of Gastroenterology & Hepatology,2017,11(7):673-682.
[18] Tayman M,Canan nder,Sivge Kurgan,et al.A novel systemic indicator of periodontal tissue damage:Ischemia modified albumin[J].Combinatorial Chemistry & High Th-roughput Screening,2018,21(8):544-549.
[19] Sel?觭uk Nazik,Avci V,Zeynep Küskü Kiraz.Ischemia-modified albumin and other inflammatory markers in the diagnosis of appendicitis in children[J]. Turkish Journal of Trauma & Emergency Surgery Tjtes,2017,23(4):317-321.
[20] Guntas G,Sahin A,Duran S,et al.Evaluation of ischemia-modified albumin in patients with inflammatory bowel disease[J].Clinical Laboratory,2017,63(2):341-347.
(收稿日期:2020-05-09)
