基于ISSR的重楼种质资源遗传多样性研究
2020-11-30刘胜坤胡剑民朱红军尹晓蛟杨旭
刘胜坤 胡剑民 朱红军 尹晓蛟 杨旭


摘 要: 采用ISSR分子标记方法,对13份重楼属种质资源间的遗传多样性进行了分析。结果显示,12条引物扩增出181条清晰条带,其中174条多态性带,平均多态性比率为96.13%;Nei's基因多样性指数范围为0.214~0.327,香农指数范围为0.351~0.500,样品间的遗传相似系数范围为0.293~0.624;通过聚类分析将重楼种质分为3类。结果表明,重楼属种质具有丰富的遗传多样性,ISSR是研究重楼种质资源遗传多态性及亲缘关系的重要手段之一。
关键词: 重楼;种质资源;ISSR;遗传多样性
中图分类号:Q94 文獻标识码:A 文章编号:1004-3020(2020)05-0020-04
Abstract: Genetic diversity in 13 Paris species resources collected was evaluated by ISSR markers.The results showed that 181 bands was amplified by 12 primers,174 of which were polymorphic,with an average polymorphism rate of 96.13%. Nei's diversity indicates ranged from 0.214 to 0.327,Shannon's information index ranged from 0.351 to 0.500 and the genetic similarity coefficients among the tested cultivates ranged from 0.293 to 0.624.Paris germplasms was divided into 3 types by cluster analysis AFLP markers were suitable to analyze genetic diversities and genetic relationships of Camellia japonica Germplasms.The results showed that there was abundant genetic diversity in the Paris germplasms and ISSR was one of the important methods to study genetic polymorphism and genetic relationship of the Paris species resources.
Key words: Paris;species resources;ISSR;genetic diversity
重楼隶属于百合科重楼属Paris L.,为多年生草本植物,又名蚤休、七叶一枝花、草河车、海螺七等[1]。中国共有24种重楼、12个变种、两个变型,主要分布在中国的云南、贵州、广东、广西、四川、湖北等地[2]。重楼的化学成分主要为甾体皂苷、孕甾烷苷、脂肪酸酯、甾醇及其苷、黄酮苷、β-蜕皮激素、多糖等,具有清热解毒,消肿止痛,凉肝定惊的功效,常用于疔疮痈肿,咽喉肿痛,蛇虫咬伤,跌扑伤痛,惊风抽搐[3]。近年来,由于重楼药用价值高,市场需求量大,重楼价格也随之上涨,直接导致了野生重楼属资源急剧减少,个别物种甚至濒临灭绝。因此,如何合理利用野生重楼资源,保护重楼资源的生物多样性是当前面临的主要问题。
以往对重楼属植物遗传多样性的研究多以形态学比较研究为主,而同一遗传型易受环境的影响而出现不同的表型(环境饰变),存在很大的局限性和不确定性,对性状相似的种类很难鉴别。在此背景下,新的遗传多态性检测手段——DNA分子标记技术应运而生,目前已有部分学者利用AFLP[5]、SSR[6]、RAPD[7]、CDDP[8]、SCOT[9]等对重楼开展了相关研究,而利用简单重复序列中间区域技术(ISSR,Inter-simple sequence repeats)对重楼属种质资源遗传多样性进行研究的报道甚少。与其它分子标记方法相比,ISSR具有多态性高、DNA用量少、操作简单、成本低、可重复性好等特点[10],鉴于此,本文基于ISSR分子标记技术比较分析了分属于重楼属13个种的13份种质资源的遗传多样性,以期为重楼属植物鉴别、遗传育种及其起源演化提供理论依据,为重楼属野生资源的保护与合理利用提供科学的理论指导。
1 材料与方法
1.1 材料
供试的重楼品种共13份(见表1),均于2019年5月采自湖北省农科院中药材研究所的重楼种质资源圃。采集的各重楼种质幼嫩叶片,经硅胶干燥后放入液氮中保存备用。DNA提取采用CTAB法[11]。
1.2 ISSR分析
PCR扩增体系(25 μL)为:DNA模板约40 ng,10×Bufer 2.5 μl,primer 0.3 μmol·L-1,四种dNTPs各0.25 μmol·L-1,MgCl2 1.5 mmol·L-1,TaqDNA聚合酶1.25 U。PCR扩增程序为:94 ℃预变性5 min,然后进行35个循环:94 ℃变性45 s,55~62 ℃复性45 s,72 ℃延伸1.5 min;循环结束后72 ℃延伸10 min,4 ℃保存。PCR结束后,将PCR产物在2.0%的琼脂糖凝胶电泳中检测。
1.3 数据分析
依据PCR扩增产物的电泳图谱,在凝胶的某个相同迁移率位置上,如果有DNA条带,赋值为“1”,无DNA条带的赋值为“0”。利用POPGENE和NTsys-pc 2.1软件对样品进行遗传多样性分析,用非加权配对平均法(UPGMA,unweighted pair-group method with arithmetic means)对所有样品进行聚类分析。
2 结果与分析
2.1 引物筛选及多态性分析
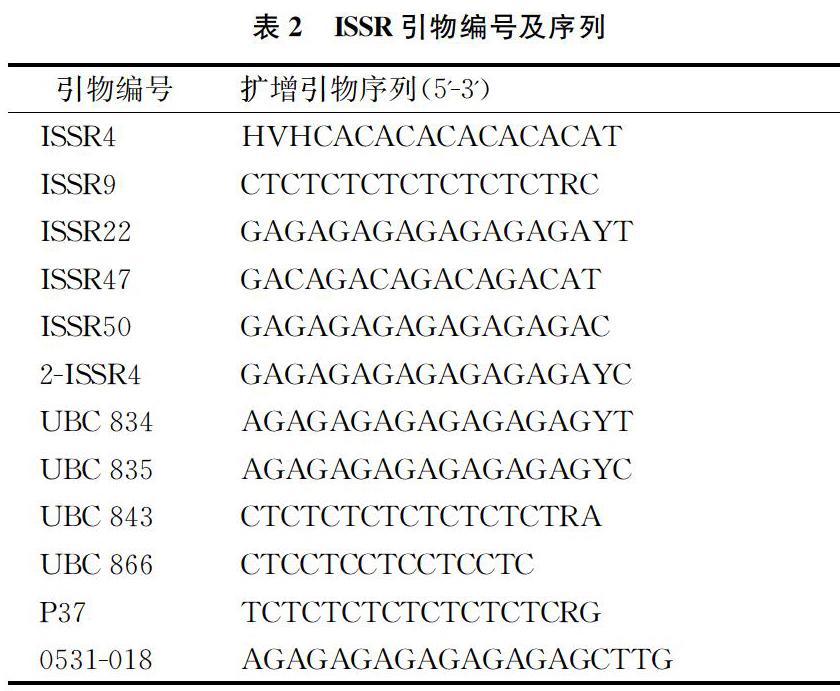
以通用的ISSR引物为基础,结合前人研究结果,利用24条ISSR引物進行PCR扩增,筛选出12条扩增条带清晰、带数较多、多态性良好且易于扩增的引物(表2)。由表3可知,12条引物对13个重楼样品进行扩增,共分离出181条清晰条带,扩增出174个多态位点,平均每个引物扩增出的多态位点为14.5个,其中6条引物的多态性比率达100%,平均多态百分数为96.13%。从单个引物扩增得到的多态位点来看,引物ISSR4扩增得到的多态位点最多,为18个。
2.2 遗传多样性分析
以筛选的12条引物分别扩增13份样品的基因,结果显示(表3):样品的观察等位基因数(Na)范围为1.857~2.000,有效等位基因数(Ne)范围为1.365~1.533,Nei′s基因多样性指数(H)范围为0.214~0.327,香农指数(I)范围为0.351~0.500,表明13个样品间存在丰富的遗传多样性。
由重楼属13份种质资源的ISSR标记数据矩阵可知(表4),样品间的遗传相似系数范围为0.293~0.624,平均相似系数为0.452;遗传距离范围为0.536~0.746,平均遗传距离为0.638,这说明供试的重楼属种质间存在不同程度的遗传变异,遗传多样性较高。其中相似性系数最大、遗传距离最小的是毛重楼和凌云重楼;而长药隔重楼和华重楼则有最小的相似性系数和最大的遗传距离。
2.3 聚类分析
利用UPGMA聚类法对13份供试重楼属植物进行了分析,基于遗传距离矩阵构建了分子系统树(见图1)。当以平均遗传距离(0.64)来划分时,可分成三大类群:大类群Ⅰ为亮叶重楼、短瓣重楼、狭叶重楼和长瓣重楼4个品种;大类群Ⅱ为啟良重楼、多叶重楼、凌云重楼、金线重楼、长药隔重楼、华重楼和矮重楼7个品种;大类群Ⅲ包括毛重楼和黑籽重楼2个品种。
3 讨论
本试验利用ISSR分子标记技术对13份重楼种质资源的遗传多样性进行了研究,从其遗传距离和多态性来看,重楼种质间遗传多样性高,能准确反映基因组组成上的差异,这说明ISSR标记适用于重楼种质间的遗传多样性分析。尹晓蛟等[12]对13份重楼种质资源的表型遗传多样性进行了聚类分析,其研究结果与本文存在一定的差异,如从形态表现来看,短瓣球药隔重楼和亮叶重楼的亲缘关系较远,而从ISSR的聚类结果显示两者间存在较近的亲缘关系。重楼属的分类研究中也并未表明短瓣球药隔重楼和亮叶重楼有亲缘关系,推测本研究中短瓣球药隔和亮叶重楼在分子水平出现较高的相似性是因种质在同一栽培环境下长期繁育基因交流的结果。
根据李恒[13]基于形态学的重楼属分类研究,本文中聚类的第Ⅱ类群包含的多叶重楼、金线重楼、凌云重楼同属于重楼属蚤休组,另外,啟良重楼、长药隔重楼、华重楼、矮重楼又为多叶重楼的变种。显然,第Ⅱ类群包含的全部7种重楼在重楼属进化地位中位于较为原始的蚤休组。第Ⅲ类的毛重楼属于蚤休组,黑籽重楼属于黑籽组,二者表型上差异较大,ISSR的聚类结果却将二者划在同一组中,可能是因毛重楼和黑籽重楼在种质资源圃集中生长的过程中,发生了种间基因交流,获得了相似的基因型[9]。
参 考 文 献
[1]中国植物志编辑委员会.中国植物志(第15卷)[M].北京:科学出版社,1978.
[2]赵志勇,高文远,黄贤校,等.重楼属植物分类学研究进展[J].药物评价研究,2010,33(3):244-246.
[3]国家药典委员会编.中华人民共和国药典(2015版)第一部[M],北京:中国医药科技出版社,2015.
[4]辛本华.重楼属植物遗传多样性研究与品质评价分析[D].成都:四川农业大学,2012.
[5]唐铭霞,王丽,翁周.黑籽重楼种内AFLP遗传多样性及遗传分化研究[J].四川大学学报(自然科学版),2008,45(2):402-408.
[6]陈中苏直,田波,蔡传涛.基于SSR分子标记的滇重楼遗传多样性研究[J].中草药,2017,48(9):1834-1838.
[7]张金渝,虞泓,张时刚,等.多叶重楼遗传多样性的RAPD分析[J].生物多样性,2004,12(5):517-522.
[8]周武先,段媛媛,卢超,等.基于CDDP标记的重楼属种质资源鉴定及遗传多样性分析[J].中草药,2019,50(20):5033-5039.
[9]李壮,辛本华,杨华,等.重楼属植物遗传多样性的SCOT标记[J].广西植物,2014,34(3):315-319.
[10]孙玥,苏京平,王胜军,等.ISSR分子标记技术在作物遗传育种中的应用[J].种子科技,2019,37(12):26-27.
[11]Doyle J J,Doyle J L.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochem Bull,1987,19: 11-15.
[12]尹晓蛟,何银生,王智,等.基于表型的重楼种质遗传多样性分析[J].浙江农业科学,2020,61(5):960-964.
[13]李恒.重楼属的分类研究[J].植物研究,1986,6(1):109-144.
(责任编辑:唐 岚)
