IL-18和ESM-1在急性呼吸窘迫综合征大鼠中的作用
2020-11-30向群殷宗宝
向群 殷宗宝
1中南大学湘雅医学院附属海口医院重症医学科570208;2中南大学湘雅医学院附属海口医院急诊科570208
近年ARDS的治疗有保护性通气、液体管理、体外膜肺氧合等,患者病死率有一定的下降,但是中度及以上的ARDS患者的病死率仍高于40%[1]。这是因为ARDS 的临床表现缺乏特异性,与心源性肺水肿和重症肺炎等疾病极不容易相鉴别,早期诊断、早期干预对改善预后,降低病死率有十分重要的作用。ARDS的病理生理机制十分复杂,涉及到全身炎症反应、凝血/纤溶平衡失调、肺泡上皮细胞及肺毛细血管内皮细胞损伤等病理生理过程,在全身炎症反应与肺泡上皮细胞及肺毛细血管内皮细胞损伤的过程中,机体全身炎症反应中的抗炎和促炎反应失衡起着主要作用,因此如果临床上有早期监测机体炎症变化和肺血管内皮细胞损伤的指标则可以提高诊断率和预后[2-3]。目前研究发现IL-18是炎症反应一个高度盖然性的指标[4],而内皮细胞特异分子1 (endothelial cell specific molecule-1,ESM-1)可以反映肺毛细血管内皮细胞的潜在指标[5]。本研究旨在探讨血清IL-18 和ESM-1 在ARDS大鼠的诊断价值,为临床早期诊断ARDS提供理论支持。
1 材料与方法
1.1 主要仪器和试剂 光学显微镜:日本Oly mpus公司,酶标仪:奥地利TECAN 公司,台式普通离心机:上海安亨科学仪器厂,医用深低温冰箱:德国For ma公司,超净工作台:北京伟达净化技术研究所,Finnpipette 可调式移液器:热电(上海)仪器有限公司,脂多糖内毒素:日本化药株式会社,进口许可证号X20000349;大鼠IL-18和ESM-1 酶联免疫吸附测定试剂盒:美国Rapid Bio公司。浓缩型兔抗大鼠IL-18和ESM-1抗体(美国Santa Cruz公司),即用型SABC 试剂盒(兔Ig G)和DAB 显色试剂盒 (棕黄色,北京中杉金桥生物技术有限公司)。
1.2 动物来源及分组 健康清洁级雄性大鼠120只(5 周),合格证号:SCXK0020158,体质量(150±20)g,由温州医学院实验动物中心提供;完全数字随机分为对照组40 只、干预组40 只、ARDS组40只,常规喂养。
1.3 造模方法 ARDS组:参照王华兵等[6]建立ARDS模型方法,取Wistar大鼠,以2%戊巴比妥钠经腹腔内注射麻醉后,用鼠灌胃器插入气道并回抽出有大量气体后证明确己在气管内,缓慢注入含脂多糖内毒素的生理盐水2 mg/kg (浓度2 g/L),注入后立即旋转动物,使药液在肺内分布均匀。干预组:同ARDS组以等量的生理盐水代替脂多糖内毒素气管内注入。
1.4 大鼠血清标本采集 在ARDS模型成功后6、12、24、48 h,分别用2%戊巴比妥钠腹腔内注射麻醉,仰卧位开腹腔,取腹主动脉近心端断端全血8 ml,室温静置2 h 后,以3 000 r/min 离心15 min,离心半径10.0 c m,取上层血清保存于-70 ℃冰箱中备用。将右下肺于4%多聚甲醛固定,待病理组织学观察,左下肺于-80 ℃液氮内保存待实时荧光PCR 法检测。干预组和正常对照组用同样的方法收集标本。
1.5 检测指标及方法
1.5.1 普通病理观察 右肺下叶肺组织常规HE染色。
1.5.2 左肺下叶肺组织IL-18 mRNA、ESM-1B mRNA 检测 取液氮内各组大鼠左下肺组织,用Trizol试剂提取总RNA,逆转录反应按照试剂盒说明书操作。采用引物设计软件:Pri mer 5.0 Rotor-gene 6.0,Cor bett Research生产。Ppia:正向引物 5'-CCGCAGAAAGGATATGGCTA-3',反向引物5'-GGCAGGAGCTCTATGCATCA-3',长度160 bp;IL-18:正向引物5'-CACCTATCGCAGTCCACTTGAC-3',反向引物5'GCACCGCTACATCATTCGA3',长度133 bp;ESM-1:正向引物5'-AGCTATAACATGCTCGCGAGTC-3',反向引物5'-CCTAGATTCGGTCGCTTAGAT-3',长度95 bp。目的基因和管家基因PCR反应体系:d NTP (每次2.5 mmol/L)2.5 μl,10×PCR 缓冲液2μl,Mg Cl2溶液1.5μl,Taq聚合酶2.5μmol/L,10μmol/L PCR 正向引物和反向引物各1μl,c DNA 1μl,加水至总体积25μl;PCR 反应条件:95 ℃变性5 min;45个PCR 循环(94 ℃25 s,59 ℃30 s,72 ℃20 s);72 ℃延 伸5 min。将PCR 产物进行10 倍梯度稀释:设定PCR产物浓度为1,分别稀释为1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7、1×10-8、1×10-9。几个梯度稀释的DNA 模板和所有c DNA 样品分别配置Realti me PCR 反应体系。置Realti me PCR 仪 进 行PCR 反 应,Ppia (ENF):95 ℃5 min,43个PCR 循 环 [95 ℃15 s,60 ℃10 s,70 ℃20 s,80 ℃ (收集荧光)5 s]。Ppia(BSR):95 ℃5 min,35 个PCR 循 环 [95 ℃10 s,59 ℃15 s,72 ℃20 s,80.5 ℃ (收 集 荧光)5 s]。IL-8:95 ℃5 min,40 个PCR 循 环[95 ℃10 s,59 ℃15 s,72℃20 s,83℃(收集荧光)5 s]。ESM-1:95 ℃5 min,43个PCR 循环[95 ℃10 s,59 ℃15 s,72 ℃20 s。78 ℃(收集荧光)5 s]。结束后从72 ℃缓慢加热到99 ℃建立PCR 产物熔解曲线,根据此曲线,各样品目的基因和管家基因浓度由机器生成。每个样品目的基因浓度除以其管家基因浓度,即为此样品此基因校正后的相对含量。
1.5.3 大鼠血清IL-18和ESM-1的测定 采用双抗体夹心法测定大鼠血清IL-18和ESM-1,按试剂盒说明书要求进行。
1.5.4 免疫组织化学 肺组织IL-18和核因子κB(nuclear factor kappa B,NF-κB)的测定按免疫组织化学试剂盒说明的SABC 法进行。据肺组织的IL-18和NF-κB IHC 表 达 结 果 用SPOT 及IPP 图像采集分析系统处理,40×10视野下观察采集图像,I mage-Pro Pl us 6.0版专业图像分析软件处理结果,以累积吸光度值表示IL-18 和NF-κB 表达的相对强度,每张切片选5个免疫反应较强视野进行分析。
1.6 统计学分析 采用SPSS 20.0统计软件进行统计学分析。计量资料以±s表示,多组比较采用方差分析,2 组间比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 肺组织病理变化 干预组未出现明显的病理变化。ARDS组12 h表现为肺泡间质增厚,肺泡水肿;24 h表现为肺泡毛细血管扩张,有炎症细胞渗出,肺泡结构大量破坏。见图1。
2.2 各组左肺下叶肺组织IL-18 mRNA、ESM-1 mRNA 的表达 ARDS 组各时间点IL-18 mRNA和ESM-1 mRNA 表达水平均高于干预组 (P值均<0.05)。随着时间的延长,ARDS 组IL-18 mRNA 和ESM-1 mRNA 的表达逐渐增加;ARDS组6 h 的IL-18 mRNA 和ESM-1 mRNA 表 达 与48 h的比较,差异均有统计学意义 (t=5.12、5.17,P值均<0.05)。见表1。
2.3 各组大鼠肺组织IL-18和NF-κB的表达 与干预组相比,ARDS 组各时间点IL-18 和NF-κB阳性反应增强(P值均<0.05),呈片块状或粗条索状(表2、图2)。
2.4 各组大鼠血清IL-18 和ESM-1 的含量 ARDS组各时间点大鼠血清IL-18 和ESM-1 的含量均高于干预组 (P值均<0.05)。ARDS组6 h血清IL-18和ESM-1含量与48 h比较,差异均有统计学意义 (t=5.46、5.14,P值均<0.05)。见表3。

图1 干预组及ARDS组肺组织病理 HE ×100 A:干预组;B:ARDS组12 h;C:ARDS组24 h
表1 各组大鼠肺组织不同时间点IL-18 mRNA 和ESM-1 mRNA 的表达 (×10 2,±s)
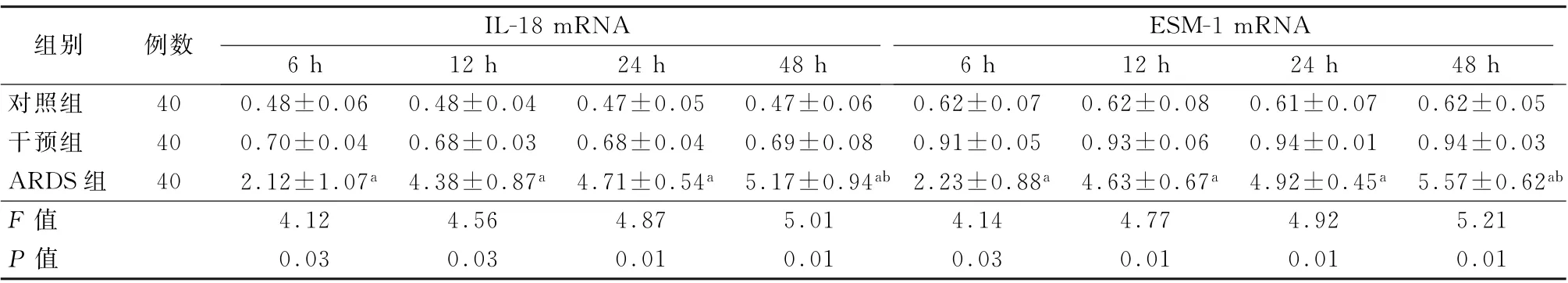
表1 各组大鼠肺组织不同时间点IL-18 mRNA 和ESM-1 mRNA 的表达 (×10 2,±s)
注:ESM-1为内皮细胞特异分子1;与干预组比较,a P <0.01;与6 h比较,b P <0.05
组别 例数 IL-18 mRNA ESM-1 mRNA 6 h 12 h 24 h 48 h 6 h 12 h 24 h 48 h对照组 40 0.48±0.06 0.48±0.04 0.47±0.05 0.47±0.06 0.62±0.07 0.62±0.08 0.61±0.07 0.62±0.05干预组 40 0.70±0.04 0.68±0.03 0.68±0.04 0.69±0.08 0.91±0.05 0.93±0.06 0.94±0.01 0.94±0.03 ARDS组 40 2.12±1.07 a 4.38±0.87 a 4.71±0.54 a 5.17±0.94 ab 2.23±0.88 a 4.63±0.67 a 4.92±0.45 a 5.57±0.62 ab F 值 4.12 4.56 4.87 5.01 4.14 4.77 4.92 5.21 P 值 0.03 0.03 0.01 0.01 0.03 0.01 0.01 0.01
表2 各组大鼠不同时间点肺间质IL-18和NF-κB的定量表达 (±s)
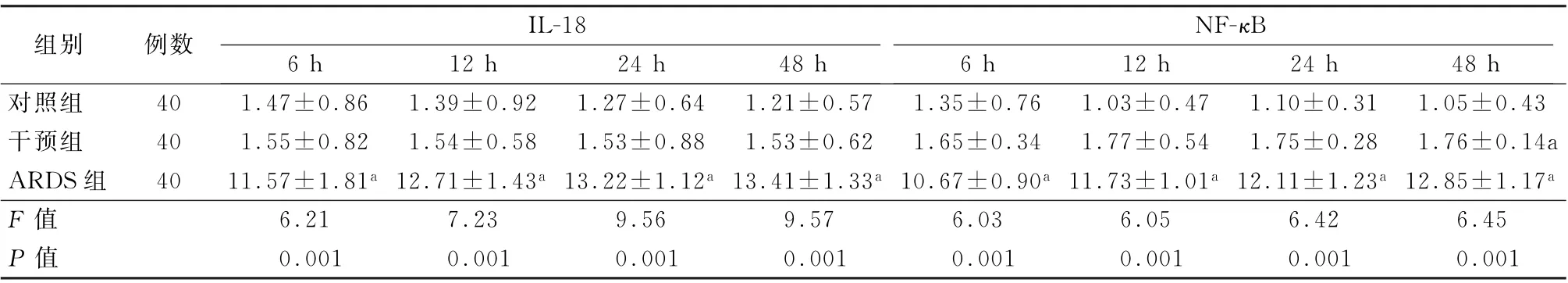
表2 各组大鼠不同时间点肺间质IL-18和NF-κB的定量表达 (±s)
注:NF-κB为核因子κB;与干扰组比较,a P <0.01
组别 例数 IL-18 NF-κB 6 h 12 h 24 h 48 h 6 h 12 h 24 h 48 h对照组 40 1.47±0.86 1.39±0.92 1.27±0.64 1.21±0.57 1.35±0.76 1.03±0.47 1.10±0.31 1.05±0.43干预组 40 1.55±0.82 1.54±0.58 1.53±0.88 1.53±0.62 1.65±0.34 1.77±0.54 1.75±0.28 1.76±0.14a ARDS组 40 11.57±1.81 a 12.71±1.43 a 13.22±1.12 a 13.41±1.33 a 10.67±0.90 a 11.73±1.01 a 12.11±1.23 a 12.85±1.17 a F 值 6.21 7.23 9.56 9.57 6.03 6.05 6.42 6.45 P 值 0.001 0.001 0.001 0.001 0.001 0.001 0.001 0.001

图2 ARDS组大鼠肺组织各时间点IL-18的表达 DAB ×400 A:6 h;B:12 h;C:24 h;D:48 h
表3 各组大鼠血清不同时间点IL-18和ESM-1含量 (ng/L,±s)

表3 各组大鼠血清不同时间点IL-18和ESM-1含量 (ng/L,±s)
注:ESM-1为内皮细胞特异分子1;与干预组比较,a P <0.01;与6 h比较,b P <0.05
组别 例数 IL-18 ESM-1 6 h 12 h 24 h 48 h 6 h 12 h 24 h 48 h对照组 40 0.71±0.06 0.83±0.03 0.77±0.08 0.64±0.04 0.48±0.04 0.37±0.06 0.21±0.02 0.19±0.05干预组 40 0.97±0.02 0.99±0.04 0.98±0.06 0.99±0.06 0.88±0.01 0.86±0.07 0.98±0.06 0.87±0.04 ARDS组 40 9.05±0.51 a 11.07±0.97 a 12.33±0.49 a 14.58±0.82 ab 10.23±0.14 a 13.01±0.31 a 14.87±0.24 a 15.78±0.41 ab F 值 7.21 7.79 8.01 8.99 8.23 9.76 10.23 11.33 P 值 0.001 0.001 0.001 0.001 0.001 0.001 0.001 0.001
3 讨论
患者在严重感染、休克、创伤及烧伤等疾病过程中容易发生ARDS,其临床特征是由于肺毛细血管内皮细胞和肺上皮细胞损伤引起的弥漫性肺间质水肿和肺泡水肿,以进行性低氧血症、呼吸窘迫为特征的临床综合征[7]。各种损伤导致机体抗炎和促炎反应失衡引起肺泡上皮细胞、肺血管内皮细胞弥漫性损伤是ARDS发生的病理基础[2]。尽管目前在治疗上取得了很多进展,但ARDS 发病率和病死率仍居高不下。其原因之一就是临床上缺乏敏感的ARDS早期诊断和病情严重程度监测指标。本实验用大鼠ARDS模型探讨不同时间点的肺结构变化和血清炎症因子的变化,阐明他们之间的关系。病理切片实验结果显示干预组肺泡结构基本正常,未出现明显病理变化;ARDS组12 h大鼠肺间质水肿、增厚,24 h 时肺泡结构破坏,符合ARDS组织病理演变过程。
IL-18是近年发现的一种多功能细胞因子,它诱导干扰素-γ生成,促进T 细胞活化,趋化多形核白细胞到达急性炎症部位,同时激活的IL-18与IL-18受体a链结合后,再与IL-18受体β链结合,形成三者复合体,通过NF-κB 信号途径发挥着免疫调节作用[4]。实验证实通过抑制NF-κB 信号途径可以减轻IL-18细胞因子的转录水平,导致减轻ARDS大鼠炎症症状[8-10]。有学者研究作用发现,胱甘草定可以通过抑制NF-κB 从而减少大鼠血浆IL-18的含量来保护脂多糖致ARDS大鼠[4]。这些研究证明了NF-κB 可以促进IL-18 的生成,与本实验结果相似。本实验ARDS 组的6、12、24、48 h免疫组织化学结果显示,随着时间的延长,IL-18和NF-κB逐渐在肺组织高表达,与各组相应时间点上的干预组比较,差异均有统计学意义(P值 均<0.05)。这 说 明IL-18 和NF-κB 在ARDS发生、发展中起着重要作用,尤其是在引起肺结构性破坏并促使肺毛细血管内皮细胞渗出大量造成肺间质水肿、肺泡壁透明膜形成起着关键作用。本实验ARDS组大鼠肺组织和血液中的IL-18含量也表现为随着时间的延长逐渐增高,且ARDS组48 h的血清IL-18含量和肺组织的表达与6 h的相比,差异有统计学意义 (P<0.05),表明IL-18可能是反映和预测炎症严重情况指标之一。在炎症感染和机械通气大鼠的肺泡灌洗液、血清发现了IL-18,气管内滴入IL-18可以增加肺血管渗透性而滴入IL-18抗体可以缓解血管渗透性,减轻肺损伤[11-12]。在内毒素血症诱导的ARDS 小鼠模型中IL-18 mRNA 高表达[13]。本实验ARDS组大鼠肺组织IL-18 mRNA 在6 h高表达,且随着时间的延长表达增高,ARDS组48 h IL-18 mRNA 与6 h比较,差异有统计学意义 (P<0.05),说明IL-18是肺组织炎症重要指标,可以用于后期监测。IL-18是一种重要的炎症趋化因子,在ARDS早期血浆中IL-18浓度升高与ARDS患者病死率、多器官功能衰竭发生相关[14]。虽然炎症因子与ARDS患者预后相关,感染、应激等可以引起炎症因子升高,不具有特异性,但是将IL-18和其他类型生物标志物联用,可用于ARDS 诊断和预后评估。本实验从ARDS 大鼠肺组织和血清含量方面上说明IL-18是一个很有潜力的评价炎症严重程度指标。
ESM-1大部分由激活的内皮细胞分泌,主要在肺表达,其次在肾血管、肿瘤内皮细胞等。在肺组织中,ESM-1大量表达在肺毛细血管内皮细胞和支气管上皮细胞,在肺泡上皮细胞少量表达,而肺大血管内皮细胞未见表达[15]。多种炎症细胞因子可以促进ESM-1 mRNA 表达。研究表明脂多糖、肿瘤坏死因子α、IL-1等可以促进肺毛细血管内皮细胞分泌ESM-1,与时间成正比[17]。本实验ARDS 组 的6、12、24、48 h 大 鼠 肺 组 织 中 的IL-18 mRNA、ESM-1 mRNA 表达和血清IL-18、ESM-1水平逐渐增高,且以上指标在6 h和48 h比较,差异有统计学意义 (P<0.05),这表明随着炎症程度的加重,肺毛细血管内皮细胞的ESM-1 mRNA 和IL-18 mRNA 表达逐渐增高,说明IL-18有可能促进了肺毛细血管内皮细胞对ESM-1的表达和分泌,加重了ARDS严重程度。有研究发现血浆ESM-1 水平越高,提示ARDS 的预后越差,认为ESM-1可以作为独立预测ARDS患者预后的生物学指标[15]。这也与本实验在不同时间点ARDS大鼠肺组织的病理结构和血清学检测结果相一致。
总之,炎症因子IL-18是ARDS早期的监测指标之一,增加了肺毛细血管内皮细胞渗透性。随着ARDS的进展,IL-18和ESM-1的表达和水平也增加,提示其预后较差,为临床ARDS的诊断和预后评估提供了理论支持。
利益冲突 所有作者均声明不存在利益冲突
