艾司洛尔联合右美托咪定对重型颅脑创伤患者去骨瓣减压术后脑代谢及预后的影响
2020-11-30徐丽张玉坤吴江陈军嵇富海
徐丽,张玉坤,吴江,陈军△,嵇富海
重型颅脑创伤发生率高居全身创伤的第2位,且好发于青壮年,致死致残率极高,外科手术清除血肿和坏死脑组织并去骨瓣减压可以降低患者病死率和病残率[1-2]。但是,颅脑创伤后继发的脑缺血缺氧、脑水肿仍可影响脑灌注压和颅内微循环,导致脑细胞代谢紊乱、无氧酵解增加等病理生理反应[3]。镇静药物是颅脑外科去骨瓣减压术后重要的辅助治疗手段,具有减轻创伤后应激反应、降低脑组织代谢、调节颅内压(ICP)等作用。右美托咪定作为一种镇痛镇静药物,具有控制交感活性、改善应激反应的作用,已广泛应用于神经外科重症患者的治疗[4]。艾司洛尔是β1受体阻滞剂,具有一定的抗交感作用,多被用于高血压及心动过速的治疗,但对重型脑创伤后脑代谢及脑血流的影响尚不明确[5]。本研究对接受去骨瓣减压术的重型颅脑创伤患者术后采用艾司洛尔联合右美托咪定治疗,探讨联合治疗方案对于重型颅脑创伤患者的脑代谢及ICP的影响。
1 对象与方法
1.1 研究对象选取2015年1月—2018年12月收治于苏州大学附属第一医院麻醉科/中心重症监护室(ICU)或神经外科重症监护室(NICU)的重型颅脑创伤并行单侧去骨瓣减压手术的患者60例。采用随机信封法分为艾司洛尔联合右美托咪定治疗组(联合治疗组,30例)和单用右美托咪定治疗组(对照组,30例),术后分别给予艾司洛尔联合右美托咪定治疗和右美托咪定治疗。2组患者一般情况比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究经医院伦理委员会审批同意,所有入组患者家属均签署知情同意书。
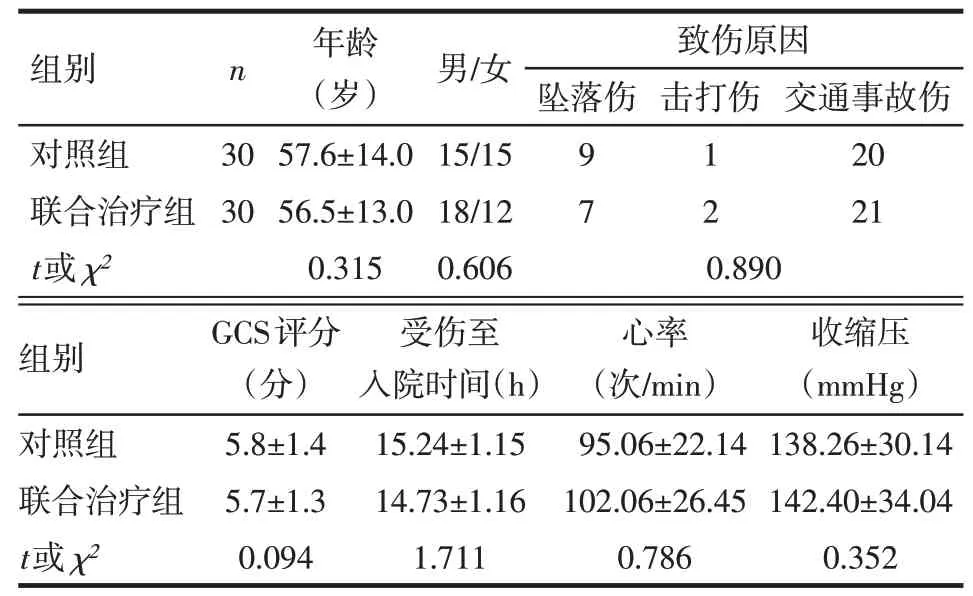
Tab.1 Comparison of clinical data between the two groups表1 2组患者临床资料的比较
1.2 纳入与排除标准纳入标准:(1)有明确颅脑创伤史,经头部CT明确诊断。(2)予单侧去骨瓣减压术。(3)年龄>18岁。(4)入院时GCS评分4~8分。(5)术后复查CT确认无需再次手术。排除标准:(1)深昏迷,双侧瞳孔散大。(2)入院时检查收缩压<90 mmHg。(3)合并心脏、肺、肾脏等器官功能衰竭。(4)对右美托咪定或艾司洛尔过敏。
1.3 治疗方法(1)单侧去骨瓣减压术。患者仰卧位,全身麻醉后做常规大骨瓣开颅,术中清除血肿和坏死脑组织,经额部皮质穿刺侧脑室额角,置入带脑室引流的ICP传感器,骨瓣去除,常规关颅,带管进入ICU。(2)围手术期管理。①镇静药物应用:对照组给予右美托咪定(江苏恒瑞医药股份有限公司,国药准字H20090248;批号190525BP)1μg/(kg·h)静脉泵入,持续10 min,进入镇静状态后,予以0.2~0.7μg/(kg·h)静脉泵入维持,每天2次,给药时间≤7 d。联合治疗组给予右美托咪定(给药方式同对照组)+艾司洛尔(齐鲁制药有限公司,国药准字H19991059;批号9A0032C05)0.05~0.20 mg/(kg·min)静脉泵入维持,每天2次,给药时间≤7 d。②常规处理:患者按照美国严重创伤性颅脑损伤的管理指南第四版[6]进行监测评估,去骨瓣减压术后动态监测ICP,通过ICP探头的脑室外引流装置留取脑脊液(CSF)进行检测,判断是否存在颅内感染;伤口每1~2 d换药,10~14 d视愈合情况予以拆线;术后根据痰培养、CSF培养及药敏结果予以敏感抗生素治疗,根据患者呼吸情况予以气管切开及呼吸机辅助通气治疗等。
1.4 观察指标(1)分别于治疗前和治疗后1、3、7 d从颅内压探头的脑室外引流装置直接留取CSF,采用全自动血气分析仪(ABL-90)检测CSF乳酸含量;采用酶联免疫吸附测定(ELISA)法检测CSF中S100B蛋白水平(试剂盒购自美国R&D公司)。(2)测量2组患者治疗前和治疗后1、3、7 d ICP变化情况,ICP分级标准:5~15 mmHg为正常,16~20 mmHg为轻度增高,21~40 mmHg为中度增高,>41 mmHg为重度增高。(3)于镇静药物应用期间和停药后24 h内观察并记录药物不良反应,主要为低血压和心动过缓。(4)比较2组患者治疗后14 d的GCS评分和美国国立卫生研究院卒中量表(NIHSS)评分变化。
1.5 随访和预后评估出院后共随访6个月,预后随访以电话、微信交流或患者来院复诊的方式进行,每月1次。采用Glasgow预后分级(GOS,1~5分)评价长期预后:1分为死亡;2分为植物生存;3分为重度伤残,意识清楚但生活无法自理;4分为中度残疾,可在一定保护下独立生活工作;5分为恢复良好或存在轻度神经障碍,可独立正常生活和工作。其中1~3分为不良预后,4~5分为良好预后。
1.6 统计学方法采用SPSS 23.0进行统计学分析。所有计量资料均进行正态性检验及方差齐性检验,符合正态分布计量资料采用均数±标准差(x±s)表示,采用重复测量数据的方差分析和独立样本t检验。计数资料以例(%)表示,组间比较采用χ2检验。等级资料采用Mann-WhitneyU检验进行分析比较。P<0.05为差异有统计学意义。
2 结果
2.1 2组患者CSF中乳酸含量和S100B蛋白表达水平比较时间和治疗方法对CSF中乳酸和S100B的表达均有影响,且两者存在交互效应,2组患者治疗前CSF乳酸含量和S100B蛋白表达水平差异均无统计学意义(P>0.05);从治疗后第1天开始,2组CSF乳酸含量和S100B蛋白表达水平总体均呈下降趋势;联合治疗组患者治疗后1、3、7 d的乳酸含量和S100B蛋白表达水平均低于对照组。见表2。
Tab.2 Comparison of lactin and S100B concentrations in CSF at different time points between the two groups表2 2组患者不同时间点CSF乳酸含量和S100B蛋白表达水平比较 (n=30,±s)
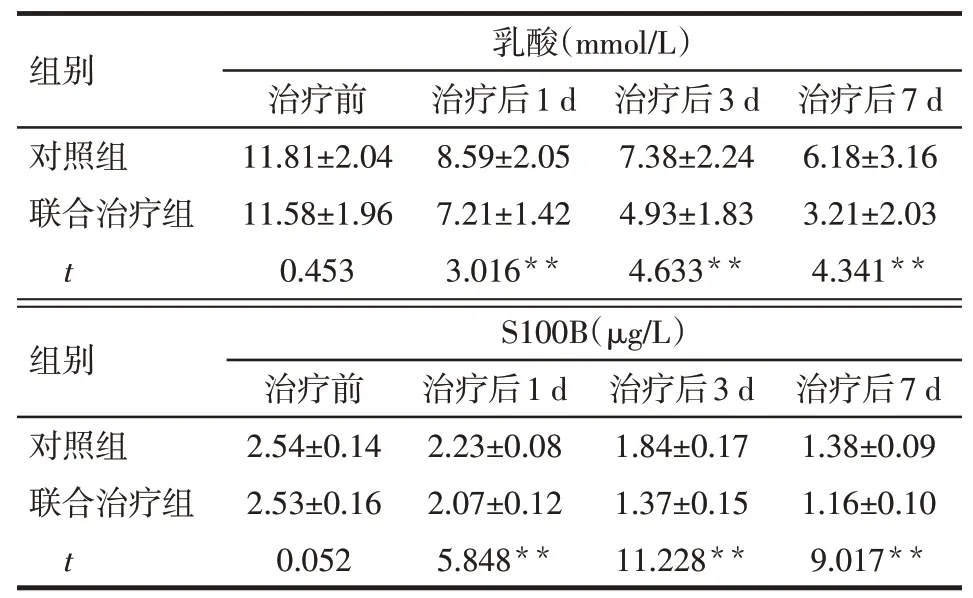
Tab.2 Comparison of lactin and S100B concentrations in CSF at different time points between the two groups表2 2组患者不同时间点CSF乳酸含量和S100B蛋白表达水平比较 (n=30,±s)
**P<0.01;乳酸:F组间=16.581,F时间=229.398,F交互=9.273,均P<0.01;S100B:F组间=87.519,F时间=1 524.746,F交互=45.613,均P<0.01
组别对照组联合治疗组t乳酸(mmol/L)治疗前11.81±2.04 11.58±1.96 0.453治疗后1 d 8.59±2.05 7.21±1.42 3.016**治疗后3 d 7.38±2.24 4.93±1.83 4.633**治疗后7 d 6.18±3.16 3.21±2.03 4.341**组别对照组联合治疗组t S100B(μg/L)治疗前2.54±0.14 2.53±0.16 0.052治疗后1 d 2.23±0.08 2.07±0.12 5.848**治疗后3 d 1.84±0.17 1.37±0.15 11.228**治疗后7 d 1.38±0.09 1.16±0.10 9.017**
2.2 2组患者治疗前后ICP变化时间和治疗方法对ICP均有影响,且存在交互效应。2组患者治疗前ICP比较差异无统计学意义(P>0.05);从治疗后第1天开始,2组ICP呈下降趋势;联合治疗组治疗后1、3、7 d的ICP分别均低于对照组,见表3。
Tab.3 Comparison of ICP at different time points between the two groups表3 2组患者不同时间点ICP比较(n=30,mmHg,±s)

Tab.3 Comparison of ICP at different time points between the two groups表3 2组患者不同时间点ICP比较(n=30,mmHg,±s)
**P<0.01;F时间=173.356,F组间=28.416,F交互=5.414,均P<0.01
组别对照组联合治疗组t治疗前23.7±2.6 22.4±3.1 1.702治疗后1 d 18.4±2.7 13.8±3.1 6.118**治疗后3 d 17.4±3.3 14.9±3.3 2.990**治疗后7 d 14.4±4.1 9.9±3.6 4.481**
2.3 2组患者治疗后GCS评分和NIHSS评分变化治疗后14 d,联合治疗组GCS评分和NIHSS评分均高于对照组(P<0.01)。见表4。
Tab.4 Comparison of GCS score and NIHSS score before and after treatment between the two groups表4 2组患者治疗2周后的GCS和NIHSS评分比较(n=30,分,±s)

Tab.4 Comparison of GCS score and NIHSS score before and after treatment between the two groups表4 2组患者治疗2周后的GCS和NIHSS评分比较(n=30,分,±s)
**P<0.01
组别对照组联合治疗组t GCS评分6.46±1.19 7.66±1.56 3.343**NIHSS评分4.10±1.26 4.96±0.88 3.063**
2.4 2组随访时GOS评分比较出院后6个月随访时,联合治疗组患者GOS评分与对照组比较差异无统计学意义(P>0.05),见表5。
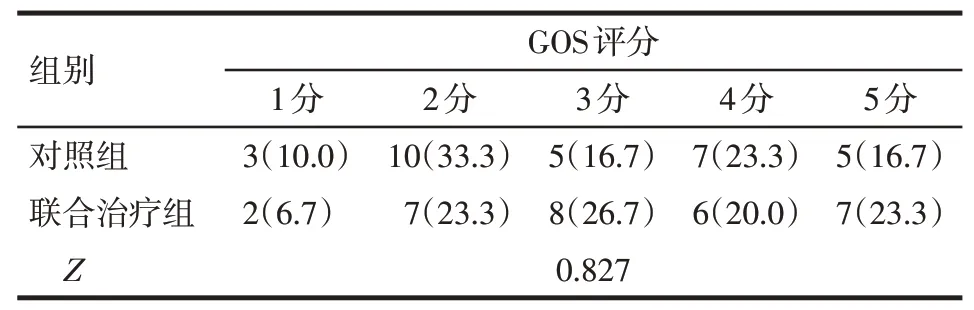
Tab.5 Comparison of GOS score 6 months after followup between the two groups表5 2组患者6个月后GOS评分比较[n=30,例(%)]
2.5 2组患者不良反应发生情况比较对照组8例(27%)出现心动过缓,8例(27%)出现血压下降。联合治疗组6例(20%)出现动过缓,10例(33.3%)出现血压下降。2组患者心动过缓和血压下降的发生率比较均无统计学意义(χ2分别为0.373和0.318,均P>0.05)。
3 讨论
重型颅脑创伤致残致死率高,长期以来治疗效果欠佳。重型颅脑创伤除了创伤本身所致的脑组织损伤及血肿形成以外,其继发的一系列病理生理过程包括神经细胞能量代谢障碍、血流动力学调节异常等均会加重脑组织缺血缺氧和神经元损伤,临床上表现为ICP进行性升高,最终导致不良预后[6-7]。开颅手术可以清除损伤所致的坏死脑组织和血肿,同时通过去骨瓣来缓解围手术期的ICP增高[8];但并不能缓解脑损伤后交感中枢兴奋性传出增强导致的脑代谢增加,因此适当的镇静降低脑代谢及伤害性刺激诱发的交感神经反应在围手术期治疗显得尤为重要。
脑能量代谢需求量大,几乎完全依赖于葡萄糖的氧化。颅脑创伤后,脑能量代谢需求急剧增加,而受损的脑组织因缺血缺氧等因素导致糖有氧代谢障碍,使得无氧酵解增加致乳酸大量产生,从而导致CSF中乳酸水平病理性升高[9]。因血脑屏障的存在,传统的血乳酸与CSF乳酸水平存在差异,并且血乳酸水平受肺部感染、心功能不全等多种脑外因素所干扰,故而CSF乳酸更能反映脑代谢状态。已有研究表明,CSF乳酸水平可预测颅脑创伤患者的预后[10]。此外,S100B蛋白是一种主要存在于神经胶质细胞的神经组织特异性蛋白质,细胞损伤或应激时诱导其过量表达,并在脑创伤急性期从受损细胞中渗漏,积聚在细胞外间隙[11]。研究表明动脉瘤性蛛网膜下腔出血患者CSF中S100B蛋白水平高提示脑损伤严重,预后不佳[12-13]。因此,检测CSF乳酸和S100B可以较为全面准确地评估颅脑组织损伤程度及代谢情况,有可能进一步预测病情预后。
右美托咪定具有镇痛镇静作用,几乎不影响呼吸,并可保留唤醒功能[14]。近年来,越来越多的研究表明右美托咪定具有器官保护功能,其中也包括脑保护作用[15-16]。He等[17]通过对9项临床试验的404例颅脑手术病例的荟萃分析发现,右美托咪定能够改善颅脑手术中血流动力学的稳定性,具有神经保护作用。艾司洛尔是一种超短效、高选择性的β1受体阻滞剂,能够抑制伤害性刺激引起的肾上腺素能反应。有研究表明循环中儿茶酚胺水平与颅脑创伤的死亡率直接相关[18]。而在大鼠脑卒中模型中已发现艾司洛尔可通过降低中枢神经系统的交感兴奋性来降低脑血流及脑代谢率,进而发挥脑保护作用[19],但是在临床应用中尚鲜见相关报道。笔者使用右美托咪定和艾司洛尔联合治疗,发现联合治疗相比对照组可以有效降低CSF中乳酸含量和S100B蛋白表达水平及ICP,同时治疗后14 d的GCS评分和NIHSS评分均优于对照组。其可能机制为:艾司洛尔联合右美托咪定一方面可以协同降低内源性儿茶酚胺释放,降低应激反应,进而降低脑代谢;另一方面可以扩张外周血管,控制平均动脉压和脑灌注压,保持血流动力学稳定,降低脑血流和毛细血管静水压,控制脑水肿,降低ICP。然而出院后6个月随访时,2组患者GOS评分无明显差异,提示艾司洛尔联合右美托咪定治疗与单用右美托咪定相比,未能有效改善颅脑创伤术后患者的长期预后。可能的原因是本研究的病例数较少,且重型颅脑创伤的病理生理过程复杂,涉及多器官多系统,单一药物的使用仍有一定的局限性。此外,本研究中联合治疗组和对照组比较不良反应发生率差异无统计学意义,表明在右美托咪定的基础上加用艾司洛尔并未明显增加不良反应。
综上所述,与单用右美托咪定治疗对比,艾司洛尔联合右美托咪定治疗可有效降低重型颅脑创伤去骨瓣减压术患者CSF乳酸和S100B蛋白水平并降低ICP,且不良反应轻微,但不能改善患者的长期预后。由于本研究样本量小,只提示了艾司洛尔在重型颅脑创伤围手术期治疗中的可能应用潜力,对于其具体作用机制和对长期预后的影响仍有待后续深入研究。
