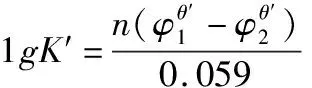氧化还原反应条件平衡常数与条件电位的关系探讨
2020-11-27赵立军田春媛庄旭明
王 丽,赵立军,栾 峰,田春媛,庄旭明
(烟台大学 化学化工学院,山东 烟台 264005)
分析化学中滴定分析法要求反应能够定量进行完全,氧化还原反应进行的完全程度通常可用平衡常数K来衡量,K越大,反应进行的越完全,而条件平衡常数K′更能说明氧化还原反应实际进行的程度。氧化还原反应的K(或K′)须根据有关电极电位进行计算。关于氧化还原反应条件平衡常数的计算以及与条件电位的关系,一般分析化学教科书中都有所述及,但是有的关系式不够严谨,概括的不够全面;有的一笔带过未进行推导,学生知其然而不知其所以然,本文主要针对条件平衡常数K′和条件电位的关系式进行了详细的探讨。
1 问题的提出
一个氧化还原反应是由两个氧化还原电对组成的,而氧化还原电对可以分为对称电对和不对称电对。对于对称电对参与的氧化还原反应,其条件平衡常数与条件电位的关系大多数教材中都有所指出。
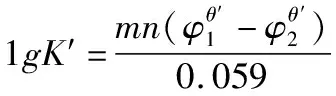
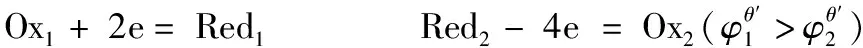
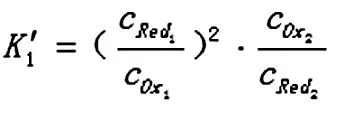
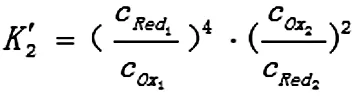
想要正确判断氧化还原反应进行的程度,必须要用正确的公式来进行计算。从上面的示例可以看出,在应用公式1时,如果m和n能够约分,用公式1计算出来的结果是错误的;所以为避免这种情况,在应用公式1时,要注意必须注明是在m和n不能约分的情况下才能使用。
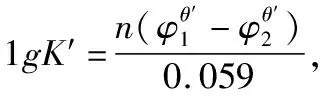
2 条件平衡常数与条件电位关系的推导
2.1 对称电对
2.1.1 转移电子数相同的对称电对
Ox1+n1e= Red1
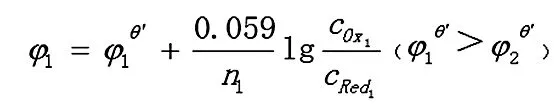
Ox2+n2e =Red2
(n1= n2=n)
其反应方程式应写为:Ox1+ Red2=Red1+Ox2
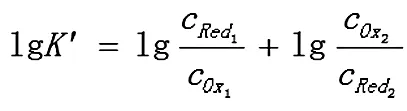
反应达到平衡时,两电对的电位相等,φ1=φ2
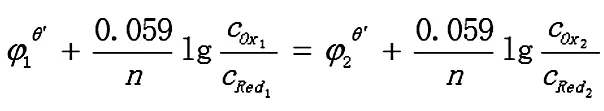
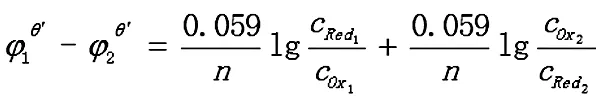
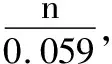
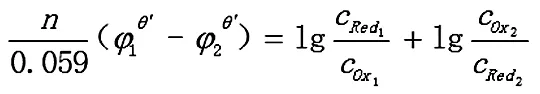
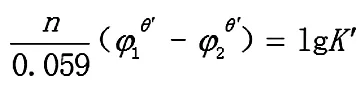
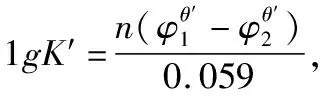
2.1.2 转移电子数不相同的对称电对
Ox1+n1e= Red1

Ox2+n2e=Red2
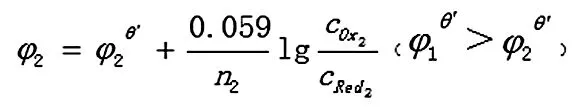
反应达到平衡时,两电对的电位相等,φ1=φ2
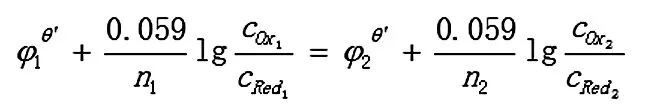
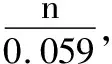
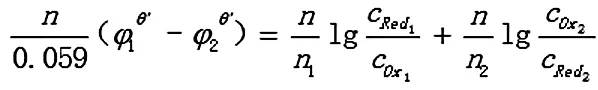
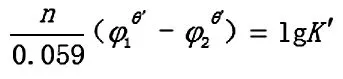
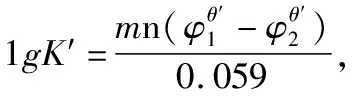
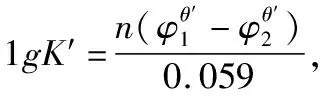
2.2 不对称电对
2.2.1 若其中一个电对为不对称电对
Ox1+n1e= Red1
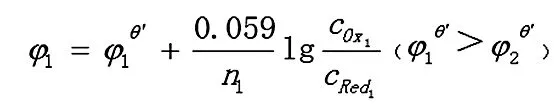
Ox2+n2e=p Red2
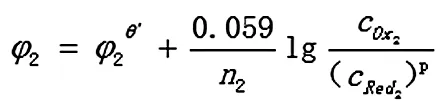
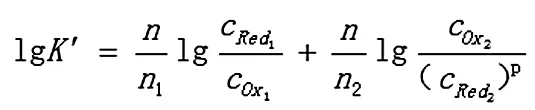
反应达到平衡时,两电对的电位相等,φ1=φ2
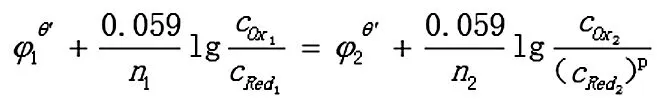
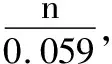
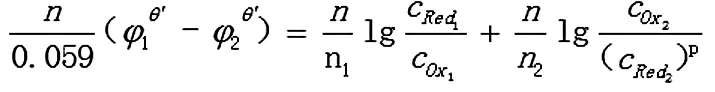
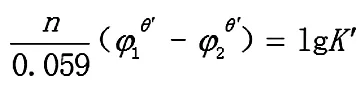
现今,裕固族开展良好的传统项目有欢庆节日时开展的马上运动,有深受裕固族人民喜爱的拉棍、拔棍、顶杠子等,还有少数民族传统体育运动会上的摔跤、赛马、射弩、拔河、拉爬牛等诸多比赛项目。这些项目凭借着着自身的项目特点在当今得到了较为健康的发展。但随着社会的飞速发展和现代娱乐项目的不断丰富,裕固族的一些传统体育项目(如:赛骆驼等)已渐渐失宠甚至失传。现代体育竞赛的快速发展,也无情地冲垮了传统体育与竞技的纺线,使它们濒临失传和消亡。
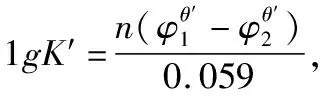
2.2.2 两个电对均为不对称电对
p1Ox1+n1e=p2Red1
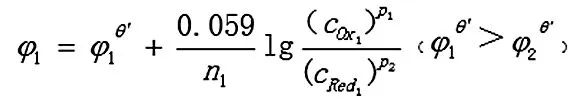
h1Ox2+n2e =h2Red2
(n为n1和n2的最小公倍数)
其反应方程式应写为:
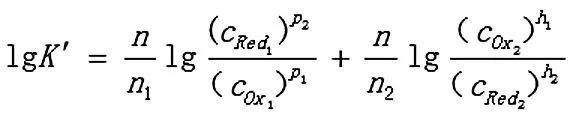
反应达到平衡时,两电对的电位相等,φ1=φ2
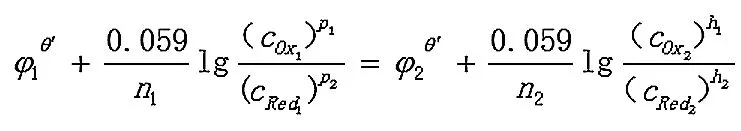
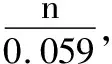
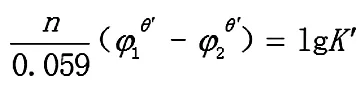
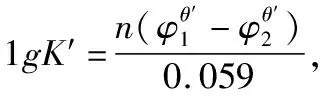
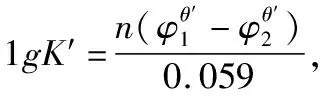
3 结语