青钱柳叶降血糖作用研究
2020-11-27杨胜祥赵立春
唐 梅,杨胜祥,赵立春
青钱柳叶降血糖作用研究
唐 梅1,杨胜祥2,*赵立春1
(1.广西中医药大学药学院,广西,南宁 530200;2.浙江农林大学理学院,浙江,杭州 311300)
研究青钱柳叶双水相提取物对糖尿病小鼠的降血糖作用。通过高脂饮食联合腹腔注射链佐霉素(STZ)建立小鼠糖尿病模型,设置青钱柳叶双水相提取物高、中、低剂量组灌胃,连续14 d后测定空腹血糖值,检测血清中胰岛素(INS)、总胆固醇(T-CHO)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、极低密度脂蛋白含量(VLDL-C),采用HE染色法观察实验性糖尿病小鼠肝脏和胰腺的病理学变化。青钱柳叶双水相提取物中剂量能明显改善2型糖尿病小鼠体重减轻这一症状(<0.01),低剂量组降低糖尿病小鼠空腹血糖(<0.05),高剂量组显示出降低血清胰岛素的作用(<0.05),青钱柳叶双水相提取物能降低糖尿病小鼠血清中总胆固醇、甘油三酯、低密度脂蛋白的含量,增加高密度脂蛋白含量。二甲双胍组和青钱柳叶双水相提取物高、中、低剂量组小鼠的肝脏和胰腺的病变较模型组有不同程度的减轻。青钱柳叶双水相提取物具有降低小鼠空腹血糖、降脂、改善胰岛素抵抗、保护胰岛细胞的作用,其降血糖的作用机制需进一步研究。
青钱柳叶;双水相提取;降血糖
糖尿病(diabetes mellitus,DM)是一种由多源性病因引起的以慢性高血糖为特征的代谢性疾病,是由胰岛素分泌和作用缺陷引起。糖尿病一般可分为胰岛素依赖性(1型,IDDM)及非胰岛素依赖性(2型,NIDDM,T2DM)两种类型,而2型糖尿病患者至少占糖尿病患者总数的90%以上。2017年国际糖尿病联盟(Internation Diabetes Federration,IDF)发布的第8版糖尿病概览数据显示,全球范围内共有4.25亿成年人患有糖尿病,其中我国糖尿病患病人数达到1.14亿,仍是全球糖尿病患病人数最多的国家,预测到2045年全球糖尿病人数将增至近7亿[1]。此外,据资料统计[2-3],儿童和青少年的患病率亦有所增高。在农村,因为医疗知识的缺乏,没有体检的意识,可能使得一部分人成为隐形糖尿病患者,未能纳入统计数据中[4]。2型糖尿病起病隐匿,大多数患者无症状或症状较轻,不少患者因身体检查、伴发病、慢性并发症而被发现。胰岛素缺乏和组织的胰岛素抵抗会引起不同程度的糖、脂肪、蛋白质、水及电解质等代谢紊乱综合征,久病者常并发眼、肾、心脑血管、神经等组织器官慢性进行性病变,最后引起多系统损伤,危害人类健康。糖尿病已成为全球发病率和死亡率最高的疾病之一,针对它的防治工作刻不容缓。
青钱柳((Batai.) Iljinskaja ) 系双子叶植物纲(Dicoty ledoneae)胡桃科(Juglandaceae)青钱柳属植物,另有甜茶树、青钱李、山麻柳、摇钱树等称。青钱柳是一种高大速生乔木,奇数羽状复叶,广泛分布于中国南方各省的海拔500~2500 m的山区和溪谷[5]。青钱柳是冰川世纪的孑遗树种,它是我国特有的单种属植物,也是国家重点保护的濒危植物之一,属于国家二级保护树种,有植物界的大熊猫、医学界的第三棵树之称。2007年,江西省修水神茶(集团)公司用青钱柳叶作为主要原料,研发生产了具有降糖、降压和减肥作用的一系列神茶,是我国保健茶中首个获得美国FDA颁发质量证书的产品。青钱柳的药理作用研究主要集中在降血糖、降血脂、降血压、抗氧化、抗菌、抗癌作用等方面。青钱柳被医学界称为“天然胰岛素”,其降糖作用是多成分、多位点、多环节作用的结果,研究表明其降血糖活性成分为多糖类[6-8]、黄酮类[9-11]、三萜及甾体[12-13]、内酯等化合物,一些微量元素[14]也与之相关。
两种高聚物溶于水,或高聚物与某种高价无机盐溶于水并静止一段时间后自然形成两种不相溶的上下两相,其中两相都含有大量水分,这种两相体系被称作双水相体系(Aqueous two-phase system, ATPS)。由于两相对某些化学物质的溶解性存在差异,双水相体系被当作一种液/液萃取分离技术使用,它具备能规模放大化、连续化操作、环保绿色等优点[15]。自1956年Albertsson[16]将此体系率先用于叶绿素的分离后,之后双水相体系被广泛应用于分离纯化蛋白质、基因、生物纳米分子、细胞和天然产物等领域[17-19]。它在中药活性成分方面主要集中在黄酮、生物碱、萜类、多酚、色素和蒽醌等几类化合物的研究应用。传统的双水相体系主要是双高聚物和聚合物/盐双水相体系,近年来小分子亲水有机溶剂和盐、离子液体和盐组成的双水相体系应用更为广泛。本实验采用乙醇/无机盐双水相体系提取青钱柳叶总黄酮,优化提取条件后,黄酮提取率达到3.00%,在优化的工艺条件下提取青钱柳叶提取物,并进行小鼠降血糖研究。
1 材料
1.1 药材与试剂
青钱柳干燥叶,2017年4月购于广西百色市隆林县德峨乡,经广西中医药大学袁经权教授鉴定为胡桃科青钱柳属植物青钱柳叶。乙醇(国药集团化学试剂有限公司)、石油醚(成都市科隆化学品有限公司)、乙酸乙酯、二氯甲烷(广东光华科技股份有限公司)。高脂大小鼠饲料(北京华阜康生物技术科技股份有限公司,SCXK(京)2014-0008),盐酸二甲双胍片(中美上海施贵宝制药有限公司,批号:国药准字H20023370),链脲佐菌素(Sigma-Aldrich, WXBC6558V)。柠檬酸(天津市大茂化学试剂厂,20181006),柠檬酸三钠(广东光华科技股份有限公司,20170414)。小鼠T-CHO、TG、HDL-C、LDL-C测试盒(南京建成生物工程研究所,20190221~20190225)。小鼠胰岛素(INS)酶联免疫吸附测定试剂盒、小鼠极低密度脂蛋白(VLD-L)酶联免疫试剂盒(武汉伊莱瑞特生物科技股份有限公司,产品批号:GYV3LWB6SH)。
1.2 实验动物
SPF级昆明小鼠140只,雌雄各半,3~4 w龄,体重18~22 g,购于湖南斯莱克景达实验动物有限公司(SCXK(湘)2016-0002)。小鼠饲养于通风良好、相对湿度为50%~60%、室温为23~25 ℃、严格12 h光照12 h黑暗的标准化饲养房。
1.3 仪器
电子天平(瑞士Mettler toledo),旋转蒸发仪(德国Heidolph),冷冻干燥机(德国Christ)。罗氏卓越精采型血糖仪(德国罗氏诊断有限公司,200687),罗氏卓越精采型血糖试纸(葡萄糖脱氢酶法)(Roche Diabetcs Care Gmbh,477232),罗氏血糖仪一次性采血针(苏州施莱医疗器械有限公司,E3023)。高速冷冻离心机、移液枪(德国eppendorf)。制冰机、-80℃冰箱(日本松下),雷磁PHS-3E计(上海仪电科学仪器股份有限公司)。全波长酶标仪Epoch 2,(美国Biotek)。石蜡切片机(Thermo),组织包埋机,组织脱水机(意大利Diapath S. p. A.)。
2 方法
2.1 药材提取与分离
取过40目筛的青钱柳叶粉末1 kg,按前期优化所得的双水相提取工艺:无水乙醇质量分数33.00%,盐的质量分数15.00%,超声时间52 min,液料比33:1,提取过滤,分离上下相,上相除盐;然后用石油醚萃取,弃取石油醚部位,水层用乙酸乙酯萃取多次,乙酸乙酯部位浓缩、干燥即得青钱柳叶粗提物。
2.2 糖尿病小鼠造模与分组治疗
小鼠经过3 d适应期后,随机对小鼠进行预分组,取12只小鼠作为空白组(BG),饲喂普通饲料。剩余小鼠全部饲喂高脂高糖饲料,喂养1个月后,小鼠禁食12 h,按体重100 mg/kg 剂量予腹腔注射链佐霉素(STZ)溶液(pH4.5,柠檬酸钠缓冲液配制,现配现用),空白组小鼠注射等量柠檬酸钠缓冲液,注射完毕后立刻恢复小鼠饮食,注射72 h后尾静脉采血测定空腹血糖值,空腹血糖≥11.1 mmol/L且连续多食、多饮、多尿症状的小鼠即为造模成功。
取造模成功的小鼠随机分为糖尿病模型组(MG)、二甲双胍组(PG)、青钱柳叶提取物高剂量组(HDG)、中剂量组(MDG)、低剂量组(LDG),每组12只。高、中、低剂量组分别用青钱柳叶提取物600、400、200 mg/kg剂量灌胃;二甲双胍组以二甲双胍200 mg/kg剂量灌胃;模型组和空白组灌胃等剂量的超纯水。各组按0.2 mL/10g灌胃给药,每天灌胃1次,连续14 d。
2.3 样本采集与处理
每天观察各组小鼠精神状态、反应灵敏度、毛色、饮食、饮水、尿量等的改变,定时称量小鼠体重。造模前、灌胃7 d、灌胃14 d,测定空腹血糖。小鼠灌胃14 d后,禁食不禁水12 h,摘眼球取血。取完血后,小鼠断颈处死,解剖,观察其体内主要脏器发育情况。取肝脏、肾脏、脾脏、胰腺,剔除脂肪、筋膜,用生理盐水洗涤,滤纸吸干水分后称重,计算脏器指数。脏器指数=脏器质量/体质量。全血凝固后在4 ℃,3500 r/min条件下离心15 min,吸取上清液,置于-80℃冰箱保存待测。血清中INS、T-CHO、TG、HDL-C、LDL-C、VLDL-C含量的测定按照试剂盒说明进行操作,然后用酶标仪进行测定。
将小鼠的一部分肝脏、胰腺组织固定在4%多聚甲醛中,24 h后常规洗涤、脱水、石蜡包埋。对载玻片编号并对包埋组织进行切片,片厚5 µm,浸入二甲苯两次各5 min、无水乙醇两次各3 min、95%、80%乙醇各3 min,接着用流水充分冲洗。然后用苏木精液染色3~5 min,流水洗去载玻片上的多余染液,1%盐酸乙醇分化10 s反蓝,流水冲洗3~5 min。再用1%曙红液染色1~5 min,充分水洗。常规梯度乙醇脱水,80%乙醇3~5 s,95%乙醇两次5~10 s、1~3 min,100%乙醇两次各1~3 min。松节油透明两次各2 min,中性树胶封固,光镜下观察小鼠肝脏、胰腺的病理变化。
所有切片均由病理科医师盲法读片,对肝细胞变性和炎性细胞浸润程度分别进行分级评分。肝细胞水肿变性程度判断标准[20]见表1,肝炎症活动评分标准[21]见表2,两个评分标准参照原文献稍作修改。肝炎症活动分为汇管区(P)、小叶内(L)、碎屑坏死(PN)及桥接坏死(BN)4项,每项依病变程度为1、2、3、4分,计分公式为P+L+2(PN+BN),因为BN和PN的严重度与预后直接有关,故其计分2倍于其他病变,在实际应用中,对二者依其轻、中、重程度直接计以2、6、8分,总分为4项计分之和。

表1 肝细胞水肿变性程度评分表

表2 肝炎症评分表
2.5 数据统计与分析

3 结果
3.1 对小鼠体重、空腹血糖的影响
小鼠饲喂高脂饲料后体重快速增加。造模成功后,空白组小鼠的形态正常、毛色光滑、动作敏捷、好动、精神状态良好,体重仍然呈增长状态;而模型组小鼠则变得消瘦、体毛松散无光泽、尾巴湿冷、活动度低常静卧。造模成功后,每天更换垫料,发现糖尿病小鼠垫料明显不及空白组的干燥洁净;每天更换等量饮水,发现糖尿病小鼠饮水比空白组小鼠多。青钱柳叶提取物低、中、高剂量组的小鼠体重呈现下降趋势。灌胃两周后模型组和空白组小鼠体重存在差异(<0.05),青钱柳叶提取物中剂量组小鼠体重略有增加(<0.05),空白组与二甲双胍、青钱柳叶低中高组小鼠体重有显著差异(<0.01)。结果提示,青钱柳叶提取物在一定剂量下能改善糖尿病小鼠体重减轻的症状。小鼠体重变化见表3和图1。
小鼠在适应性喂养时,空腹血糖都在正常范围,高脂饲料喂养一个月后,有少数小鼠的空腹血糖值已经超过11.1 mmol/L。腹腔注射STZ后,部分小鼠的血糖非常高甚至超过血糖仪的测量上限High(33.3 mmol/L),在计算中为方便数值化计算将High值计为33.4 mmol/L。模型组在造模后、灌胃2周后的空腹血糖和空白组相比都存在显著差异,表明模型组高血糖状态稳定。灌胃2周后模型组和青钱柳提取物低剂量组具有差异(<0.05),提示青钱柳叶提取物在一定剂量下有降低糖尿病小鼠空腹血糖的作用。青钱柳叶提取物对糖尿病小鼠的影响见表4和图2。

表3 小鼠体重
=12,与空白组比较:*<0.05,**<0.01;与模型组比较:#<0.05,##<0.01
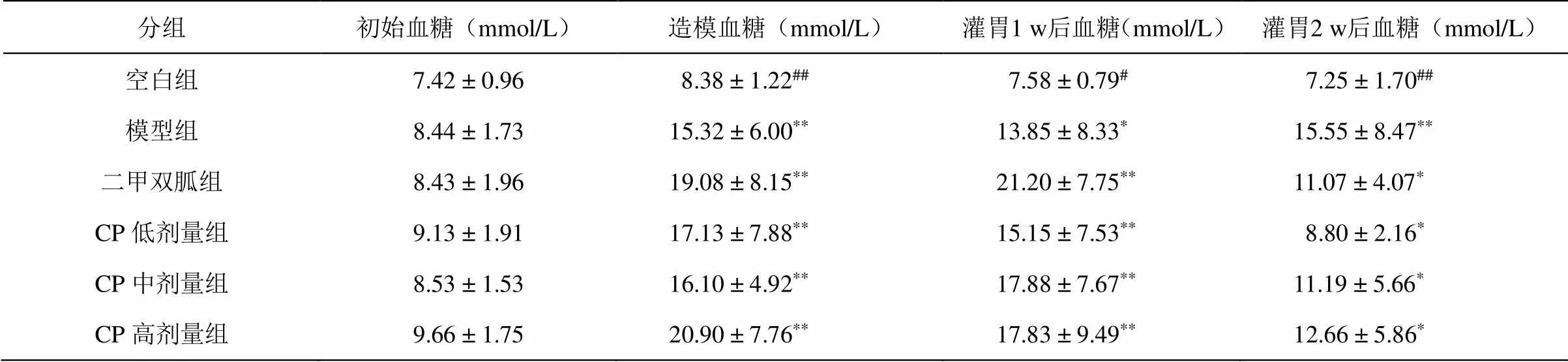
表4 小鼠血糖
=12,与空白组比较:*<0.05,**<0.01;与模型组比较:#<0.05,##<0.01

图1 小鼠体重

图2 小鼠血糖含量
3.2 对小鼠血清胰岛素的影响
通过标准品的浓度和OD值绘出四参数逻辑函数的标准曲线,代入样本OD值求得胰岛素含量。模型组、阳性组、低剂量组小鼠的血清胰岛素含量明显高于空白组(<0.01),中剂量组高于模型组(<0.05),这些糖尿病小鼠出现了胰岛素抵抗。灌胃两周,青钱柳叶提取物高剂量组小鼠的血清胰岛素与模型组相比含量显著下降(<0.01),接近空白组胰岛素水平。青钱柳叶提取物对小鼠血清胰岛素的影响如表5和图3所示。

表5 青钱柳提取物对小鼠血清胰岛素、各血脂指标的影响
=12,与空白组比较:*<0.05,**<0.01;与模型组比较:#<0.05,##<0.01;与阳性组比较,^<0.05,^^<0.01

图3 小鼠血清INS、VLDL-C
3.3 对小鼠血脂的影响
从表5,图3、4可知,与空白组相比,糖尿病小鼠血清中总胆固醇、甘油三酯、低密度脂蛋白、极低密度脂蛋白含量明显升高(<0.01),高密度脂蛋白有所升高(<0.05)。与模型组相比,二甲双胍组小鼠血清的T-CHO、TG和LDL-C显著降低,HDL-C升高;青钱柳提取物低剂量组血清中T-CHO、LDL-C水平显著降低(<0.01),TG降低(<0.05),HDL-C显著升高(<0.01);青钱柳提取物中剂量组T-CHO、TG、LDL-C水平显著降低(<0.01),HDL-C显著升高(<0.01);青钱柳提取物高剂量组TG显著降低(<0.01),T-CHO、LDL-C水平降低(<0.05),HDL-C显著升高(<0.01)。

图4 小鼠血清T-CHO、TG、LDLC和HDLC比较
3.4 脏器指数
脏器指数指实验动物器官湿质量与体质量的比例,主要用于反映药物对内脏器官的损害而导致内脏器官质量变化的一个客观指标。与空白组相比,模型组小鼠的肝脏、脾脏脏器指数具有差异(<0.05),脾脏差异显著(<0.01),这提示模型组小鼠的内脏可能已经受到损伤。与模型组相比,二甲双胍组和青钱柳高剂量组小鼠的脾脏、肾脏指数有明显差异(<0.01),胰腺指数有显著性差异(<0.05);低剂量和中剂量组的肝脏、脾脏、肾脏指数都有明显的差异(<0.01),中剂量组小鼠胰腺与模型组差异明显(<0.01)。与阳性组比较,青钱柳提取物剂量组,除了肝脏系数有差异,其余三个指数无统计学差异,推测青钱柳提取物有保护糖尿病小鼠肝脏、胰腺、肾脏和胰腺的作用,青钱柳叶有减少2型糖尿病内脏并发症的可能。脏器指数如表6所示。

表6 脏器指数
=12,与空白组比较:*<0.05,**<0.01;与模型组比较:#<0.05,##<0.01;与阳性组比较,^<0.05,^^<0.01
3.5 小鼠肝脏、胰腺病理形态学分析
观察小鼠肝脏外观形态可知,空白组小鼠肝脏质地柔软而有弹性,颜色深红,表面光滑,边缘锐利;糖尿病小鼠肝脏体积增大,质地较硬,颜色粉红,表明有白色斑点,边缘变钝;二甲双胍组和青钱柳叶提取物组肝脏变化较模型组有所减轻。观察肝脏病理学切片,空白组小鼠(图5 BG)肝细胞结构完整,细胞核大且呈圆形或椭圆形,位于细胞中央,胞质丰富,细胞排列整齐,边界清晰。模型组小鼠肝细胞严重水肿,汇管区和小叶内出现一些炎细胞(图5 MG),外形不规则,结构模糊,胞核固缩,排列混乱,界限不清;给药组与模型组相比,胞核固缩程度较轻,细胞水肿程度较轻,排列较整齐,肝脏损伤程度减轻,说明青钱柳叶提取物对糖尿病小鼠的肝脏有一定的保护作用。肝脏评分结果见表7。
观察小鼠胰腺外观形态可知,空白组小鼠胰腺组织边界清晰,表面光滑,质地致密,颜色均匀,切割易分离、无粘连;糖尿病模型组小鼠胰腺出现水肿现象,质地糖稀,边界不清晰,颜色变暗,与表面脂肪组织粘连、切割时不易分离;二甲双胍组和青钱柳叶提取物组小鼠的胰腺形态变化较轻。观察小鼠胰腺病理切片,空白组(图6 BG)胰岛细胞数量丰富,分布均匀,呈圆形、椭圆形或索状,细胞核染色质清晰,胞浆丰富,边界清晰,排列整齐,未见明显细胞肿胀、坏死和炎细胞浸润。模型组胰岛数目明显减少,而且胰岛细胞面积变得很小,形状不规则,排列紊乱,可见细胞空泡变性,有少量淋巴细胞浸润。青钱柳叶提取物低、中、高剂量组和二甲双胍组的胰岛细胞较多,如在青钱柳叶提取物低剂量组的一个视野中(图6 LDG)可以看到两个胰岛细胞,中剂量组(图6 MDG)可以看到4个胰岛细胞。可见胰岛结构比较完整,排列较整齐,由此表明青钱柳叶提取物能够保护小鼠胰腺形态,甚至逆转胰岛β细胞的损伤。由于糖尿病小鼠胰腺病理切片评分较少,暂统计了胰岛个数,后可用专门软件计算各个胰岛细胞面积作为考察指标之一。

表7 肝脏、胰腺切片评分
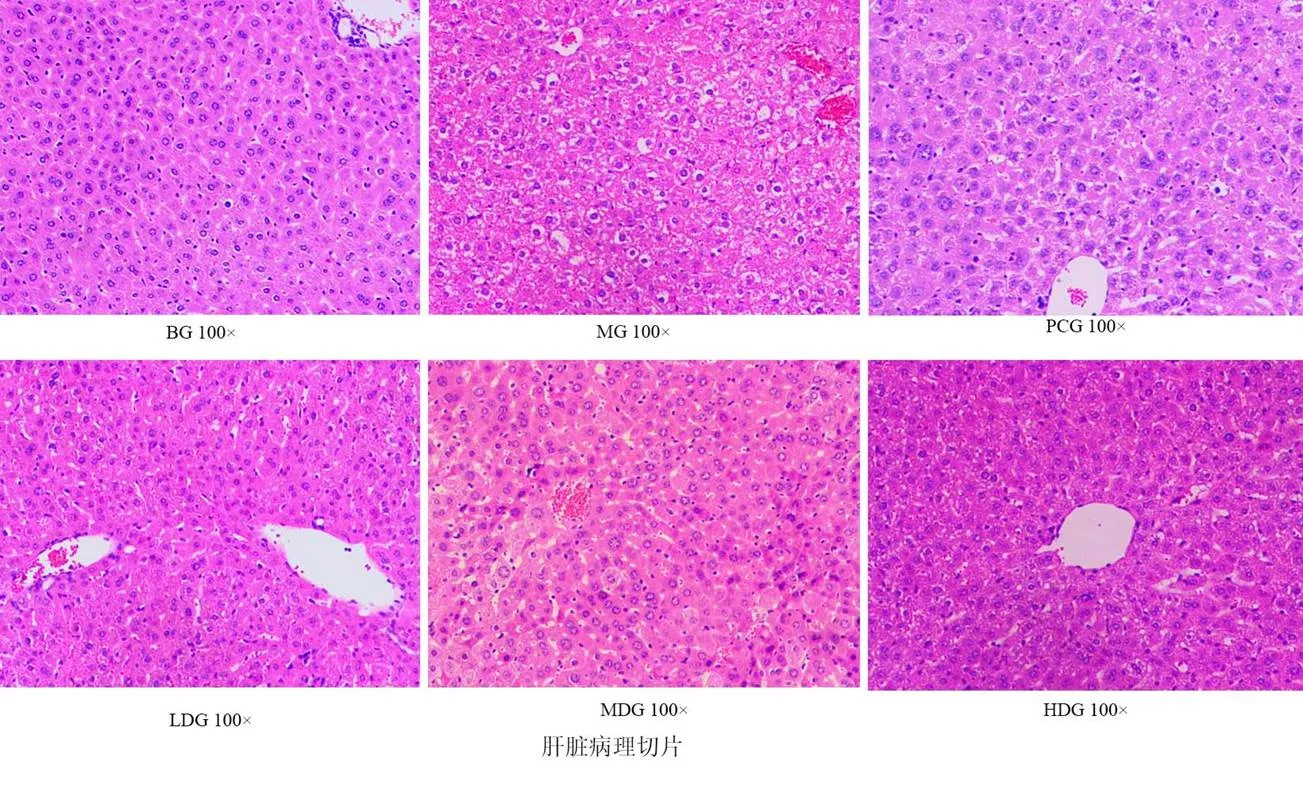
图5 小鼠肝脏切片

图6 小鼠胰腺切片
4 讨论
用高脂饲料与STZ联合诱导的方法建立了2型糖尿病模型,通过对2型糖尿病小鼠分组予以高、中、低剂量的青钱柳叶的双水相提取物灌胃,研究其对2型糖尿病的干预作用。影响STZ造模的因素很多,如STZ给药剂量、推注时间、STZ批次、动物个体敏感性、病程长短、生长环境,小鼠胰岛β细胞受损程度不一,对同一治疗产生的效果可能不一。在该试验中,灌胃给药两周后,虽然给药组小鼠的体重和空白组还是存在显著差异,但能观察到给药组小鼠的体重呈回升趋势。糖尿病小鼠的空腹血糖值与空白组小鼠存在显著差异,但由统计数据可判断给药后小鼠血糖值呈下降趋势,或由于血糖值太高,甚至实验中出现几只小鼠血糖超过血糖仪阈值(33.3 mmol/L),中药见效普遍较缓,此处应延长给药时间,考察其降血糖效果。青钱柳叶经过乙醇/无机盐双水相体系提取后,总黄酮提取率达到3.00%,黄酮进行富集后,可以认为青钱柳叶粗提物中发挥药理作用的大多为黄酮类成分。检测小鼠血清中的血脂指标,可见模型组与空白组相比较,TG、T-CHO、LDL-C和VLDL-C上升幅度很大,HDL-C明显降低。给药两周后,给药组和模型组的血脂含量存在显著差异,表明青钱柳叶双水相提取物发挥了降血脂的作用。
胰岛素是机体内唯一降低血糖的激素,同时促进糖原、脂肪、蛋白质合成,STZ破坏胰岛β细胞,引起胰岛素分泌减少,模型组、二甲双胍组、青钱柳叶提取物低剂量组小鼠出现了胰岛素抵抗,中剂量组小鼠胰岛素也显示出和空白组有差异。模型组小鼠胰岛素和青钱柳叶双水相提取物高剂量组存在显著差异,提示高剂量组能够改善胰岛素抵抗。对各组小鼠的肝脏和胰腺病理切片进行观察,直接可见模型组各小鼠肝细胞出现不同程度水肿、汇管区或小叶内出现不同量炎症细胞,给药组小鼠水肿和炎症的程度较轻,说明青钱柳叶双水相提取物对肝脏有保护作用。模型组小鼠的胰岛细胞较空白组数量骤减,面积变小,给药组小鼠的胰岛细胞较模型组多且面积较大,说明给药后胰岛细胞呈现不同程度逆转。我们的实验指标表明,青钱柳叶双水相提取物对糖尿病小鼠有降低空腹血糖、降低胰岛素、降血脂的作用,其作用机制待后期免疫组化进行更深入研究。
[1] International Diabetes Federation. Press Release: New IDF figures show continued increase indiabetes across the globe, reiterating the need for urgent action[M]. IDF atlas qth edition and other resources, 2017: 14.
[2] 董彦会,王政和,杨忠平,等. 中国儿童青少年糖尿病患病率Meta分析[J].中国学校卫生,2016, 37(11): 1676-1679.
[3] 徐奚如,王旭. 中国儿童及青少年糖尿病发病现状与防治策略[J]. 山东医药, 2011,51: 98-99.
[4] 唐佳慧,胡欣,戚燕. 农村老年糖尿病患者自我管理能力的质性研究[J]. 井冈山大学学报:自然科学版, 2015,36(06):88-91.
[5] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京:科学出版社, 1979: 18-19.
[6] 张小芳,段小群,卢曦,等. 青钱柳多糖对糖尿病小鼠血糖水平和胰腺组织形态的影响[J]. 华夏中医, 2010, 23(1): 15-17.
[7] 张小芳. 广西青钱柳降血糖有效成分及作用机制的研究[D]. 桂林:桂林医学院. 2010.
[8] LI L, ZHAO L, XIE M Y, et al. Bioactivity of reducing blood sugar and elements speciation analysis of the extract from(Batal.) Iljinsk leaves [J]. Journal of Xiamen University (Natural Science),2003,42(1): 73-77.
[9] 杨武英,上官新晨,徐明生,等. 青钱柳黄酮对α-葡萄糖苷酶活性及小鼠血糖的影响[J]. 营养学报, 2007, 29(5) : 507-509.
[10] 沈兵,赵巍,欧文斌,等. 青钱柳中α-葡萄糖苷酶抑制剂的研究[J]. 浙江大学学报:农业与生命科学版, 2013, 40(3): 275-280.
[11] 易醒,谢明勇,辜清,等. 青钱柳对胆固醇调节作用的初步研究[J]. 中国商办工业, 2000(4): 51-52.
[12] 王晓敏,舒任庚,蔡永红,等. 青钱柳水提液对糖尿病小鼠胰岛细胞的保护作用[J]. 时珍国医国药, 2010, 21(12): 3146-3147.
[13] FU X, YIN Z P, SHENGGUAN X C, et al. Stimulation of glucose consumption in 3T3-L1 adipocytes by triterpenoids fromleaves[J]. Mordern Food Science and Technology. 2014, 30(80):31-37.
[14] 李磊,谢明勇,孙振华,等. 保健食品青钱柳中稀土元素的组成及溶出特性[J]. 中国畜产与食品, 2000, 7(3): 101-102.
[15] 戈延茹,曹恒杰. 双水相萃取技术及其在药物提取分离中的应用近况[J]. 中国现代应用药学杂志, 2009, 26(8): 623-627.
[16] Albertsson P A. Chromatography and partition of cells and cell fragments [J]. Nature, 1956, 177(4513): 771-774.
[17] Asenjo J A, Andrews B A. Aqueous two-phase systems for protein separation: Phase separation and applications [J]. J Chromatogy A, 2012, 1238: 1-10.
[18] Federico R R, Jorge B, Oscar A, et al. Aqueous two-phase affinity partitioning systems: Current applications and trends [J]. J Chromatogy A, 2012, 1244: 1-13.
[19] Aguilar O, Rito-Palomares M. Aqueous two-phase systems strategies for the recovery and characterization of biological products from plants [J]. J Sci Food Agric , 2010, 90(9): 1385-1392.
[20] Diehl M A, Goodman Z, Ishak K G. Alcohollike liver disease in nonalcoholics. A clinical and histologic comparison with alcohol-induced liver injury[J]. Gastroenterology, 1988, 95(4): 1056-1062.
[21] 于淼. 解毒通络调肝法干预实验性2型糖尿病胰岛素抵抗大鼠肝内炎症并发症发病途径的实验研究[D]. 长春:长春中医药大学. 2007.
HYPOGLYCEMIC EFFECT OF EXTRACTS FROM(BATAI.) ILJINSKAJA LEAVES
TANG Mei1, YANG Shen-xiang2,*ZHAO Li-chun1
(1. School of Pharmacy, Guangxi University of Chinese Medicine, Nanning, Guangxi 530222, China; 2. School of Science, Zhejiang A & F University, Hangzhou, Zhejiang 311300, China)
The effects of aqueous two-phase extracts of(Batai.) Iljinskaja leavesondiabetes mellitus mice were studied.The mice were fed with high fat diet, then intraperitoneal injected streptozotocin (STZ) to establish the T2DM animal models. After two weeks, the contents of insulin (INS), total cholesterol (T-CHO), serum triglyceride (TG), high density lipoprotein (HDL-C), low density lipoprotein (LDL-C) and very low density lipoprotein (VLDL-C) were measured. The changes of liver and pancreatic tissues pathology in experimental diabetic mice were observed by the immunohistochemical method.Middle dose group ofleaves aqueous two-phase extracts could significantly improve the loss of diabetic mice weights (<0.01). Low dose group lowered the fasting blood glucose and high dose group lowered INS (<0.05).leaves aqueous two-phase extracts could reduce the contents of T-CHO, TG, LDL-C and increased HDL-C. T2DM mice hepatocytes showed different degrees of edema and degeneration, the portal areas and lobule occurred inflammatory cell infiltration. The liver changes of mice administrated byleaves extracts and metformin hydrochloride alleviated compared with the model group. Compared with normal mice, there were fewer islets, irregular morphology, uneven cell distribution in the islets of T2DM mice.leaves aqueous two-phase extracts possessed lowering fasting blood glucose, lowering lipid, improving insulin resistance and protective effects on STZ diabetic mice, while its specific mechanisms were worth for further investigation.
(Batai.) Iljinskaja leaves; aqueous two-phase extracts; hypoglycemic effect
R285.5
A
10.3969/j.issn.1674-8085.2020.05.015
1674-8085(2020)05-0083-09
2020-02-12;
2020-04-27
广西一流学科项目(05019018A5);“岐黄工程”创新研究团队项目(2018002);广西中医药大学2018年自治区级硕士研究生科研创新项目(YCSW2018169)
唐 梅(1993-),女,广西桂林人,硕士研究生,主要从事中药化学成分提取及活性研究(E-mail: GXtangmei@163.com);
杨胜祥(1982-),男,安徽安庆人,副教授,主要从事天然产物化学生物学研究(E-mail:shengxiangyang2000@163.com);
*赵立春(1980-),男,吉林长春人,研究员,博士,硕士生导师,主要从事中药化学成分提取及活性研究(E-mail:hyzlc@126.com).
