扬子鳄β防御素基因的血液表达谱及饲养密度对防御素基因表达的影响
2020-11-27陆瑶方盛国
陆瑶,方盛国
(浙江大学生命科学学院,生命系统稳态与保护教育部重点实验室/国家濒危野生动植物种质基因保护中心,杭州310058)
扬子鳄(Alligator sinensis)是我国特有的一种鳄类动物,也是世界上现存25种鳄类中最濒危的物种之一[1-2]。受到过度捕猎和栖息地减少的双重打击,扬子鳄仍处于极度濒危的状态,野外种群数量不断下降[1,3]。我国于20 世纪80 年代在安徽省宣城市和浙江省长兴县等地陆续建立了扬子鳄保护区,经过近40年的人工繁育,扬子鳄圈养种群不断壮大,为扬子鳄野生种群的重建和复壮提供了丰富的资源[4-5]。
然而,对有关圈养动物的研究表明,在人工饲养条件下动物面临着一系列来自于环境的挑战。人工光照、不适宜的环境温度、非自然社群中的社会互动等都可能成为压力源,影响个体对环境的适应能力[6]。其中,饲养密度是影响鳄类饲养的一个重要因素,饲养密度过高会对动物的生长、繁殖和存活造成不利影响。在相对较高的饲养密度下,扬子鳄、宽吻凯门鳄、湾鳄等鳄类幼鳄的生长速率减慢[7-9];并且,密河鳄的幼鳄和成鳄血浆中皮质酮的水平显著升高,原因是高饲养密度环境会刺激下丘脑-垂体-肾上腺轴,引起动物强烈的应激反应[10-11]。在家鸡、鱼类等动物的相关研究中还发现,饲养密度过高会影响机体的免疫系统功能和免疫状态,比如导致淋巴器官发育缓慢,由于免疫反应减弱使得对病原体的抵抗能力下降,免疫器官中先天免疫基因的表达水平发生变化等[12-15]。
在脊椎动物中,应激和免疫是十分重要的生理过程,使得机体能快速对环境中的有害因素如潜在的致病菌等产生反应。扬子鳄为营半水生生活的爬行动物,生活在充满潜在致病菌的水生环境中,先天免疫系统是其抵抗微生物入侵的第一道防线。而动物的先天免疫系统包括各种能非特异性识别并作用于病原体的免疫细胞和抗菌分子,防御素就是其中一类重要的抗菌物质[16]。防御素由18~45个氨基酸残基组成,是一类富含阳离子和半胱氨酸的小分子多肽[17]。防御素具有抗菌、趋化、免疫调节等作用,保证机体在感染病原体前保持强大的防御能力,并在感染后能迅速引发一系列免疫反应,在动物的先天免疫中发挥着重要的作用[18]。防御素在参与宿主免疫的细胞和组织中广泛表达,且在脾、中性粒细胞、巨噬细胞等免疫器官和细胞中具有较高的表达水平[18]。并且,防御素的表达受多种压力因素的调控,细菌、脂多糖、白细胞介素等外源因素均可引起防御素表达水平的变化[19]。
扬子鳄圈养种群长期生活在人工环境中,更多受到来自环境的压力,进一步了解其免疫状态可为扬子鳄的保护提供更多信息。因此,本研究利用反转录荧光定量聚合酶链式反应(reverse transcription quantitative polymerase chain reaction, RT-qPCR)技术检测扬子鳄七龄鳄群体血液中β防御素基因的表达情况,并进一步探究饲养密度对扬子鳄圈养群体β防御素表达的影响,为扬子鳄种群的管理和保护提供参考。
1 材料与方法
1.1 研究对象及试验材料
本研究于2018 年7 月在浙江省长兴县扬子鳄省级自然保护区内开展,研究对象为2011年出生的扬子鳄七龄鳄群体(n=98),分别饲养于A 和B 2 个饲养池中。通过测量A和B 2个方形饲养池的长宽计算其面积和鳄鱼的饲养密度;用手指触摸扬子鳄的泄殖腔,根据泄殖腔背壁上方有无棒状交媾器判断扬子鳄的性别[5]。一共采集了41个扬子鳄个体的血液样品用于后续试验,并利用保护区内因打斗而死亡的1头扬子鳄个体的冻存组织样品(心、肝、脑、肺、肾、胃、小肠、肌肉)的RNA 进行引物设计和筛选。本研究的试验对象和样品信息如表1所示。

表1 扬子鳄七龄鳄群体特征和样本信息Table 1 Information of seven-year-old Chinese alligator populations and samples
1.2 主要试剂
TRIzol试剂购自美国Invitrogen公司;反转录试剂盒[PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)]、TB GreenTMPremix ExTaqTM荧光染料、pMD18-T载体克隆试剂盒、EcoRⅠ酶等购自日本TaKaRa 公司;PCR 扩增试剂2×Taq主混料、GRgreenⅡ核酸染料、薄型琼脂糖凝胶DNA回收试剂盒购于上海捷瑞生物工程有限公司;DH5α感受态细胞购于天根生化科技(北京)有限公司;QIAprep Spin质粒小量提取试剂盒购于德国QIAGEN公司。
1.3 血液和组织的RNA 提取及cDNA 合成
血液和组织样品总RNA 均按照TRIzol 法进行提取,但第1步细胞裂解的方法不同:前者为将新鲜血液直接加入到TRIzol 试剂中并剧烈振荡约30 min,至血细胞完全裂解;后者为将组织样品在液氮中快速研磨成粉末,随后转移至装有TRIzol试剂的离心管中振荡约10 min。提取总RNA 后进行琼脂糖凝胶电泳检测,并使用超微量分光光度计测定RNA的质量浓度和纯度。
选择质量浓度在200 ng/µL 以上、D(260 nm)/D(280 nm)在1.8~2.0 之间的RNA 样品为模板,按照反转录试剂盒说明书合成cDNA,每20 µL 反转录体系中加入总量为1 000 ng的RNA。
1.4 引物设计与筛选
根据NCBI(https://www.ncbi.nlm.nih.gov/)中19个扬子鳄β防御素基因的cDNA 序列(GenBank登录号:MG519833~MG519852,不包括假基因AsBD103p),利用软件Primer Premier 5.0 分别设计多对荧光定量聚合酶链式反应(quantitative polymerase chain reaction,qPCR)引物,由上海捷瑞生物工程公司合成。
1.4.1 PCR 扩增
如果在PCR实验中未能扩增出条带,可能是因为该基因在组织中没有表达或者是该引物不合适。所以,为了尽可能排除引物自身问题导致的PCR扩增失败,并且尽可能多地筛选出符合标准的引物,本实验将不同的血液cDNA 和组织cDNA 进行混合,用于之后的实验。
PCR 反应体系:2×Taq主混合液5µL,无RNase ddH2O 3 µL,cDNA 1 µL,上、下游引物各0.5 µL。PCR 反应条件:94 ℃预变性5 min:94 ℃变性40 s,在最适退火温度下退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸7 min。其中,设置退火温度的温度梯度,得到最亮的扩增条带所对应的温度为最适退火温度。
使用DNA 回收试剂盒回收PCR 阳性产物,并连接到pMD18-T载体上,再转化到DH5α感受态细胞中,然后使用含氨苄的选择性固体培养基进行培养;筛选出阳性克隆并进行摇菌,送菌液至北京擎科生物科技有限公司杭州分公司进行测序。将测序结果在NCBI 上与目的片段序列进行Blast 比对,确定PCR扩增的片段是否为目的片段。
1.4.2 qPCR 扩增
初步确定引物之后进行qPCR实验,qPCR扩增体系:TB GreenTMPremix ExTaqⅡ5 µL,无RNase ddH2O 3 µL,cDNA 1 µL,上、下游引物各0.5 µL。qPCR扩增条件:95 ℃预变性3 min,95 ℃变性10 s,在最适退火温度下退火30 s,39 个循环。扩增反应完成后,每5 s 升温0.5 ℃,从65 ℃升温到95 ℃,得到熔解曲线。其中,设置退火温度的温度梯度,阈值(CT)最小值对应的退火温度为最适退火温度;熔解曲线要求为单一尖锐峰。对于满足上述条件的qPCR引物,再次扩大培养含有阳性克隆的菌液,使得细胞浓度约为3×109mL-1。根据QIAGEN质粒小提试剂盒说明书提取质粒,使用EcoRⅠ酶将环状质粒酶切为线性质粒,得到质粒DNA标准品。根据质粒DNA浓度计算质粒拷贝数,计算公式为:
质粒拷贝数/(copies/µL)=6.02×1023/(copies/mol)×10-9×质粒质量浓度/(ng/µL)÷(DNA长度/bp×660).
最后,使用Tris-乙二胺四乙酸(TE)缓冲液将质粒DNA稀释10倍,得到拷贝数为102~108共7个梯度的质粒标准品,通过制作标准曲线得到引物的扩增效率E和相关系数r2,要求E为90%~110%,r2>0.99。
1.5 扬子鳄血液中β防御素基因表达情况的检测
利用筛选出的多个β防御素基因引物对扬子鳄七龄鳄群体中41个个体的血液RNA样品进行qPCR检测,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)为内参基因,其qPCR 引物参照TANG 等[20]设计的引物。每次实验均设置阴性对照,每个样品设置3个重复。
通过qPCR实验得到的CT值和熔解曲线判断基因的表达情况,如该基因扩增过程中的熔解曲线与绘制标准曲线时的熔解曲线不同,说明扩增的片段不是目的片段,从而认定该基因在样品中未表达。如该基因有表达,则重复实验3次(要求标准偏差<0.5),取CT均值进行后续的相对定量表达分析。
1.6 数据统计与分析
首先,通过计算目的基因与内参基因的差值ΔCT判断各目的基因之间的相对表达情况:ΔCT越小,则说明基因的相对表达量较高。再以某个扬子鳄个体的基因表达量作为参照计算出2-△△CT值,得到扬子鳄不同个体间基因的相对表达倍数。然后,利用软件SPSS 19.0进行统计分析:采用Kolmogorov-Smirnov 检验和Pearson 相关系数分析各表达基因之间表达水平(ΔCT)的相关性;采用Levene检验、独立样本T检验和Mann-WhitneyU检验分析不同性别、不同饲养密度的2 个群体中各防御素基因的相对表达倍数(2-△△CT)之间的差异,P<0.05表示差异有统计学意义。
图1 扬子鳄血液(A)和组织(B)总RNA的电泳结果Fig.1 Electrophoretogram results of total RNA in blood(A)and tissues(B)of Chinese alli gator
2 结果与分析
2.1 血液和组织总RNA 的提取结果
血液和组织的RNA经电泳检测,清晰可见28S和18S 2种条带(图1),说明RNA样品质量良好,可用于后续的实验。
2.2 qPCR 引物筛选
在PCR实验中,一共设计出10个β防御素基因的引物,均能扩增出清晰的条带并且单个阳性克隆的测序结果与目的片段序列一致。但是,在进一步的qPCR实验中发现,AsBD106α基因引物的熔解曲线不是单一尖锐峰,很可能是由于AsBD106α基因与AsBD106β基因cDNA 序列高度相似(93%),在PCR扩增过程中很难将两者区分开。最终,成功设计筛选出9 个β防御素基因的qPCR 引物,所有的qPCR引物(包括内参基因GAPDH)的信息见表2。
2.3 扬子鳄β 防御素基因的血液表达谱
经qPCR检测,在扬子鳄群体的血液中表达的β防御素基因只有AsBD5和AsBD8,其余基因均未表达。其中,AsBD8与内参基因GAPDH的差值ΔCT小于AsBD5的ΔCT值,说明在扬子鳄血液中AsBD8的表达量高于AsBD5。并且,每个个体AsBD5和AsBD8的表达量之间存在较显著的正相关性(r=0.576,P<0.05)。而 在 不 同 个 体 间,AsBD5和AsBD8的表达水平均具有一定的差异;其中AsBD8表达水平的个体差异很大,不同个体间的相对表达量差异可达20倍以上(图2)。
2.4 性别和饲养密度对扬子鳄防御素基因表达的影响
雌性和雄性扬子鳄血液中防御素基因AsBD5和AsBD8的表达水平无显著性差异(图3A),但是2个不同饲养密度的扬子鳄群体间AsBD5和AsBD8基因的表达水平均存在极显著差异(P<0.001;图3B)。其中,生活在较高饲养密度饲养池B(0.55 头/m2)中的扬子鳄群体防御素的表达水平显著高于饲养池A(0.30 头/m2),说明这2 个群体间的免疫状态存在显著差异,饲养密度较高的群体具有更高的免疫水平。
3 讨论
本研究通过RT-qPCR 对扬子鳄血液中β防御素基因的表达情况进行检测,发现了在扬子鳄血液中表达的2 种防御素基因AsBD5和AsBD8,并且AsBD5和AsBD8的表达量在个体之间存在显著的正相关性。已知AsBD5和AsBD8是扬子鳄基因组上相邻的2个基因,表明这2个功能相关的基因之间可能存在共同进化的现象[21]。而在不同个体间,AsBD5和AsBD8表达水平的差异很可能与动物的免疫状态、家系等有关[22]。结合本实验之前关于扬子鳄β防御素基因组织表达的研究,可对扬子鳄防御素基因家族的表达情况有一个更加全面的了解。AsBD5和AsBD8是与鸟类β防御素基因同源的2个直系基因,在扬子鳄的血液、脾和结肠等免疫相关组织中均呈现出较高的表达水平,说明这2 个基因在扬子鳄的先天免疫系统中发挥着重要的作用[20]。
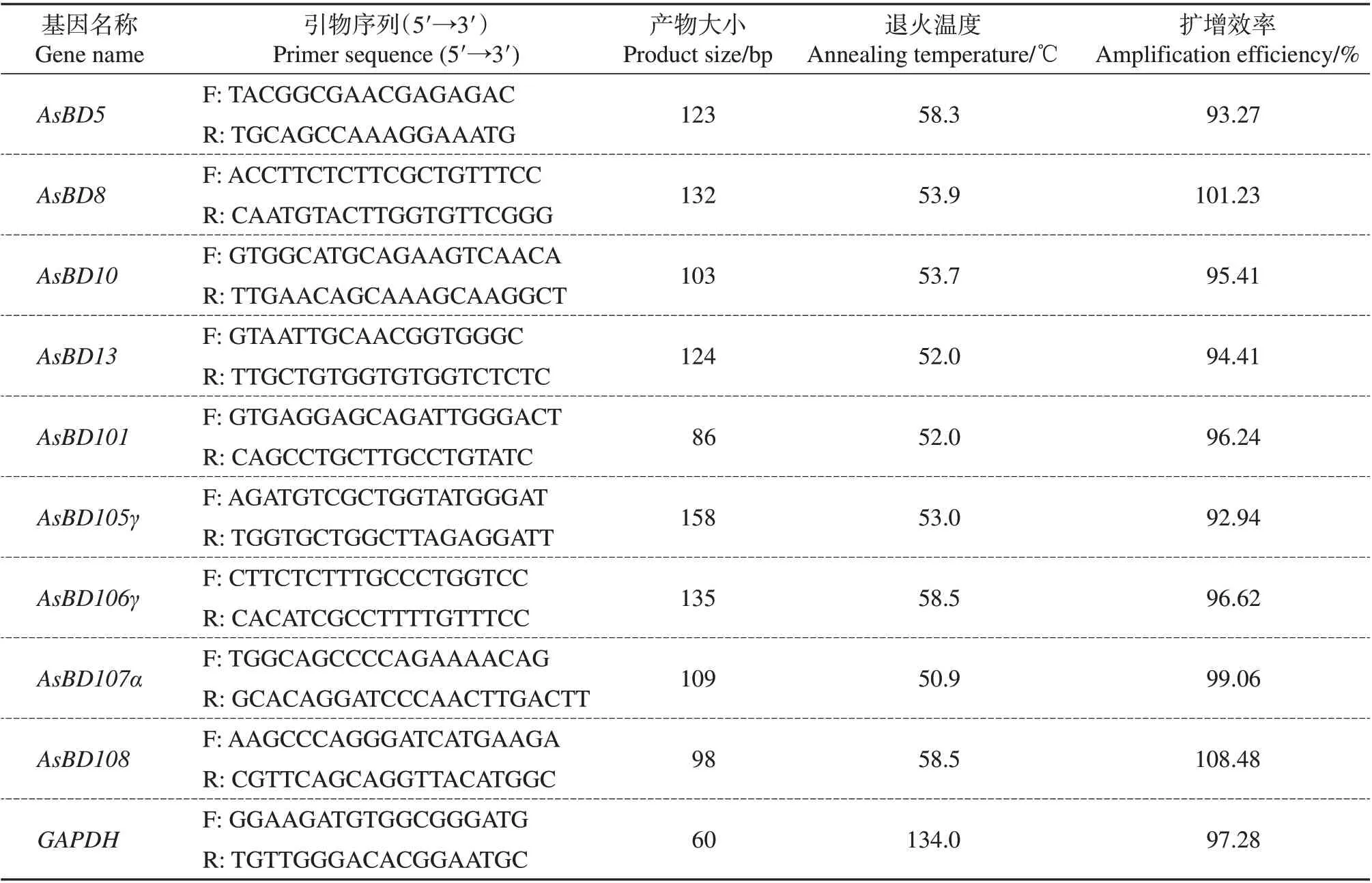
表2 qPCR引物信息Table 2 Primer information for qPCR
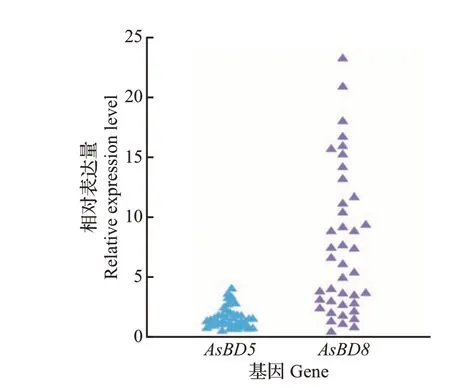
图2 扬子鳄七龄鳄群体血液中β 防御素基因AsBD5 和AsBD8的相对表达量Fig.2 Relative expression levels of β-defensin genes AsBD5 and AsBD8 in blood of seven-year-old Chinese alligators
目前,已有较多物种完成了防御素基因家族的解析,但有关其在血液中表达情况的研究仍较少。在人类的外周血中表达的防御素基因有α防御素1~3,而β防御素1或2只有在受到细菌或脂多糖刺激时才表达;在家鸡的外周血白细胞中,表达的防御素基因有AvBD1、AvBD2、AvBD6和AvBD7[22-23]。由此可见,不同物种血液中表达的防御素基因种类具有较大的差异,可能与物种间的特异性有关[24]。
本研究在分析饲养密度对扬子鳄群体防御素表达的影响时发现,饲养密度大的扬子鳄群体血液中整体的防御素表达水平较高,因此,推测饲养密度是这2个饲养池中扬子鳄免疫状况产生差异的原因之一。在有关鱼类饲养密度和免疫基因表达的研究中发现,生活在高密度饲养环境中的多耙牙鲆,其骨骼肌和头肾中的白细胞介素IL-1β表达水平显著上调,并伴随着与识别病原体相关的模式识别受体表达水平的变化[15]。这与机体感染病原体初期时免疫基因的变化十分相似,促炎性细胞因子IL-1β表达上调,然后通过相关细胞通路激活免疫效应分子如自然杀伤细胞增强因子、抗菌肽等的表达[25]。因此可推测,生活在饲养密度较高环境中的扬子鳄群体对环境中潜在病原体的敏感性更高,通过一系列促炎症反应导致防御素的表达水平升高。
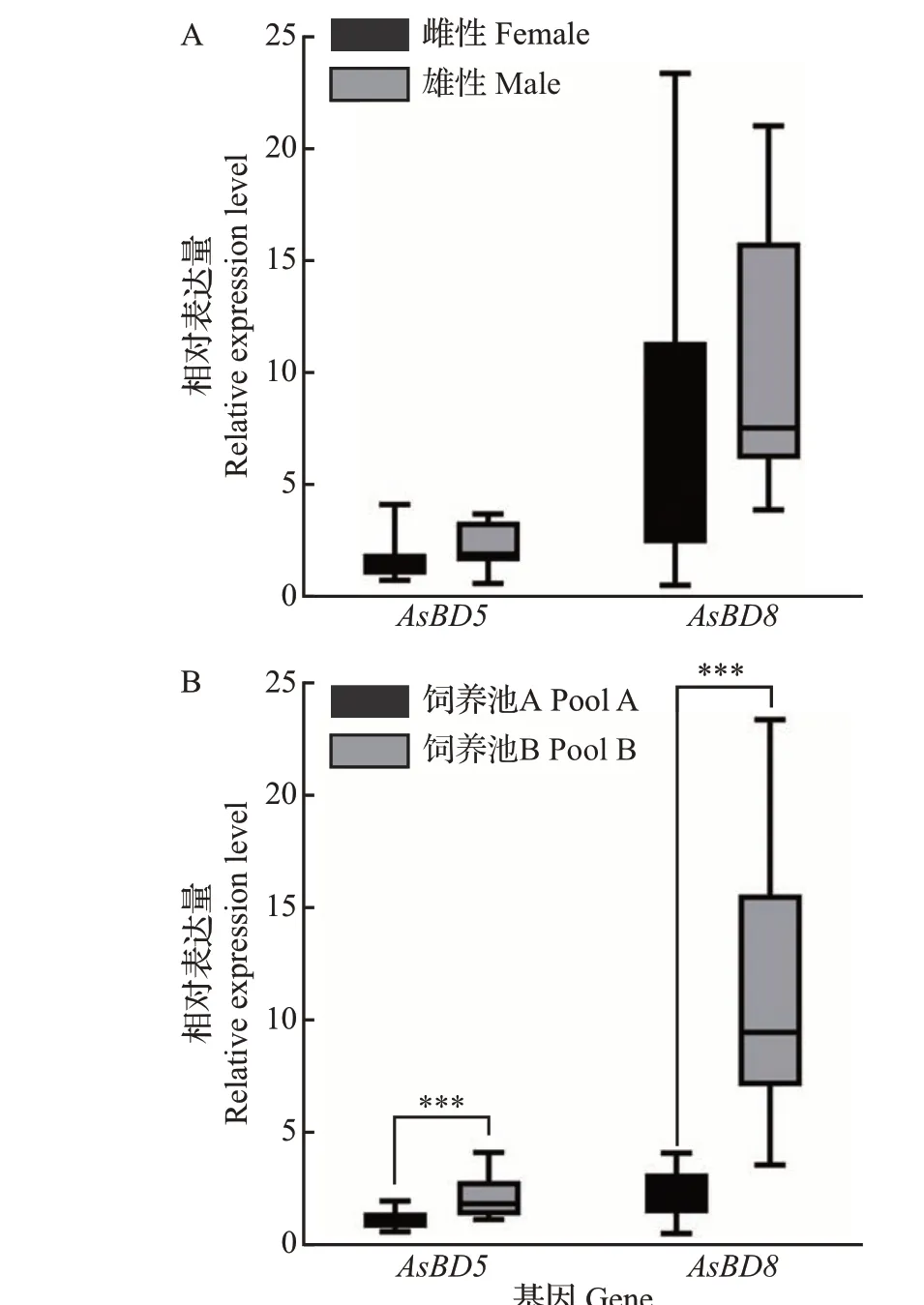
图3 不同性别(A)和不同饲养密度(B)的扬子鳄群体β 防御素基因的相对表达量Fig.3 Relative expression levels of β-defensin genes for populations of Chinese alligators under different sexes(A)and stocking densities(B)
在密河鳄、尼罗鳄、巴拉圭凯门鳄等多种鳄类的人工养殖中,西尼罗河病毒、痘病毒、嗜皮菌、弧菌等病原体大规模的传染造成了大量鳄鱼患病或死亡[26-29]。并且研究发现,在高饲养密度的群体中密河鳄幼鳄更容易感染西尼罗河病毒[30]。可见,在密集化饲养环境中,鳄类动物对病原体具有很高的敏感性。另外,在人类中已有关于疾病与防御素相关性的研究,发现在炎症性肠病、肺结节病、丙型病毒性肝炎等疾病患者的外周血中防御素基因的表达水平显著升高[31-33]。可见,防御素作为免疫和炎症的介质,其在外周血中的表达水平可作为某些疾病活动的生物标志物。由于在鳄类动物中该方面的研究仍未见报道,因此,关于高饲养密度下扬子鳄群体防御素表达升高对扬子鳄群体的健康状态和环境适应能力的长期影响还需进行更深入的研究。但是,今后可将防御素基因表达水平作为评价扬子鳄免疫状态的指标之一,以更加全面地评估扬子鳄圈养种群的免疫状态及人工饲养环境对其免疫能力的影响。
4 结论
本研究成功获得了扬子鳄β防御素基因的血液表达谱,检测出在扬子鳄血液中表达的2 个防御素基因AsBD5和AsBD8;并且发现饲养密度较高的扬子鳄群体整体的防御素表达水平显著升高,说明饲养密度在一定程度上对群体的免疫状态造成了影响,为扬子鳄今后的物种保护和种群管理工作提供了新的线索。
