厚壳贻贝转凝蛋白类贝壳基质蛋白的重组表达与功能分析
2020-11-27姜雨婷孙琦徐焕志申望张晓林范美华廖智
姜雨婷,孙琦,徐焕志,申望,张晓林,范美华,廖智
(浙江海洋大学海洋科学与技术学院,海洋生物蛋白质工程研究室,浙江 舟山316022)
生物矿化是生物体沉积矿物质的过程,多数生物矿物质为钙盐,如贝类贝壳就是由碳酸钙晶体在贝壳基质蛋白指导下形成的生物矿化组织[1]。天然的碳酸钙晶体的构型主要有3 种,分别为文石(aragonite)型、方解石(calcite)型和球霰石(vaterite)型;贝类贝壳中的碳酸钙晶体呈现出多样化的层次排列及微观结构特征[2-3]。贝壳基质蛋白对于贝壳的形成以及力学性能的发挥起到了极为重要的作用[4];贝壳的机械强度远比纯碳酸钙晶体高[5]。总之,贝壳基质蛋白不仅对贝壳的形成具有重要的指导作用,同时,也对贝壳的力学性能具有较大贡献[6-7]。目前,对贝壳基质蛋白的研究已成为了解生物矿化分子机制以及基于贝壳的生物材料学和仿生学研究的重要基础。从不同贝类贝壳中鉴定到的贝壳基质蛋白已有数百种[8-9],但多数贝壳基质蛋白在贝壳形成过程中的作用及分子机制仍不明确。
厚壳贻贝(Mytilus coruscus)是我国东部海域的重要经济贝类。前期研究表明:厚壳贻贝贝壳主要由珍珠质层、纤维棱柱层和肌棱柱层组成[10];蛋白质组学研究发现,厚壳贻贝中存在60种以上的贝壳基质蛋白[11],包括一种含有钙调理蛋白同源(calponin homology,CH)结构域的新型贝壳基质蛋白。该蛋白在序列上与转凝蛋白(transgelin)类似,因此被命名为转凝蛋白类蛋白(transgelin-like protein,TLP);该蛋白家族已先后从厚壳贻贝[11]、紫贻贝[12]、牡蛎[13]以及翡翠贻贝[14]贝壳内被鉴定到,说明该蛋白在贝壳中具有一定的保守性,并可能对贝壳的生物矿化具有重要影响,但是其在贝壳形成中的作用目前尚未见报道。
转凝蛋白又称平滑肌22α(smooth muscle 22 alpha,SM22α)蛋白,属于钙调理蛋白家族成员,可与肌动蛋白相互作用,是一种与细胞骨架相关的重要蛋白[15]。转凝蛋白通常含有一个CH 结构域,该结构域长度约100 个氨基酸,形成球状α-螺旋模块[16]。含钙调理蛋白结构域的蛋白通常属于肌动蛋白丝家族,对细胞骨架及细胞运动具有重要影响[17-19];同时,钙调理蛋白结构域可增加纤维细胞的钙化现象[17],说明该蛋白结构域与生物矿化可能存在关联。CH结构域因其在序列上与钙调理蛋白具有一定的同源性而得名[20]。CH 结构域具有细胞信号转导以及F-肌动蛋白结合功能[21-24]。考虑到转凝蛋白在贻贝贝壳中的存在,以及CH 结构域和钙调理蛋白结构域的同源性,我们推测TLP在贝壳的生物矿化过程中可能也发挥着重要作用。为此,我们对厚壳贻贝贝壳TLP 开展了原核重组表达及功能分析,结果表明,厚壳贻贝TLP 的重组表达产物对碳酸钙晶体在形貌、晶型及结晶速度等方面具有影响。上述研究结果为深入了解转凝蛋白类蛋白在贝壳生物矿化过程中的作用及其分子机制奠定了基础。
1 材料与方法
1.1 厚壳贻贝TLP 的序列分析
厚壳贻贝TLP 的基因序列已提交至GenBank数据库,编号为AKS48154.1。TLP的理化性质分析通过Expasy 数据库中的Protparam 软件(http://web.expasy.org/protparam/)在线进行;同源序列搜索、多序列比对和进化树分析在NCBI网站上利用Blast软件(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线进行;蛋白质结构域预测采用SMART 软件(http://smart.embl-heidelberg.de/)在线进行;蛋白质二级结构预测于Phyre2服务器(http://www.sbg.bio.ic.ac.uk/phyre2/)上在线进行;蛋白质三级结构预测于SWISS-MODEL 服务器(https://swissmodel.expasy.org/)上在线进行,建模软件为ProMod3 v1.1.0。
1.2 TLP 的密码子优化、设计与表达载体的构建
对厚壳贻贝TLP的cDNA成熟肽编码基因序列(长度为1 112 bp)采用OptimumGeneTM技术平台(http://www.genscript.com/)进行密码子优化设计,获得适于大肠埃希菌表达的目标基因序列。在TLP基因5′端添加多聚组氨酸标签、NcoⅠ酶切位点(CCATGG)和保护作用碱基(CA);在3′端添加终止密码子(TAA)和XhoⅠ酶切位点(CTCGAG);最终获得TLP目标基因序列,并由南京金斯瑞生物科技有限公司进行化学合成。合成后的目标基因经测序验证后,与表达载体(pET28α+)经NcoⅠ和XhoⅠ双酶切后,在T4-DNA 连接酶作用下进行连接,以构建重组表达载体rTLP/pET28α+。将构建好的重组表达载体转化至大肠埃希菌TOP10 感受态细胞中,采用平板划线法置于含卡那霉素的LB(Luria-Bertani)平板上,37 ℃过夜培养,挑取单克隆菌落进行聚合酶链式反应(polymerase chain reaction,PCR)鉴定,将阳性克隆送至生工生物工程(上海)股份有限公司进一步测序验证。
1.3 重组TLP 的表达、复性、纯化及鉴定
参照文献[25]的方法进行TLP 重组表达。重组表达产物采用镍离子金属螯合亲和层析介质(Ni-NTA)纯化,使用梯度咪唑溶液洗脱后收集目标蛋白。目标蛋白经镍柱分离后,参照文献[26]的方法进行透析复性处理。复性后的目标蛋白采用反相高效液相色谱法进一步纯化。高效液相色谱仪为Waters 600E 型(美国沃特世公司),检测器为Waters 2487双波长紫外检测器(美国沃特世公司),色谱柱为Vydac 208TP C8反相色谱柱。采用二元线性梯度洗脱,其中:A液为含0.1%三氟乙酸的纯水;B液为含0.1%三氟乙酸的乙腈,在35 min 内,其比例由30%上升至75%;流速为1 mL/min;检测波长为280 nm。收集主峰进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)检测,采用12%分离胶,120 V恒压模式;电泳结束后经固定和考马斯亮蓝G250染料染色,拍照观察。
1.4 重组TLP 的功能分析
重组TLP的功能分析主要包括体外碳酸钙结晶诱导、碳酸钙晶体结合和碳酸钙晶体结晶速度分析。体外碳酸钙结晶诱导参照文献[27]的方法,其中:方解石型碳酸钙晶体是将氯化钙溶液(10 mmol/L)放置于含碳酸铵固体的玻璃干燥罐内,利用碳酸铵挥发出的二氧化碳与氯化钙溶液反应而获得;文石型碳酸钙晶体是在上述方法基础上,预先在氯化钙溶液中添加氯化镁溶液(1∶1 摩尔比),在镁离子作用下诱导氯化钙与二氧化碳反应而形成。在上述反应体系中,分别加入不同质量浓度(0、10、30、50 μg/mL)的重组TLP 溶液以判断重组TLP 对碳酸钙结晶的影响。诱导形成的碳酸钙晶体用去离子水洗涤后均匀分布于盖玻片上,室温干燥后经真空喷金处理,在Nova_Nano_SEM450场发射扫描电子显微镜(美国FEI公司)下观察晶体形貌。碳酸钙晶体的晶型分析采用傅里叶变换红外光谱(Fourier transform infrared,FTIR)法进行。将诱导形成的碳酸钙晶体与适量溴化钾粉末研磨成细粉,混匀后压成片,进行上机扫描。所用傅里叶变换红外光谱仪为美国Nicolet Nexus 670。采用透射模式测量,扫描范围500~2 500 cm-1,扫描次数32,分辨率4 cm-1。红外光谱图采用Omnic 8.2.387软件进行分析处理。
重组TLP 对碳酸钙结晶速度的抑制实验参照文献[25]的方法。碳酸钙晶体的制备如上段所述。蛋白溶液的制备同1.3节,其中:空白对照组加去离子水;阴性对照组加50 μg/mL 牛血清白蛋白(bovine serum albumin, BSA)溶液。用Synergy H1型酶标仪(美国Biotec 公司)在600 nm 波长处扫描观察溶液浊度变化。
重组TLP 与碳酸钙晶体的结合实验参照文献[25]的方法。事先配置0.45 mg/mL 重组TLP 溶液(溶液1),分别加入2 种晶型的碳酸钙粉末,充分振荡混匀后室温孵育2 h,离心(7 000g,4 ℃,15 min)后收集上清液(溶液2),备用;沉淀经去离子水反复洗涤并离心(7 000g,4 ℃,15 min)后,用5%乙酸进行脱钙(溶液3)。对溶液1、2 和3 分别进行SDSPAGE分析。
2 结果
2.1 厚壳贻贝TLP 的序列特征
厚壳贻贝TLP 基因的天然cDNA 全长为1 112 bp,编码一个由167 个氨基酸组成的前体肽,其理论分子质量为18 879.49 Da,理论等电点为8.28,为碱性蛋白,无信号肽。其核苷酸-氨基酸序列比对见图1。氨基酸组成分析结果表明,厚壳贻贝TLP序列中含量最丰富的氨基酸为赖氨酸(10.8%),其次为天冬酰胺(7.8%)和甘氨酸(7.8%)。同源蛋白搜索结果表明,在数据库中与厚壳贻贝TLP序列相似性较高的蛋白主要为来自紫贻贝(Mytilusgalloprovincialis)的TLP,其序列一致性超过80%。根据序列同源搜索结果,选取同源性较高的17条序列构建系统进化树。结果(图2)表明,厚壳贻贝TLP 首先与地中海贻贝TLP 家族聚为一支,然后进一步与牡蛎TLP家族聚为一支。
由图3 可见,在软体动物中,含CH 结构域的蛋白大致可分为4类,分别为仅含1个CH结构域的蛋白(Ⅰ类),含1个CH结构域和1个钙调理蛋白结构域的蛋白(Ⅱ类),含1个CH结构域和多个钙调理蛋白结构域的蛋白(Ⅲ类),以及含1个CH结构域和1个GAS2 结构域的蛋白(Ⅳ类)。在这4 类蛋白中,厚壳贻贝TLP 属于第Ⅰ类,含1 个CH 结构域,位于肽段33~143 号氨基酸残基处;该类蛋白主要包括转凝蛋白(transgelin)、细丝蛋白(filamin)及网蛋白(plectin)。总之,厚壳贻贝TLP 与其他软体动物的同源序列在结构域分布上具有较大差别。
厚壳贻贝TLP的二级结构主要由α-螺旋组成,含量为59%(图4A)。其预测的三级结构为球状α-螺旋域,含有6段α-螺旋(Ⅰ~Ⅵ;图4B),与已报道的转凝蛋白空间结构类似[28]。其中:6段α-螺旋分别为螺旋Ⅰ(Ala16~Gln29),螺旋Ⅱ(Arg41~Lys49),螺旋Ⅲ(Thr52~Leu61),螺旋Ⅳ(Ala78~Tyr95),螺旋Ⅴ(Thr105~Trp109)与螺旋Ⅵ(Met114~Ala128);螺旋Ⅳ与螺旋Ⅰ,以及螺旋Ⅱ和螺旋Ⅲ呈垂直状态,类似于钙离子结合结构域中经典的E/F 手(E/F hand)结构模体。

图2 厚壳贻贝TLP与17条来自其他软体动物且一致性在88%以上的同源蛋白序列基于邻接法构建的系统进化树Fig.2 Phylogenetic tree of M.coruscus TLP with 17 homologous protein sequences from other mollusks constructed by neighborjoining method

图3 厚壳贻贝TLP与来自其他软体动物的同源蛋白序列的结构域分布比较Fig.3 Comparison of domain distribution among M.coruscus TLP and homologous protein sequences from other mollusks
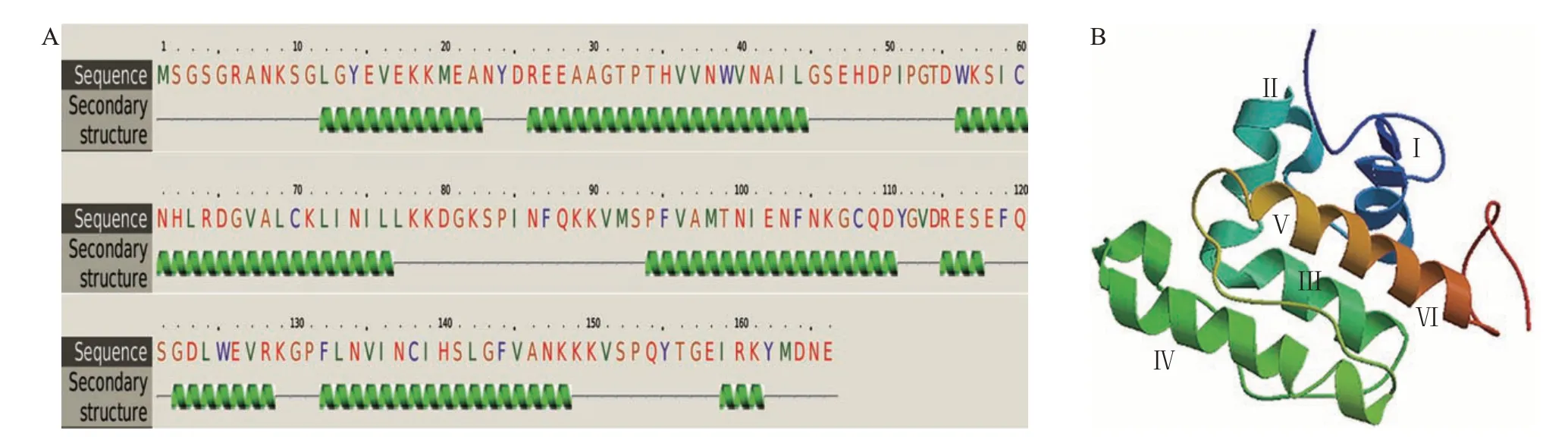
图4 厚壳贻贝TLP的二级和三级结构预测Fig.4 Prediction of secondary and tertiary structures of M.coruscus TLP
2.2 厚壳贻贝TLP 的重组表达
使用南京金斯瑞生物科技有限公司提供的密码子分析工具(GenScript rare codon analysis tool)对优化前后的目标基因开展密码子适应指数(codon adaptation index, CAI)分析,结果见图5。厚壳贻贝天然TLP 编码序列的开放阅读框(open reading frame, ORF)长度为504 bp,经密码子优化和序列重新设计后,目标序列长度为525 bp;TLP基因在优化前,其CAI 值经OptimumGeneTM软件计算为0.64;优化后,其CAI值达到了0.87。CAI值大于0.8,意味着该目标基因在大肠埃希菌中的表达效率较高[29]。
TLP 重组菌经异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)诱导表达后,用SDS-PAGE检测,结果见图6。从中可见:厚壳贻贝重组TLP主要在包涵体中表达;目标蛋白条带的分子质量在18 kDa 左右,与预期分子质量吻合;重组TLP蛋白经镍柱分离,在300 mmol/L咪唑浓度下可得到充分洗脱。重组TLP经透析复性后,进一步采用反相高效液相色谱法进行纯化,目标蛋白在54%乙腈体积分数下被洗脱,且纯度较高(图7)。
2.3 重组TLP对碳酸钙晶体形貌变化的诱导作用

图5 厚壳贻贝TLP在优化前后的密码子适应指数分析Fig.5 Analysis of codon adaptation index of M. coruscus TLP before and after optimization
厚壳贻贝重组TLP 对碳酸钙晶体体外结晶的诱导结果如图8~9所示。由图8可见:天然方解石型碳酸钙晶体形态为规则六面体(图8A);而加入50 μg/mL 牛血清白蛋白(阴性对照)对方解石型碳酸钙晶体的形貌无明显影响(图8B);在低质量浓度(10 μg/mL)的重组TLP 诱导下,多数碳酸钙晶体的形貌无明显变化(图8C);在30 μg/mL 重组TLP 诱导下,部分碳酸钙晶体形貌出现了端部放射状结构(图8D);在高质量浓度(50 μg/mL)的重组TLP诱导下,部分碳酸钙晶体呈现出绣球状形貌(图8E~F)。由图9 可见:天然的文石型碳酸钙晶体以及在牛血清白蛋白作用下,其形态无明显区别,均为球状(图9A~B);而在加入不同质量浓度的重组TLP 后,文石型碳酸钙晶体的形貌出现明显变化。其中:低质量浓度(10 μg/mL)的重组TLP 使部分碳酸钙晶体的球体表面呈现出凹陷现象(图9C);30 μg/mL的重组TLP 使多数文石型晶体的形貌呈现出中部缢裂现象(图9D);50 μg/mL 的重组TLP 使文石型碳酸钙晶体的形貌进一步改变为不规则的花瓣状结构(图9E~F)。
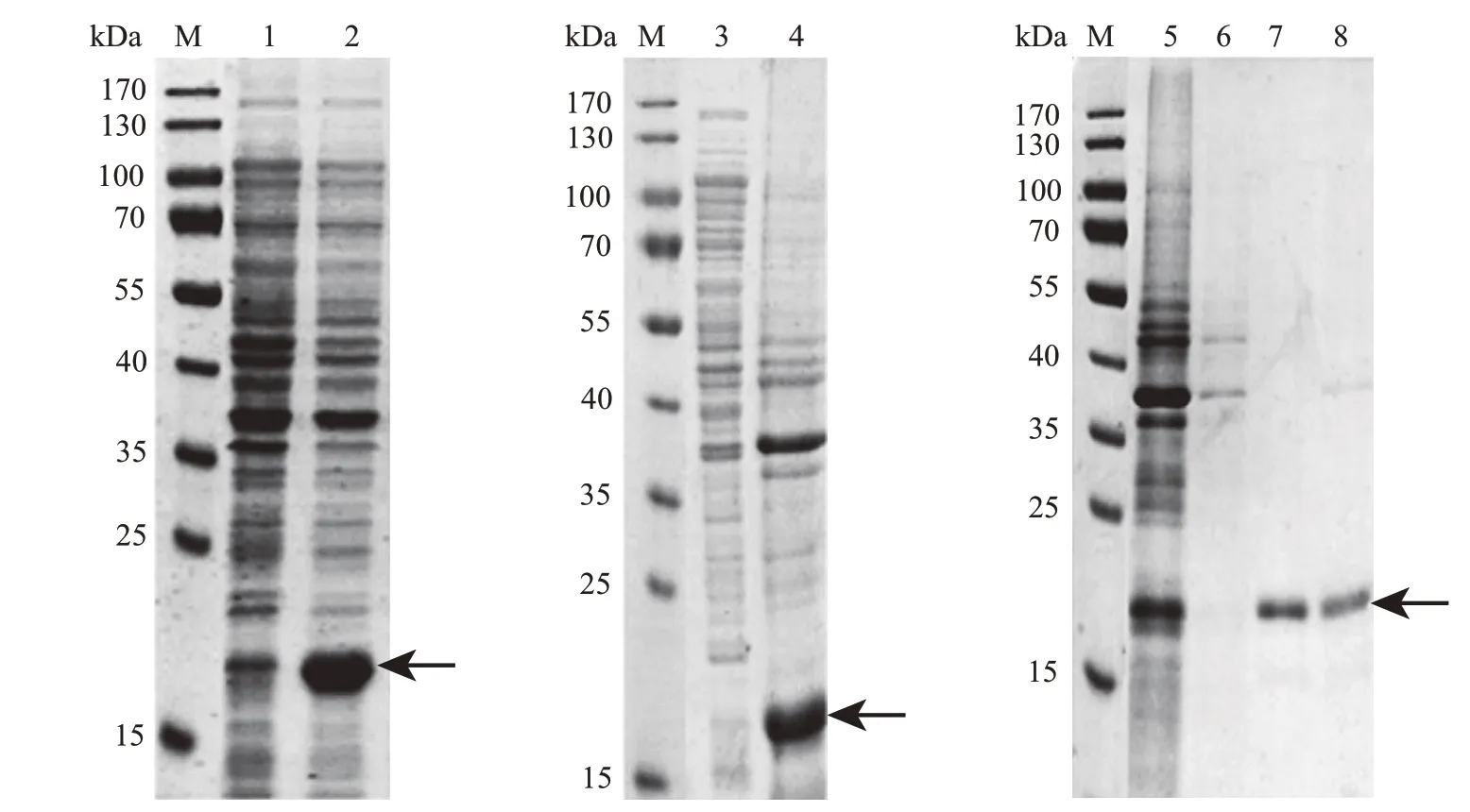
图6 厚壳贻贝TLP重组表达和纯化后的SDS-PAGE鉴定Fig.6 SDS-PAGE identification of M.coruscus TLP after recombinant expression and purification

图7 重组TLP复性后的高效液相色谱法纯化Fig.7 Purification of refolded recombinant TLP(rTLP)by high performance liquid chromatography
采用FTIR 法对重组TLP 进行碳酸钙晶体晶型分析,结果见图10。与天然碳酸钙晶体相比,50 μg/mL 重组TLP对方解石型碳酸钙晶体的晶型影响较为明显,多出了一个波数值为1 035.93 的文石型碳酸钙晶体特征峰(图10A2);而50 μg/mL重组TLP对文石型碳酸钙晶体的晶型无明显影响(图10B2)。
2.4 重组TLP 对碳酸钙晶体结晶的抑制作用
采用分光光度计法测定碳酸钙结晶的时间曲线以及在重组TLP 作用下,碳酸钙结晶速度的变化。结果(图11)表明:重组TLP对方解石型碳酸钙晶体具有明显的抑制作用,但对重组TLP的质量浓度无明显依赖性;重组TLP对文石型碳酸钙晶体的结晶速度在较高质量浓度(50µg/mL)下具有促进作用,而在10和30µg/mL质量浓度下具有抑制作用。

图8 方解石型碳酸钙晶体的扫描电子显微镜观察Fig.8 Scanning electron microscope (SEM) observation on in vitro crystallization of calcite-type calcium carbonate crystal
2.5 重组TLP 与碳酸钙晶体的结合作用
重组TLP 与碳酸钙晶体结合后的SDS-PAGE检测结果如图12所示:重组TLP与方解石型晶体有明显的结合作用,经与碳酸钙晶体孵育并离心,其上清液中的蛋白条带明显变弱;进一步将结合了重组TLP 的碳酸钙晶体经5%乙酸脱钙透析后,重组TLP被释放出来并在SDS-PAGE中重新出现条带。而文石型碳酸钙晶体与TLP结合后,上清液中蛋白质含量未有明显变化,沉淀经脱钙后也未出现蛋白条带。

图9 文石型碳酸钙晶体的扫描电子显微镜观察Fig.9 SEM observation on in vitro crystallization of aragonitetype calcium carbonate crystal
3 讨论

图10 方解石型和文石型碳酸钙晶体的傅里叶变换红外光谱图Fig.10 Fourier transform infrared spectra of the calcite-and aragonite-type calcium carbonate crystals
贝壳的形成过程属于典型的生物矿化现象。生物矿化是指生物通过各种生物大分子对矿化组织进行调控加工的动态生理过程[30]。在贝壳的形成过程中,贝壳基质蛋白通常作为自组装结构的矿化体系核心,不仅提供矿物质晶体成核的位点,也对晶体的生长和组装起到调控作用,包括晶型、晶体生长方向及有序性等方面的调控[31-33]。目前,贝壳中已报道的各种贝壳基质蛋白种类数已超过1 000种,且在结构上千差万别,表明贝壳的生物矿化过程有着一套极为复杂的调控体系。TLP是从厚壳贻贝贝壳中鉴定到的一种新型贝壳基质蛋白[11]。结构预测结果表明,TLP的结构以α-螺旋为主。贝壳基质蛋白中α-螺旋与钙离子的结合以及钙离子在水中的溶解度有关,且有利于碳酸钙晶体在贝壳中形成高度有序的结构[8]。因此,推测TLP 可能通过其结构中的α-螺旋域在生物矿化中发挥作用。此外,厚壳贻贝TLP 序列中含有一段典型的CH 结构域。该结构域通常以单拷贝形式在蛋白中广泛分布,包括转凝蛋白(transgelin)、亲肌肉蛋白(myophilin)、钙调理蛋白(calponin)等[34-35]。CH 结构域被认为与肌动蛋白结合有关[20],而在不同物种贝壳中也鉴定到肌动蛋白的存在[11-14]。尽管贝壳中肌动蛋白的存在目前尚有争议[36],但是考虑到厚壳贻贝TLP 主要从贝壳的肌棱柱层中被鉴定到,且肌棱柱层是厚壳贻贝后闭壳肌与贝壳直接相连的部位[37],因此,不排除TLP 可能对肌棱柱层的生物矿化具有影响并在贝壳-肌肉连接界面处发挥作用。

图11 重组TLP对碳酸钙晶体结晶速度的抑制作用Fig.11 In vitro inhibition of calcium carbonate crystallization by rTLP
本研究采用密码子优化及原核重组表达策略,结合氧化复性以及镍柱和反相高效液相色谱纯化,成功获得重组厚壳贻贝TLP蛋白;体外碳酸钙结晶诱导结果表明,重组TLP对碳酸钙晶体的晶型具有明显诱导作用。目前,已鉴定的贝壳基质蛋白多数具有碳酸钙结晶诱导作用而导致晶体形貌发生变化[38-41],表明贝壳基质蛋白可能通过对碳酸钙晶体的形貌影响而促进贝壳不同微观层次的形成。此外,FTIR 分析表明,重组TLP 蛋白能诱导方解石型碳酸钙晶体晶型向文石型转变,但是对文石型晶体的晶型无明显影响。这表明厚壳贻贝TLP 在贝壳形成过程中,可能针对性地对方解石型晶体具有诱导作用。已知厚壳贻贝贝壳肌棱柱层的碳酸钙晶型为文石型[10],因此,TLP蛋白对方解石型碳酸钙晶型的转变可能与肌棱柱层的形成有关。进一步对碳酸钙晶体结晶速度进行分析表明,重组TLP可以抑制方解石型碳酸钙晶体的结晶速度,但是对文石型碳酸钙晶体结晶速度的抑制则较为复杂,表现为低质量浓度下的抑制作用和高质量浓度下的促进作用。从此前的研究结果来看,多数已知的贝壳基质蛋白对碳酸钙晶体的结晶速度存在抑制作用,例如:厚壳贻贝贝壳胶原蛋白-2(collagen-2;含vWA结构域)对方解石型碳酸钙晶体的结晶速度存在抑制作用[25];合浦珠母贝(Pinctada fucata)贝壳的无定形碳酸钙结合蛋白(amorphous calcium carbonatebinding protein,ACCBP;含ACh-binding 结构域)以及Pfy2 对方解石型碳酸钙晶体的结晶速度也有明显的抑制作用[40,42];而富含赖氨酸的基质蛋白-3(lysine-rich matrix protein-3, KRMP-3;含Gly/Tyr结构域)则对文石型碳酸钙晶体的结晶速度有抑制作用[38]。此外,来自鲍鱼(Haliotis laevigata)贝壳的Perlwapin(含乳清酸性蛋白结构域)同样对方解石型碳酸钙晶体的结晶速度有抑制作用[43]。由此可见,不同类型的贝壳基质蛋白可能在贝壳形成过程中普遍存在对碳酸钙晶体结晶速度的抑制现象。但也有少数贝壳基质蛋白对碳酸钙晶体的结晶速度有促进作用,例如,大珠母贝(Pinctada maxima)贝壳的N66(含碳酸酐酶结构域)对文石型碳酸钙晶体的结晶速度有促进作用[44]。此前已有报道认为,贝壳基质蛋白分子通过吸附于碳酸钙晶核的表面,对晶体的成核起负调控作用(对晶体的成核尺寸大小产生影响),并通过吸附于晶体的不同晶面,使得晶体的生长速度受到抑制,进而调控晶体的形貌[45-46]。进一步的碳酸钙晶体结合试验结果表明,重组TLP 与方解石型碳酸钙晶体具有明显的结合作用,表明重组TLP可通过与方解石型碳酸钙晶体结合而产生调控作用。但重组TLP 与文石型碳酸钙晶体并未表现出明显的结合作用,这表明TLP在贝壳形成过程中,对文石型碳酸钙晶体的调控可能通过其他未知途径进行,还需进一步的实验研究。
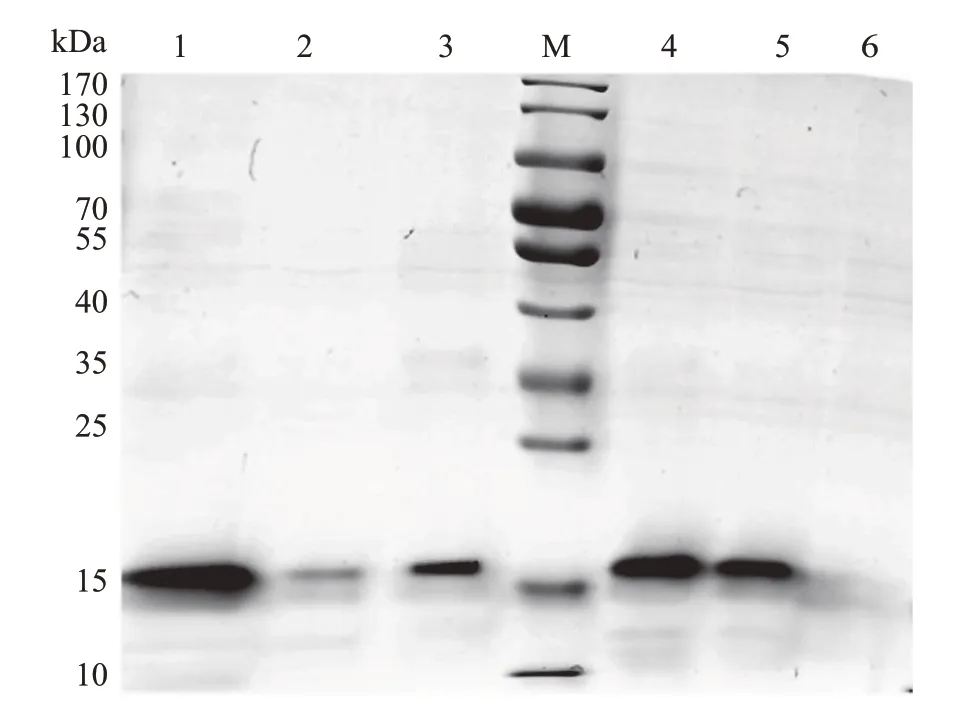
图12 重组TLP 与方解石型及文石型碳酸钙晶体结合的SDS-PAGE分析Fig.12 SDS-PAGE analysis of rTLP precipitated by calciteand aragonite-type calcium carbonate crystals
综上所述,本文采用密码子优化及原核重组表达技术,获得了重组厚壳贻贝TLP。经功能分析发现,厚壳贻贝TLP 可影响碳酸钙晶体的形貌和晶型,并对方解石型碳酸钙晶体具有抑制作用。以上结果表明,厚壳贻贝TLP 可能在贝壳,特别是肌棱柱层的形成过程中发挥重要作用。上述研究结果一方面为探究贻贝贝壳的生物矿化机制提供了线索,另一方面也为基于TLP的后续蛋白质工程研究奠定了基础。
致谢 浙江大学电镜中心宋丹丹老师在扫描电子显微镜观察中提供了大力帮助,谨致谢意!
