基于冷冻肿瘤组织切片的磷酸化HER2免疫组织化学染色方法探讨
2020-11-27范姝琼
范姝琼 , 郑 莉
[1. 迪哲(上海)医药有限公司,上海 201203;2. 复旦大学生命科学学院,上海 200433]
原癌基因编码蛋白人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)作为表皮生长因子受体(epidermal growth factor receptor,EGFR)家族成员之一,当基因扩增或过表达时会形成同源二聚体,或与EGFR家族其他成员形成异源二聚体,激活下游细胞通路,影响细胞的生长与增殖等功能[1-2]。肿瘤分子标志物存在于肿瘤组织中,当机体发生癌变时,与之相对应的癌因子会发生功能性的改变。因此,通过对肿瘤分子标志物的检测可以及早发现肿瘤患者,并监测其临床治疗效果以及评估预后。肿瘤分子标志物在细胞中的精准定位及表达水平与分子靶向药物的治疗效果密切相关[3]。在早期药物研发阶段,通过肿瘤分子标志物检测和判读,可以直接验证靶向化合物的作用机制,分析化合物在动物模型中达到的药效动力学,帮助了解药效动力学和药代动力学的相关性。磷酸化HER2(phospho-HER2,p-HER2)作为HER2抑制剂的直接作用靶点,是最直接最理想的药效验证靶向蛋白[4]。从技术手段角度来说,免疫组织化学方法方便、快捷、易于操作,医院病理科以及中心实验室都具备比较成熟的免疫组织化学检测技术和实验条件,易于推广。
在实际科研和病理诊断工作中,冷冻切片在操作上相较于石蜡切片更快速,常用于短时限内病理诊断与生物标志物的检测。但冷冻切片的组织形态与抗原稳定性容易受外部因素的影响,例如切片温度、不同的组织固定液和切片存储条件等[5-6]。 相较于石蜡切片,多次制片更容易对冷冻组织造成不可逆的损失和损伤。本文通过对比不同的固定条件和存储时间,观察免疫组织化学染色过程中p-HER2的信号变化,探讨针对p-HER2检测过程中冷冻组织切片的最佳固定与保存条件。
1 材料与方法
1.1 动物模型
6~8周龄雌性BALB/c-nu/nu小鼠10只,体质量为20~25 g,购自北京维通利华实验动物有限公司[SCXK(京)2016-0011],饲养于迪哲(上海)医药有限公司动物实验室[SYXK(沪)2018-0015]。实验正式开始前,需将动物在新环境中适应性饲养1周。选取p-HER2高表达的人源性乳腺癌细胞株BT474,通过腹部皮下注射的方法建立小鼠皮下移植瘤模型,建模成功率为60%(6/10)。本实验符合迪哲(上海)医药有限公司动物伦理委员制定的伦理学标准(IACUC:
1804-ONM-02)。
1.2 试剂
抗p-HER2(6B12)抗体购自美国Cell Signaling Technology公司,免疫组织化学检测试剂盒购自瑞士Ventana Roche公司,冷冻包埋剂OCT购自美国Thermo公司,苏木精购自美国Sigma公司,甲醛、无水乙醇和乙酸均购自国药集团药业股份有限公司。乙醇-乙酸-甲醛(AAF)混合固定液的配制:冰醋酸5 mL,37%甲醛溶液10 mL,无水乙醇85 mL。
1.3 仪器
冷冻切片机Leica CM3050S Motorized Cryostat和病理切片病理数字扫描系统Aperio ScanScope均购自德国Leica公司,全自动免疫组织化学染色仪Ventana Discovery XT购自瑞士Ventana Roche公司。
1.4 制片
接种后第5日起,每隔3 d用游标卡尺测量移植瘤体的长径(L)、短径(W)1次,取平均值,按公式V=1/2(L×W2)计算移植瘤平均体积。待裸小鼠BT474细胞皮下肿瘤生长至约300 mm3时处死小鼠,剥离肿瘤组织,用液氮速冻[7],连续冰冻切片(厚度为5µm)。然后进行最佳固定与保存条件的探索。
1.5 切片固定
实验分3部分。(1)探索不同固定液对p-HER2免疫组织化学染色信号的影响:制作2组冷冻组织切片,分别用体积分数10%的中性甲醛固定液和AAF固定液处理5 min,然后进行免疫组织化学染色。(2)探索冷冻切片后不同时间点进行甲醛溶液固定对p-HER2免疫组织化学染色信号的影响:冷冻制片后1、5、20和30 min后,用10%中性甲醛溶液固定5 min,然后进行免疫组织化学染色。(3)探索冷冻切片固定后在超低温保存条件下的抗原稳定性:采用逆向计算实验时间的方法,在不同时间制备冷冻组织切片;未染色的切片经过固定后,置于-20 ℃冰箱内存储;切片分别经过1周、4周和12周后,与新鲜制备的冷冻切片一同进行免疫组织化学染色,并将所有切片的染色结果与新鲜切片染色结果进行对比。
1.6 免疫组织化学染色
用全自动免疫组织化学染色仪进行免疫组织化学检测。在制作好的切片上滴加质量浓度为3.4 µg/mL的兔抗人p-HER2(Tyr1221/1222)单克隆抗体,孵育20 min后,洗去一抗;再滴加即用型Ultra Map过氧化物酶标记的羊抗兔二抗试剂,孵育16 min,再用ChromoMap DAB进行显色。显色完成的切片滴加苏木精染液,再滴加蓝化试剂进行返蓝,完成组织细胞核的对比染色程序。染色完成的切片在无水乙醇中清洗,然后置于自动封片机上封固。
1.7 结果判读
免疫组织化学染色切片经Aperio成像系统扫描归档,染色结果由病理医师进行观察、对比,并截图拍照。
2 结果
2.1 不同固定液对p-HER2免疫组织化学染色结果的影响
用10%中性甲醛固定液处理后,切片组织结构完整,细胞形态和结构清晰,p-HER2的免疫组织化学染色信号清晰可判读(图1A)。用AAF固定液处理后,虽然切片组织和细胞结构清晰,但p-HER2的免疫组织化学染色信号强度相对较弱(图1B)。
2.2 BT474肿瘤组织固定前抗原的稳定性
BT474移植瘤组织在冷冻制片后5~20 min进行甲醛溶液固定,组织黏附性好,染色过程中不易掉片,光学显微镜下显示组织结构与细胞形态清晰,p-HER2染色信号稳定无差异(图1C~E)。冷冻制片30 min后再行甲醛溶液固定的切片中,p-HER2染色信号开始下降。 冷冻组织制片后立即进行甲醛溶液固定的切片在光学显微镜下显示组织黏附性较差,在染色冲洗过程中容易掉片,细胞结构不够清晰,p-HER2免疫组织化学信号弥散(图1F)。
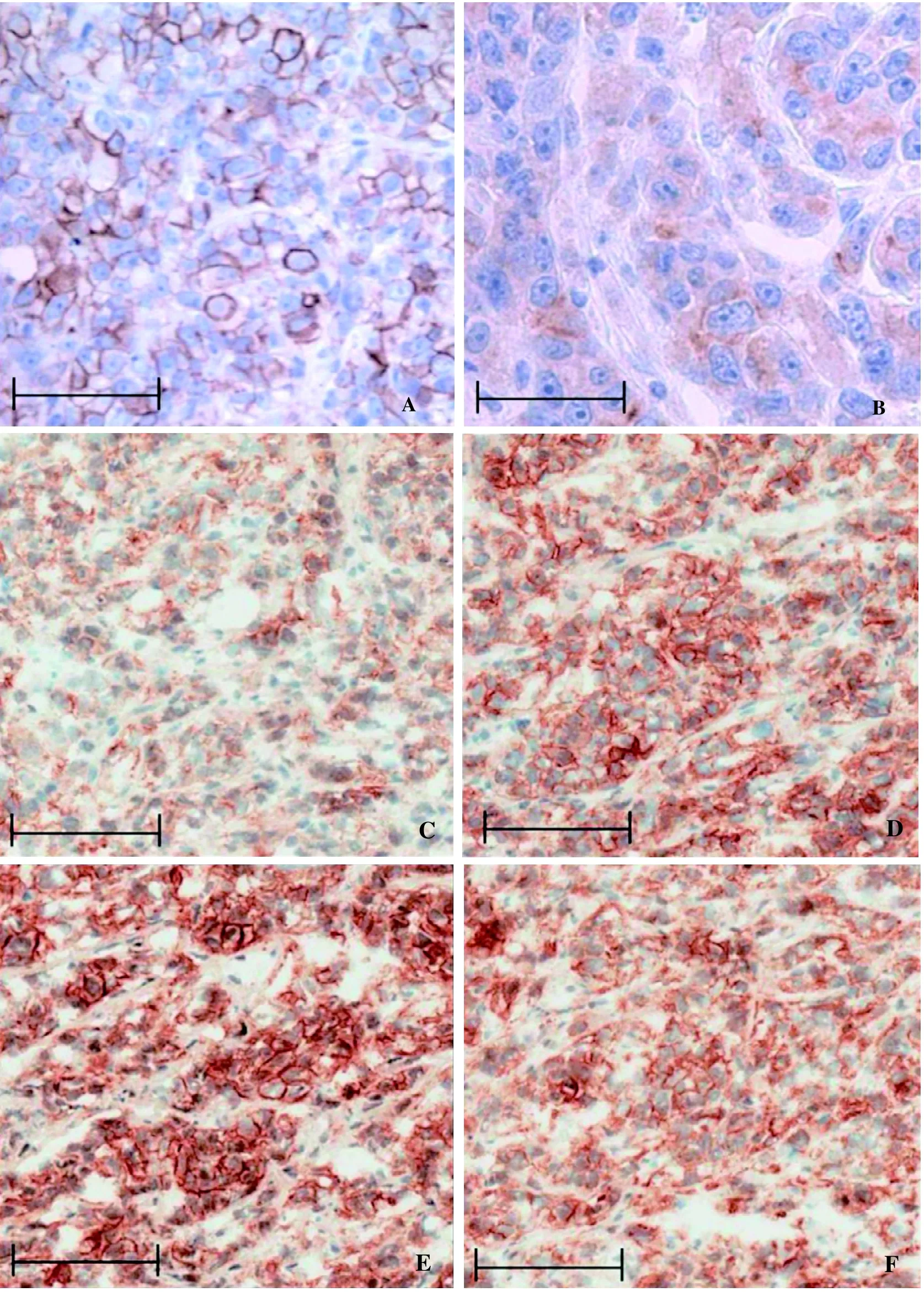
图 1 冷冻组织切片中p-HER2免疫组织化学染色结果(DAB显色)Figure 1 Immunohistochemistry staining result of phospho-human epidermal growth factor receptor 2 (p-HER2) in frozen sections (DAB coloring)
2.3 BT474肿瘤组织固定后抗原的稳定性
利用全自动染色仪对新鲜及经过长时间保存的冷冻组织切片进行免疫组织化学染色。结果显示,未经染色的冷冻组织切片经过12周的存储后,组织黏附性好,染色过程中没有发生组织脱落的现象,且组织与细胞形态完整清晰;p-HER2免疫组织化学染色信号清晰,其信号强度与固定完当日即行免疫组织化学染色的切片相比没有明显差异(图2)。
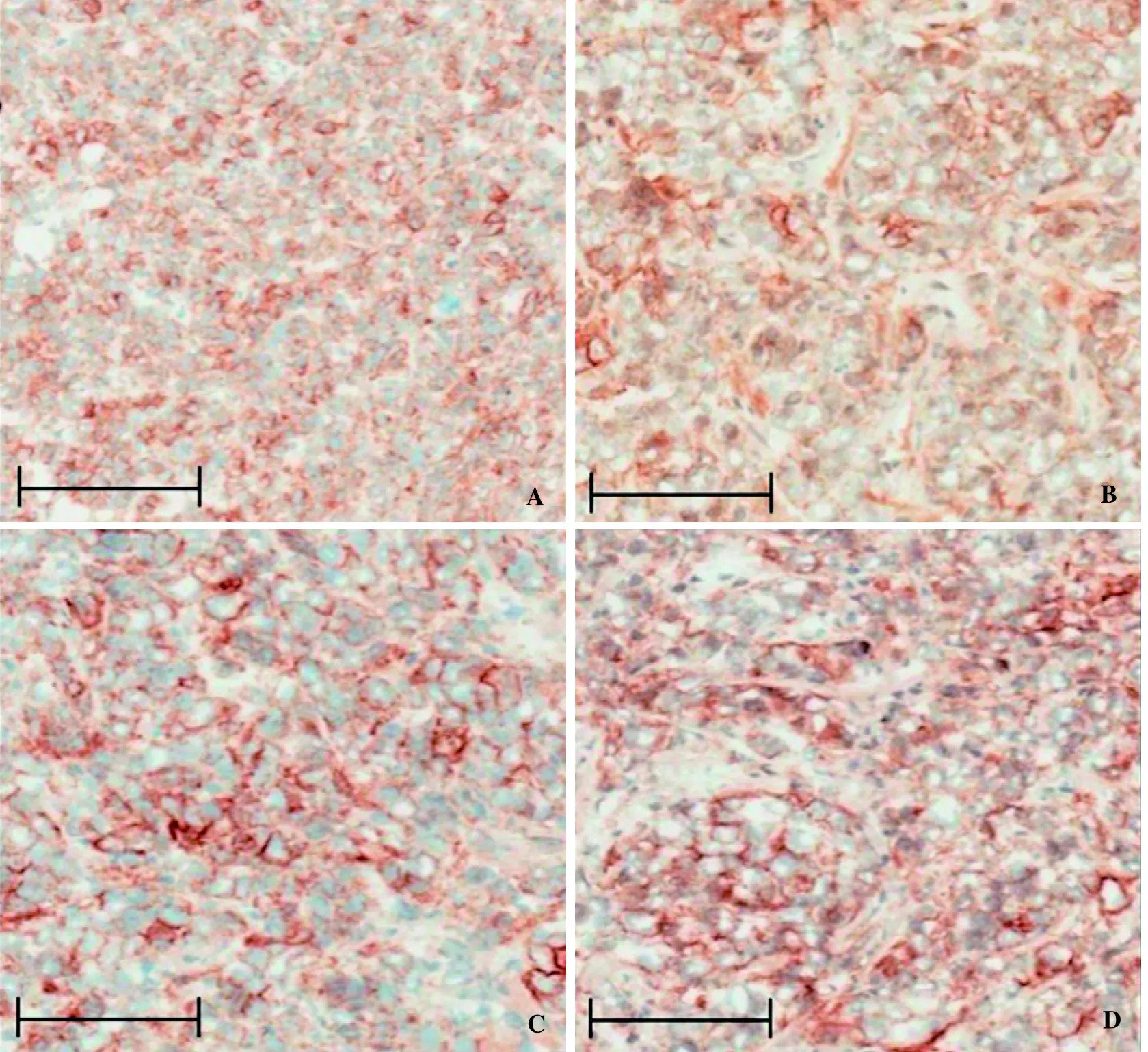
图 2 未染色的冷冻组织切片经过不同时间保存后p-HER2免疫组织化学检测结果(DAB显色)Figure 2 Immunohistochemistry staining result of phospho-human epidermal growth factor receptor 2 (p-HER2) in frozen sections stored for different time (A, 0 day;B, 1 week; C, 4 weeks; D, 12 weeks) (DAB coloring)
3 讨论
免疫组织化学染色作为生物标志物常用检测方法,利用抗原抗体结合以及化学显色反应,反映组织细胞中的蛋白含量及分布情况。由于其方法相对简单,因此普及率相当高,在医院内常用于辅助患者明确病理诊断,从而提供依据帮助选择合适的靶向治疗方案,以及用于判断患者的预后情况。在新药研发的过程中,免疫组织化学染色方法也常用于确定药物的作用机制,并分析药代动力学与药物效果的相关性。常规的免疫组织化学实验采用经甲醛溶液固定的石蜡组织切片,其优点是样品易于保存,而缺点是从样品采集、充分固定到石蜡切片制备完成所需要的时间较长,而且在实验过程中经过固定的抗原需要先进行抗原修复。而冷冻组织切片相较于石蜡组织切片而言,其制片非常快速,抗原保存完好,而且切片染色可以满足病理诊断的要求;冷冻组织切片由于当天即可完成免疫组织化学染色,可以帮助医生与科研人员在尽可能短的时间内得出结论,因此该方法在医院临床实践以及科研工作中都具有一定的优势。
本实验通过比较针对冷冻组织切片的不同固定条件与保存时长对免疫组织化学信号的影响,探索多组样本量情况下冷冻组织制片操作与存储中可灵活调整的时间段,优化针对同一样本多种生物标志物检测的制片规划,减少多次制片引起的反复冻融而导致冷冻样本遭受不可逆的形态损伤与抗原丢失问题。
醛类固定液会使蛋白质发生交联[8],而乙醇通过沉淀蛋白发挥固定作用,同时兼有脱水作用[9],因此10%中性甲醛溶液与AAF混合溶液均是医院与各科研院所广泛使用的针对冰冻细胞与组织切片的固定试剂。经过短时间的固定液处理,用10%中性甲醛溶液固定的冷冻切片中的细胞形态与免疫组织化学染色信号强度相比于用AAF混合溶液固定过的样品更为清晰,更有利于研究者在光学显微镜下进行判读打分。
冷冻组织切片中未经固定的磷酸化蛋白降解非常迅速。本实验对p-HER2抗原的稳定性进行了分析,发现在冷冻组织制片5~20 min采用10%中性甲醛溶液固定后,检测到的p-HER2免疫组织化学染色信号强度与新鲜切片没有明显差异;而在冷冻制片经过30 min后再进行固定的切片中,检测到的p-HER2免疫组织化学染色信号明显减弱。本研究发现p-HER2在20 min内拥有良好的抗原稳定性,这为日常工作中大批量冷冻样品制片提供了一定的灵活操作时间。
综上所述,利用冰冻组织切片进行免疫组织化学染色的可操作性强,需要染色时间短,在提高工作效率的同时不影响染色结果的判读,可以考虑将其作为常规石蜡切片染色方法的补充或者替代。然而,冷冻组织切片未经固定即暴露于外界,不仅组织形态容易遭受损伤,组织抗原信号也会降解甚至消失。本研究发现,冷冻组织制片后5~20 min,经过10%中性甲醛溶液充分固定后的组织形态结构清晰,p-HER2蛋白稳定性较好,而且-20 ℃条件下保存3个月之内仍可以较好保存其抗原性,这一发现对实际检测工作具有一定的价值。
