红花檵木两个查尔酮合成酶的克隆及生物信息学分析
2020-11-27李彩虹荣朵艳廖晓珊张邦跃
李彩虹 ,荣朵艳 ,廖晓珊, ,张邦跃
(1.湖南工业大学 生命科学与化学学院,湖南 株洲 412007;2.湖南工业大学 百合种质资源创新与深加工湖南省工程研究中心,湖南 株洲 412007;3.株洲市农业科学研究所,湖南 株洲 412007)
1 研究背景
红花檵木(Loropetalum chinensevar.rubrum)整株富含红色花青苷物质,观赏价值高,是我国南方地区常用的园林绿化植物[1-2]。1905年Molish 首次发现了花青苷晶体,花青苷是由花色素与各种糖形成的糖苷,它的基本结构是3,5,7-三羟基-2-苯基苯并吡喃。花青苷的生物合成途径在矮牵牛(Petunia hybrida Vilmorin)、金鱼草(Antirrhinum majusL.)、葡萄(Vitis viniferaL.)等模式植物上已经取得了较大的进展。花青苷元的合成是花青苷生物合成的核心。目前,花青苷在植物体内的合成途径已经基本明确,其合成途径是类黄酮物质合成的一个分支。红花檵木中,花青苷物质也是决定其观赏价值的关键因素,在植物的花、叶、果皮等组织的着色过程中起着重要作用,同时也参与植物响应生物与非生物胁迫过程[3]。因此,通过开展红花檵木的花青苷物质合成研究,不仅对深入了解红花檵木花青苷的合成途径提供依据,而且也对促进红花檵木的育种具有现实意义。在植物花青苷生物合成过程中,查尔酮合成酶(chalcone synthase,CHS)是第一个限速酶,催化底物4-香豆酰CoA 和丙二酰-CoA 发生反应,包括了三个步骤的反应过程:底物的加载反应、丙二酰基脱羧反应和3 次聚酮化合物延伸反应,从而环化形成花青苷物质的基本骨架[4-5]。
目前,科研工作者已经对很多植物中CHSs 的生物学功能进行了研究,特别是其在花青苷物质生物合成过程中的功能取得了较多的研究成果。CHS 作为花青苷合成途径的第一个关键酶类,对花青苷物质的积累是必需的。在发生基因共抑制(cosuppression)或自然沉默的矮牵牛(Petunia hybrida)中,PhCHS-A基因在花朵部分区域的表达受到抑制,PhCHS-A受抑制的部分区域不合成花青苷而显白色,从而形成双色花[6]。利用嘧螨脂能够抑制矮牵牛PhCHS-A的转录后沉默,从而促进花朵中花青苷物质的合成[7]。对双色花的大丽花(Dahlia variabilis)的研究也表明,DvCHS2 基因在花朵部分区域发生了转录后沉默(post-transcriptional gene silencing,PTGS),从而造成同一朵花形成红白双色花,而在富含类黄酮叶片中DvCHS2 基因的表达量也远远高于那些低类黄酮含量的叶片[8]。通过RNAi 下调蓝猪耳(Torenia hybrida)的ThCHS基因的表达,花朵的颜色由蓝色变为浅色或白色[9]。干扰苹果(Malus×domestica)中MdCHSs基因的表达,转基因株系的茎、花瓣及果皮中不能生成花青苷而表现为绿色,同时二氢查尔酮和类黄酮含量也在转基因株系中急剧降低[10-11]。利用病毒诱导基因沉默(virus induced gene silencing,VIGS)技术瞬时干扰猕猴桃中AeCHS基因的表达,AeCHS基因表达下调的花瓣颜色变浅、花青苷含量降低[12]。此外,海棠(Malus crabapple)的McCHS[13]、香雪兰(Freesia hybrid)的FhCHS1[14]和紫丁香(Syringa oblataLindl.)的SoCHS[15]也与相应植物中花青苷物质的积累紧密相关,这些基因的异源过表达可导致转基因植株花朵颜色变深。
本文基于红花檵木叶片转录组测序数据,筛选到两个CHS同源基因,分别命名为LcCHS1 和LcCHS2。其中LcCHS1 与之前报道的LcvrCHS1 的核苷酸序列一致性很高[16],但LcvrCHS1 只有本文中LcCHS1 的部分ORF(open reading frame,ORF)序列,且LcvrCHS1 基因的推导氨基酸缺乏CHS 酶的特征序列(“GVLFGFGPGL”)。通过对转录组测序结果分析所筛选到的LcCHS1 和LcCHS2 基因的克隆及生物信息学分析,将有利于提升对红花檵木花青苷生物合成机制的了解,为进一步开发红花檵木的经济价值以及红花檵木品种的改良创造条件。
2 材料与方法
2.1 试验材料
供试红花檵木为多年生扦插苗,种植于湖南工业大学校园内;植物多糖多酚总RNA 提取试剂盒,购自北京艾德莱生物科技有限公司;PrimeSTAR GXL DNA 高保真酶和M-MuLV 逆转录酶,购自宝日医生物技术有限公司。
2.2 RNA 提取和第一链cDNA 合成
利用植物多糖多酚总RNA 提取试剂盒,按照试剂盒上的提取方法提取红花檵木叶片(50~100 mg/次)的总RNA,并以总RNA 为模板,利用Oligo dT18引物及M-MuLV 逆转录酶,在42 ℃下延伸1 h 合成第一链cDNA,并置于-20 ℃冰箱备用。
2.3 LcCHS1 和LcCHS2 基因克隆
基于已经完成的红花檵木转录组测序结果,利用其注释数据从中筛选到两个查尔酮合成酶CHS 同源基因序列,分别命名为LcCHS1 和LcCHS2。这两个基因的转录组测序结果序列中都包含了完整的开放阅读框(ORF),其中LcCHS1 基因的ORF为1 170 bp,LcCHS2 基因的ORF 为1 182 bp。利用Primer Premier 5.0 软件分别设计LcCHS1 和LcCHS2 基因ORFs 序列上、下游特异引物CHS1-F(5’-GCACCTCATTTCTCTCTTCT-3’)、CHS1-R(5’-TTTTGACTTTCCGACAGCCT-3’)、CHS2-F(5’-AGAAGATAAAGAGAGTGAAGCAG-3’)和CHS2-R(5’-TCATGAACTAATAATGAGCCATG AC-3’),以第一链cDNA 为模板,利用高保真酶扩增LcCHS1 和LcCHS2 的cDNAs 片段。PCR 体系为25 μL,扩增程序为:预变性95℃ 2 min;98℃ 10 s,55℃ 15 s,68℃ 90 s,进行35 个循环;72℃延伸5 min,10 ℃保存。PCR 产物送测序公司进行第一代测序反应,以确定LcCHS1 和LcCHS2 基因的编码框。
2.4 生物信息学分析
利用DNAMAN 软件对LcCHS1 和LcCHS2 基因的ORFs 及编码氨基酸序列进行分析,获得基因的核苷酸及氨基酸对应表;采用NCBI-BLASTP(http://blast.ncbi.nlm.nih.gov/Blast.cgi) 对2 个LcCHSs 同源序列进行搜索,获得氨基酸的同源序列,利用DNAMAN 软件对LcCHSs 与其他植物CHS 同源氨基酸序列进行多序列比对,并分析氨基酸序列中的催化位点及关键结构域;利用MEGA6 软件和邻接法(neighbor-joining method)进行LcCHSs 与多种双子叶及单子叶植物CHS 同源氨基酸的系统进化树构建;利用SWISS-MODEL 在线网站(https://swissmodel.expasy.org/)对LcCHSs 蛋白质三级结构进行建模,并对2 个同源蛋白的结构相似性进行分析。
3 结果与分析
3.1 LcCHS1 和LcCHS2 基因序列分析
以红花檵木的cDNA 为模板,CHS1-F 和CHS1-R 为引物进行PCR 扩增反应扩增LcCHS1 基因的cDNA 序列,CHS2-F 和CHS2-R 为引物扩增LcCHS2 基因的cDNA 序列,产物用1%的琼脂糖凝胶电泳检测,LcCHS1 和LcCHS2 的cDNAs 产物大小分别为1 357 bp 和1 242 bp(图1,其中,M,Marker;带1,LcCHS1 cDNA 的PCR 产物;带2,LcCHS2 cDNA 的PCR 产物),且cDNAs 片段均包含了完整的ORFs 序列。图2为LcCHSs 基因的核苷酸序列及其推导氨基酸序列图。

图1 LcCHS1 和LcCHS2 基因的PCR 扩增图Fig.1 PCR amplification picture of LcCHS1 and LcCHS2 genes


图2 LcCHSs 基因的核苷酸序列及其推导氨基酸序列Fig.2 Nucleotide sequence with its deduced amino acid sequence of LcCHSs gene
对LcCHS1 和LcCHS2 基因的ORFs 序列进行分析表明,LcCHS1 的ORF 全长为1 170 bp,编码389个氨基酸(图2a);LcCHS2 的ORF 全长为1 182 bp,编码393 个氨基酸(图2b)。
3.2 同源性比对及系统进化树构建
利用DNAMAN 软件, 将红花檵木LcCHS1和LcCHS2 的氨基酸序列与其他植物CHSs 进行氨基酸多序列比对,结果如图3所示。其中,三角形标记处代表三元催化残基“Cys164、His303 和Asn336”;方框代表CHS 功能活性部位“RLMMYQQGCFAGGTVLR”和CHS 家族特征序列“GVLFGFGPGL”。

图3 LcCHSs 与其他植物CHSs 氨基酸多序列比对Fig.3 Multiple alignment analysis of LcCHSs with other plant CHSs
红花檵木LcCHS1 和LcCHS2 之间的氨基酸序列一致性为89.3%。同时,红花檵木LcCHS1和LcCHS2 与多种植物CHSs 氨基酸序列具有非常高的序列一致性,LcCHS1 和LcCHS2 与茶树CsCHS2(Camellia sinensis,XP_028080516.1)、葡萄VvCHS(Vitis vinifera,AEP17003.1)、拟南芥AtCHS(Arabidopsis thaliana,AAB35812.1)、烟草NtCHS(Nicotiana tabacum,NP_001312634.1)氨基酸序列一致性均超过83%。将氨基酸序列与以前的研究结果[16]进行比较分析,表明在LcCHS1和LcCHS2 的氨基酸序列中,参与催化的3 个残基(Cys164、His303 和Asn336)严格保守。同时,2 个LcCHSs 均包含有保守的CHS 酶功能活性位点“RLMMYQQGCFAGGTVLR”(156~172)和CHS酶特征序列“GVLFGFGPGL”(368~377)。
利用MEGA6 和邻接法,并将bootstrap 设置为1 000 次重复,对LcCHSs 和多种双子叶植物以及单子叶植物的CHSs 蛋白进行系统进化树构建,具体包括茶树CsCHS2、葡萄VvCHS、拟南芥AtCHS、烟草NtCHS、核桃JsCHS(Juglans sigillata,ASU91339.1)、榴莲DzCHS1(Durio zibethinus,XP_022721946.1)、毛果杨PtCHS1(Populus trichocarpa,XP_002303821.2)、矮牵牛PhCHS-A(Petunia hybrida,P08894.1)、牡丹PsCHS(Paeonia suffruticosa,AEK70333.1)、芍药PlCHS(Paeonia lactiflora,AEK70334.1)、玉米ZmCHS(Zea mays,NP_001142246)、水稻OsCHS(Oryza sativa,BAB39764.1)、小麦TaCHS(Triticum aestivum,AAQ19321.1)。如图4所示,2 个LcCHSs 在系统进化上与双子叶植物CHSs 蛋白的亲缘关系较近,与单子叶植物的CHSs 蛋白的亲缘关系较远。其中红花檵木的LcCHS1 蛋白与来源于茶树和葡萄的CHSs 蛋白的亲缘关系较近,LcCHS2 蛋白与来源于牡丹和芍药的CHSs 蛋白的亲缘关系较近。
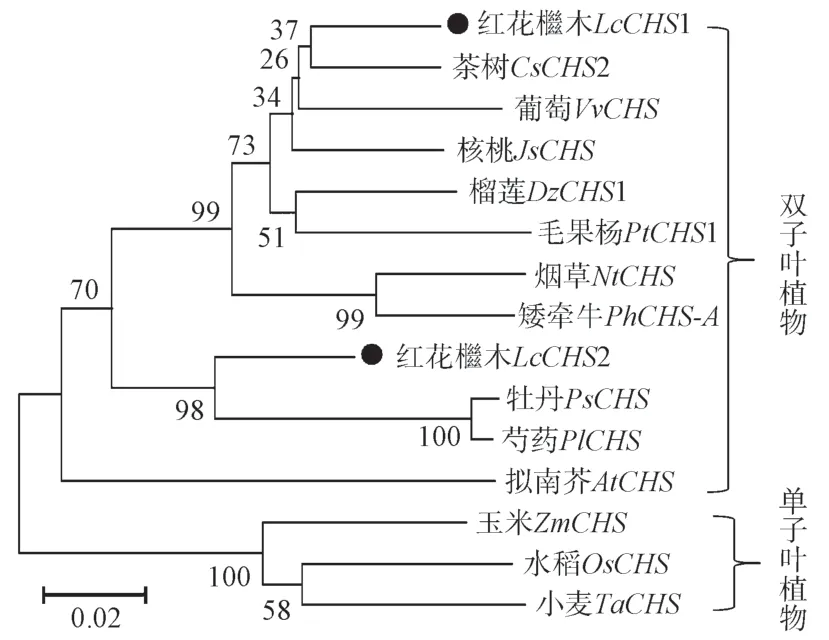
图4 LcCHSs 系统进化树分析Fig.4 Phylogenetic tree analysis of LcCHSs
3.3 LcCHSs 蛋白三级结构预测
利用SWISS-MODEL 在线软件对红花檵木的LcCHS1 和LcCHS2 蛋白进行三级结构预测,以拟南芥AtCHS蛋白的晶体结构为模型,进行红花檵木LcCHSs 的三级结构建模,结果如图5所示。


图5 LcCHSs 蛋白三级结构预测结果Fig.5 Tertiary structure prediction of LcCHSs protein
LcCHS1 能够形成同源二聚体,且预测的催化活性部位位于二聚体的外侧(图5),LcCHS2 蛋白也形成同源二聚体形式。LcCHS1 蛋白单体与LcCHS2蛋白单体的三级结构高度相似,其多肽链空间结构高度重叠,表明2 个LcCHSs 蛋白功能的保守性。
4 试验结果讨论
CHS 是类黄酮生物合成途径的第一个限速酶,其活性影响着多种类黄酮物质的生物合成,因此CHS 基因对于植物花色形成、植物生长发育及抗性形成都会产生影响[6-10,17]。利用自然或转基因材料研究,已证实了来源于矮牵牛、大丽花、苹果、猕猴桃等植物的CHSs 在花青苷物质的合成过程中有重要的作用[6-15]。CHS 基因表达变化会影响类黄酮物质的合成,从而改变植物细胞对生长素的转运能力、影响植株的生长发育及对生长素类除草剂的抗性[9-10,18],影响了细胞的扩张[19]及木本植物中木质部的形成[20]。CHS 基因还参与了植物对非生物胁迫抗性的建立,例如紫茎泽兰的EaCHS1 参与抗盐性的形成[21],桑葚的CHS 基因参与耐盐、耐热及耐旱性的形成[22]。
本研究克隆了2 个红花檵木LcCHSs 基因,分别编码389 和393 个氨基酸,2 个LcCHSs 氨基酸序列一致性非常高,达89%。2 个LcCHSs 的氨基酸长度与多种植物的CHSs 相近,例如茶树CsCHS2(389 个氨基酸)、葡萄VvCHS(389 个氨基酸)、烟草NtCHS(389 个氨基酸)、拟南芥AtCHS(395 个氨基酸),且氨基酸序列一致性均超过83%。同时,氨基酸序列中参与催化的3 个残基(Cys164、His303 和Asn336)、两段CHS 重要序列“RLMMYQQGCFAGGTVLR”(156~172)和“GVLFGFGPGL”(368~377) 都在两个LcCHSs中高度保守,这表明了两个LcCHSs 功能的保守性。在之前的研究中,已经有LcvrCHS1 蛋白的报道(GenBank:AFG25049.1),其氨基酸全长为232,该蛋白缺乏CHS 的特征序列“GVLFGFGPGL”,经过序列比对,证实LcvrCHS1 为本文LcCHS1(389个氨基酸)的部分序列,这可能是由于利用RACE技术进行LcvrCHS1 的cDNA 扩增时没有完全扩增到两端,或者是由于mRNA 发生了可变剪切,造成了编码框的改变。
系统进化树分析结果表明,红花檵木两个LcCHSs 分别与不同植物CHSs 的亲缘关系较近,但考虑到两者之间氨基酸序列的一致性很高,且通过三级结构建模也证实了两者蛋白空间结构非常相似,推测LcCHS1 和LcCHS2 蛋白可能存在功能冗余。但两个LcCHSs 在红花檵木花青苷生物合成的功能还需要进一步研究,特别是基因的时空表达及响应环境的表达差异。在植物中,CHS 基因的表达受到多种内、外在因子的诱导,例如JA(jasmonic acid)、ABA(abscisic acid)、SA(salicylic acid)、紫外线B、干旱、低温等[21-27],这是由于类黄酮在植物响应并抵御生物或非生物胁迫中起重要作用,而作为类黄酮生物合成的第一个关键酶往往会被快速诱导表达。同时,为了能更好地了解LcCHS1 和LcCHS2的功能,还需要对基因的体内调控机制开展研究,包括转录调控、转录后调控和翻译后调控,例如海棠中的转录因子McMYB4/5 可能参与McCHS 的活性转录调控[13],矮牵牛和大丽花的小RNAs 介导了PhCHS-A 和DvCHS2 的转录后调控[6,8],而蛋白水解酶KFBCHS 调控CHS 蛋白质翻译后的降解进程[28]。通过对LcCHS1 和LcCHS2 响应内外因子的表达特征分析、以及体内分子调控机制的研究,将能够更好地了解这两个LcCHSs 基因在红花檵木叶色形成、响应环境变化及生长发育中的作用。
