胃肠道间质瘤胰岛素样生长因子1受体表达水平与伊马替尼耐药的相关性
2020-11-25王炯元童汉兴侯英勇陆维祺
王炯元, 童汉兴, 姜 铨, 侯英勇, 陆维祺*
1. 复旦大学附属中山医院普通外科,上海 200032 2. 复旦大学附属中山医院病理科,上海 200032
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)起源于Caja细胞,是消化系统最常见的间叶源性肿瘤,占胃肠道肿瘤总数的1%~4%,每年发病率约为2/10万[1-2]。GIST可发生在消化系统的任何部位,其中以胃(60%)和小肠(30%)最常见[3-4]。肝转移和腹腔播散是GIST临床上最常见的恶性表现,淋巴结转移少见。c-Kit基因及血小板衍生生长因子受体α(platelet-derived growth factor receptor alpha,PDGFRα)基因的功能获得性突变是GIST发病的主要机制[5]。75%~80%GIST存在c-Kit基因突变,5%~10%GIST伴PDGFRα基因突变[6],10%~15%GIST既无PDGFRα基因突变也无c-Kit基因突变,被称为野生型GIST。一部分野生型GIST患者伴SDH基因改变,被称为SDH缺陷型,也有极少数病例存在NF-1、BRAF等其他基因的罕见突变[7]。
甲磺酸伊马替尼(imatinib mesylate,IM)是一种选择性酪氨酸激酶抑制剂,自2002年获得美国FDA批准以来,已成功应用于治疗转移性和(或)无法切除的GIST患者,同时也用于高危复发风险患者的术后辅助治疗。随着药物的临床应用,其耐药问题也日益彰显,10%~15%患者存在原发耐药,40%~50%患者在2年内出现继发性耐药[8]。SDH缺陷型GIST患者多表现为原发耐药。继发性耐药的可能机制则包括c-Kit和PDGFRα基因的二次突变、基因扩增、下游信号通路的异常活化、IM血药浓度及细胞内药物浓度的改变等[9]。IM耐药机制尚未被完全阐明,可能是多个机制共同作用的结果。因此,IM耐药是目前GIST临床治疗的难点,也是当下临床研究的热点。
胰岛素样生长因子家族(insulin-like growth factors,IGFs)由胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)、胰岛素样生长因子2(insulin-like growth factor 2, IGF-2)、胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF1R)、胰岛素受体(insulin receptor,IR)及6个胰岛素生长因子结合蛋白(IGF-binding proteins,IGFBPs)组成[10]。IGFs在细胞分化、增殖及个体的生长发育中具有重要的促进作用[11-12],也与肿瘤形成及发展密切相关。Tarn等[13]报道,野生型GIST中IGF1R的表达高于c-Kit/PDGFRα突变型标本,提示IGF1R可能是原发性耐药患者的潜在治疗靶点。因此,本研究回顾性分析复旦大学附属中山医院收治的134例GIST组织IGF1R的表达水平与IM耐药的关系,探讨IGF1R对IM耐药GIST患者预后的潜在价值。
1 资料与方法
1.1 一般资料 收集2008年1月至2014年1月复旦大学附属中山医院普通外科收治的经病理确诊的GIST患者的临床及病理资料。将所有病例术后组织石蜡切片制作组织芯片用于免疫组化染色。患者出院后通过门诊及电话随访患者生存情况。本研究患者均知情同意且签署知情同意书。
1.2 免疫组化法检测组织芯片中IGFR蛋白的表达 IGFR检测采用免疫组织化学法。组织芯片使用二甲苯脱蜡,梯度乙醇溶液(无水、95%、75%)脱水,TBS冲洗。柠檬酸抗原修复液处理后加入3%双氧水阻断其内源性过氧化物酶。冲洗后用10%山羊血清孵育30 min。移去血清,滴加按1∶150稀释的兔抗人多克隆IGF1R抗体(Abcam公司,美国)4℃孵育。冲洗后滴加生物素标记二抗(EnVision抗兔IgG试剂盒,Dako公司,丹麦),室温孵育30 min后移去二抗,滴加新鲜配制的DAB显色并使用苏木精对比染色。梯度乙醇溶液脱水,二甲苯透明,封片剂封片后镜检。
1.3 免疫组化结果判读 以染色强度结合阳性细胞数百分比综合计分,组织切片中胞质染为淡黄色至棕褐色者为阳性细胞。染色强度以多数细胞呈现的染色特性(染色深浅需与背景着色相对比)计分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分比即光学显微镜下随机取5个高倍视野(×400),每个视野中计数100个肿瘤细胞,取阳性细胞平均数:0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。染色结果为染色强度与阳性细胞百分比的乘积:0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(),9~12分为强阳性()。评分<5分为IGF1R低表达,≥5分为IGF1R高表达,以上结果由2位有经验的病理科医生完成。
1.4 统计学处理 采用SPSS 24.0分析数据。计数资料采用χ2检验,采用Kaplan-Meier绘制生存曲线,生存分析的组间比较采用log-rank检验,采用Cox风险比例回归模型对IM耐药患者行预后危险因素分析。检验水准(α)为0.05。
2 结 果
2.1 GIST患者不同临床病理特征下IGF1R蛋白表达差异 结果(表1)显示:GIST组织IGF1R蛋白表达水平在不同性别、年龄、肿瘤大小、原发部位、核分裂相、突变基因、NIH危险度分级组间表达差异无统计学意义;IM耐药患者GIST组织IGF1R蛋白的表达率(73.08%)高于非IM耐药患者(41.67%),差异有统计学意义(χ2=8.286,P=0.004),提示IGF1R高表达可能与GIST患者IM耐药相关。图1示GIST标本病理结果。

表1 不同IGF1R蛋白表达水平GIST患者临床病理特征的对比 n(%)
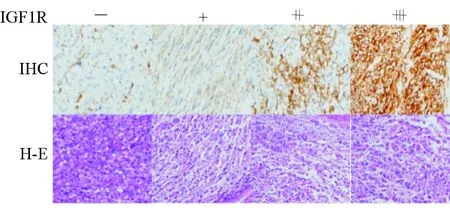
图1 GIST组织不同IGF1R蛋白表达水平的免疫组化及H-E染色
2.2 生存分析 中位随访64.5(1~96)个月,134例患者中9例患者失访,27例患者死亡。26例IM耐药患者中2例失访,12例死亡。26例IM耐药患者预后风险的单因素分析结果(表2,图2)显示:IGF1R的表达水平与总生存时间相关,IGF1R高表达患者总生存时间短于IGF1R低表达患者(35.3vs71.3个月,P=0.04)。多因素分析结果(表3)表明:肿瘤原发部位、IGF1R表达水平是影响IM耐药患者总生存时间的独立危险因素。

表2 IM耐药GIST患者预后的单因素分析
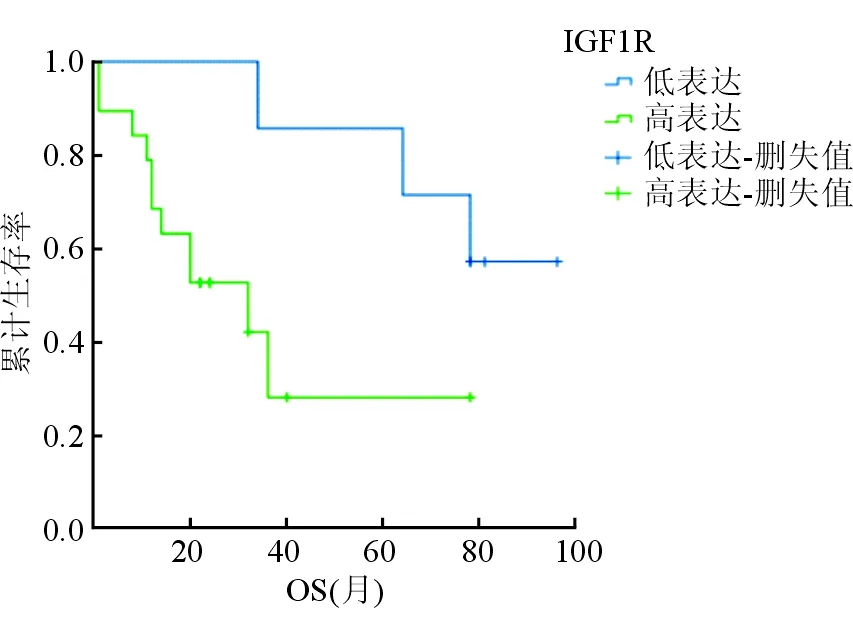
图2 不同IGF1R表达IM耐药GIST患者预后分析
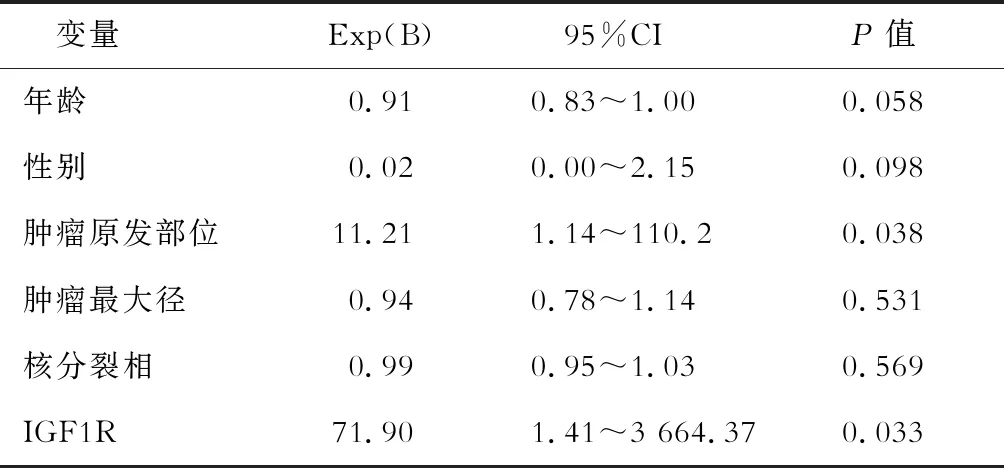
表3 IM耐药GIST患者预后的多因素分析
3 讨 论
IGF1R是一种跨膜受体酪氨酸激酶,可结合其配体IGF-1和IGF-2而被激活,并通过活化下游信号通路,包括磷脂酰肌醇3激酶-蛋白质丝氨酸苏氨酸激酶(PI3K-Akt)信号通路及丝裂原活化蛋白激酶(MAKP)通路,发挥生物学效应。近年来,IGFs在GIST发生发展中的作用也引起了关注。Tarn等[13]报道相对于c-Kit/PDGFRα突变型GIST,野生型GIST中IGF1R的表达显著升高,而野生型GIST往往表现为原发性耐药。而IGF1R是否参与了胃肠道间质瘤IM耐药目前尚不清楚。
本研究中,在IM耐药患者GIST组织IGF1R蛋白表达显著高于非耐药患者,由此推测IGF1R可能参与IM耐药的产生。Codony-Servat等[14]研究发现,在转移性结直肠癌中细胞核IGF1R的高表达可能导致化疗及靶向药物耐药的产生。近年来多个针对IGF1R的靶向药物已陆续进入临床试验,现有证据表明目前抗IGF1R治疗最大的作用在于预防或逆转传统治疗耐药。并且相较于单独应用,抗IGF1R治疗联合化疗或靶向治疗能增加获益[15]。Chen等[16]在IM耐药细胞系(GIST430和GIST48)中使用linstinib(一种IR/IGF1R抑制剂)与IM联合治疗,分别导致IM GIST430和GIST48的生存力降低60%和80%;而在IM敏感的GIST882细胞系中联合治疗与IM单药的效果相当。因此,IGF1R可作为IM耐药病例的潜在治疗靶点。本研究中,针对26例IM耐药患者的生存分析提示,IGF1R高表达患者总生存时间显著缩短,推测在IM耐药患者中IGF1R可作为预后不良的标志。同时,多项临床试验发现,IGF1R高表达的患者能从抗IGF1R治疗中获益。Asmane等[17]发现在使用抗IGF1R治疗的肉瘤患者中,IGF1R的核定位增加与良好的生存预后显著相关,提示IGF1R的表达或可成为筛选患者及监测治疗反应的潜在生物学标志物。
综上所述,本研究发现,IM耐药患者GIST组织中IGF1R的表达显著增高,IGF1R高表达患者的总生存时间短于IGF1R低表达患者,提示IGF1R参与GIST IM耐药的同时,或可作为IM耐药患者的预后判断指标,并且可能是IM耐药患者的潜在治疗靶点。
