单羧酸转运蛋白4在胰腺癌中的表达及临床预后价值
2020-11-25徐帅帅叶龙云虞先濬徐华祥
徐帅帅, 李 硕, 李 浩, 叶龙云, 刘 亮, 虞先濬, 徐华祥
复旦大学附属肿瘤医院胰腺外科,上海市胰腺肿瘤研究所,上海 200032
胰腺癌是恶性度极高的消化道肿瘤之一。根治性手术是胰腺癌患者获得长期生存的唯一手段,但其术后5年生存率仅20%,其中术后高复发率是胰腺癌患者术后预后不良的主要因素[1-2]。因此,探寻新的指标监测胰腺癌术后复发状态显得尤为重要。单羧酸转运体(monocarboxylate transporter,MCT)属于溶质运载蛋白家族(solute carrier family,SLC)16A 亚家族的成员。MCTs主要通过调控糖酵解过程中产生的乳酸、丙酮酸、丁酸、脂肪酸等一元羧酸类物质在细胞膜上的跨膜转运,实现提高肿瘤细胞的糖酵解能力和维持肿瘤周围的酸性微环境的功能[3]。MCT4在胃癌、前列腺癌和宫颈癌中均有显著表达,并参与了肿瘤恶性进展的过程[4]。本研究通过分析MCT4在胰腺癌组织中的表达分布与水平,以及其与临床病理特征之间的关系,为胰腺癌术后复发高风险人群的筛选和术后治疗策略的制定提供潜在方法。
1 资料与方法
1.1 一般资料 回顾性收集2010年2月至2014年6月在复旦大学附属肿瘤医院胰腺外科(上海市胰腺肿瘤研究所)接受根治性切除的441例胰腺癌患者的临床资料,依据以下排除标准纳入379例。(1)临床病理资料和随访资料不全(n=9);(2)术前接受抗肿瘤治疗 (n=41);(3)既往其他恶性肿瘤史 (n=12)。本研究所的数据库登记了所有入组患者的临床病理特征、治疗方式及随访数据。本研究经由复旦大学附属肿瘤医院伦理委员会批准,所有患者签署了知情同意书。
1.2 患者随访 依据本研究所胰腺癌术后随访的标准流程,每例患者在术后均接受常规随访至肿瘤复发或死亡[5]。患者术后至少每2个月来院例行体格检查和实验室检查。如果怀疑存在肿瘤复发风险,就建议患者行影像学检查(上腹部增强计算机辅助影像、上腹部增强磁共振、骨扫描和正电子计算辅助影像)。总体生存(overall survival,OS)时间定义为从患者手术日至术后死亡或最后1次随访之间的时间段;无复发生存(recurrence-free survival,RFS)时间定义为从患者手术日至术后复发或最后1次随访之间的时间段。本组胰腺癌患者术后的中位生存时间约为17个月,术后最后1次随访时间超过17个月。
1.3 免疫组化 在由甲醛固定和石蜡包埋的组织切片上,采用二甲苯逐级脱蜡和梯度乙醇逐级水化,运用柠檬酸进行抗原修复,并采用MCT4抗体(ab244385,1∶100稀释,Abcam公司)孵育和生物素标记的二抗进行显色。应用莱卡摄像机摄取免疫组化染色切片图片,并用与此摄像机连接的莱卡DM IRE2显微镜(莱卡显微图片拍摄系统,英国),将每个病例的免疫组化染色切片在200倍镜下分别选取3个代表性区域 (主要由肿瘤实质细胞组成,避开坏死组织区域),判断组织染色情况。阳性判定标准:>10%的肿瘤细胞呈现胞质或质膜褐色染色。免疫组化染色结果由2名临床医师独立综合判断;若判定结果存在分歧,由2名临床医师商定。
1.4 统计学处理 采用SPSS 13.0统计软件录入数据并进行统计分析。数据经过正态性检验和方差齐性检验后,使用非配对t检验(双侧)和卡方检验验证统计学差异。采用log-rank检验对比MCT4阳性表达与阴性表达组患者之间的生存差异。将Cox单因素分析中差异有统计学意义的指标纳入多因素Cox回归分析模型,分析OS和RFS时间的独立预测因子。检验水准(α)为0.05。
2 结 果
2.1 379例胰腺癌临床病理特征与预后情况 379例患者中,男性218例,年龄33~84岁(中位61岁),222例肿瘤位于胰头,肿瘤最大径0.5~11.5 cm (中位4.0 cm)。176例肿瘤存在淋巴结转移,141例肿瘤病理分级为低分化,72例肿瘤存在脉管侵犯,321例肿瘤存在神经侵犯,300例患者术前血清糖类抗原19-9(CA19-9)水平异常升高。截至最后1次随访,325例患者复发,其中294例死于肿瘤复发。中位OS和RFS时间分别为17.0个月和9.5个月;1年和3年OS率分别为61.4%和24.8%,1年和3年RFS率分别为37.1%和13.8%。
2.2 MCT4在胰腺癌组织中的表达及其与临床病理特征的关系 MCT4主要在胰腺癌细胞的胞质和质膜上表达,在癌细胞周围的间质细胞中也有散在表达,在正常胰腺组织中为阴性表达(图1)。MCT4在208例患者的胰腺癌组织中呈现阳性染色。结果(表1)表明,MCT4阳性表达患者的肿瘤最大径更大(P=0.004)、淋巴结转移率更高(P=0.005)、TNM分期更高(P=0.011)。

图1 MCT4在胰腺癌及正常胰腺组织中的表达
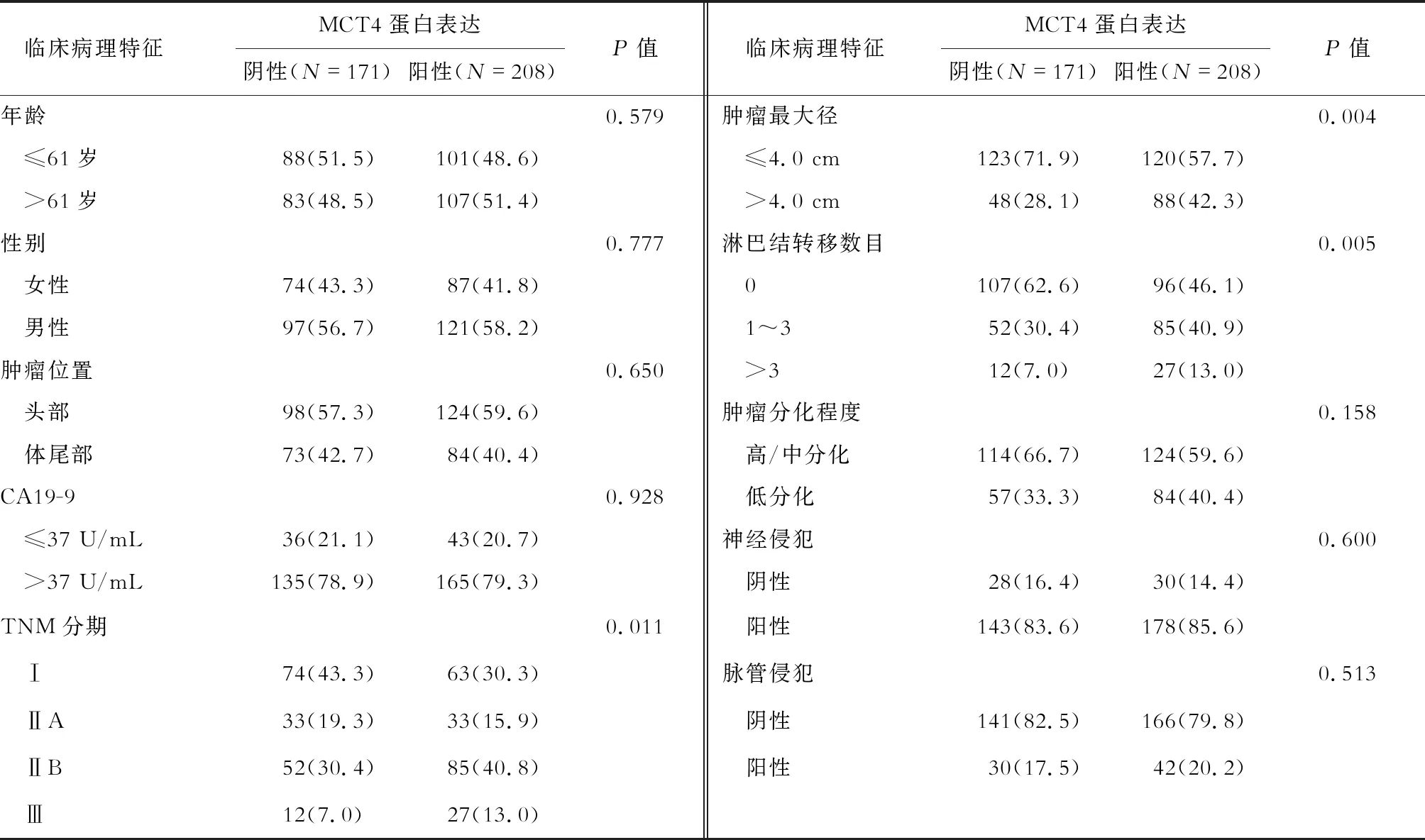
表1 胰腺癌组织中MCT4表达与临床病理特征的关系 n(%)
2.3 生存时间的影响因素 单因素Cox回归分析(表2,表3)表明,CA19-9水平升高、较大的肿瘤最大径、淋巴结转移、高TNM分期和MCT4阳性表达是胰腺癌患者OS和RFS的危险因子(P<0.05)。MCT4阳性患者的中位OS (12.4个月)和RFS(7.3个月)时间显著短于MCT4阴性患者(21.3个月,P<0.001;11.4个月,P<0.001)。多因素Cox回归分析(表2,表3)显示,MCT4阳性表达是胰腺癌患者OS和RFS的独立危险因子之一(P<0.001)。
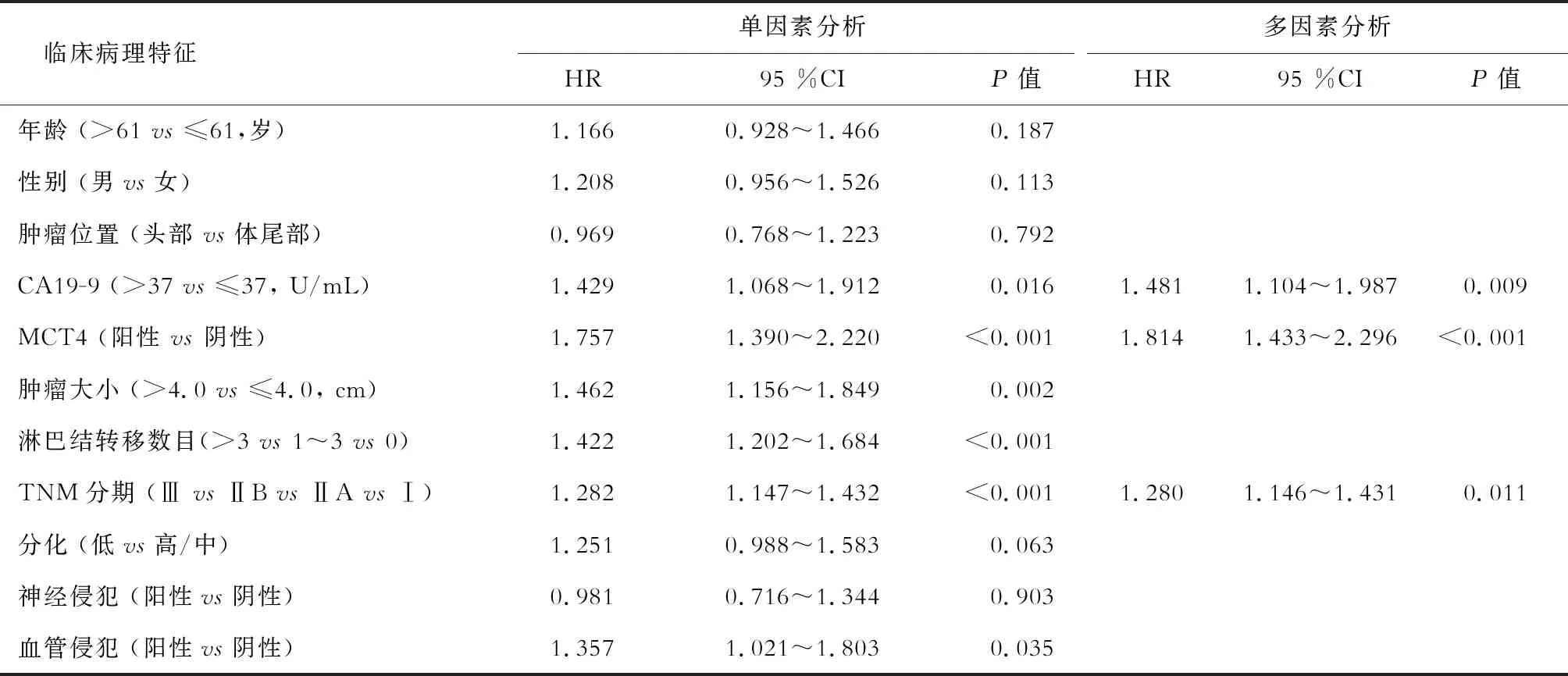
表2 胰腺癌患者OS时间的影响因素分析

表3 胰腺癌患者RFS时间的影响因素分析
3 讨 论
代谢重编程是肿瘤细胞的重要生物学特征之一。肿瘤细胞通过代谢重编程方式提高糖酵解代谢的能力并分泌大量的乳酸。MCTs参与各种单羧酸物质在细胞膜上的转运,包括乳酸、丙酮酸和酮。肿瘤细胞通过MCTs将细胞内的大量乳酸跨膜转移至细胞外,从而避免细胞内酸化导致的凋亡[6]。MCTs家族共包括14个成员,其中MCT1~4主要参与乳酸的转运[7]。MCT4主要在糖酵解代谢中通过pH梯度参与乳酸的跨膜转移[4]。本研究发现,MCT4在胰腺癌细胞上显著异常表达,且与肿瘤最大径、淋巴结转移和TNM分期相关,是胰腺癌患者术后OS和PFS的独立危险因子之一。
本研究中,MCT4在54.9%(208/379)的胰腺癌患者中呈现异常高表达,并且明显高于周围正常胰腺组织。缺氧是肿瘤细胞上调MCT4表达的主要机制,而胰腺癌是典型的乏氧性恶性肿瘤[8],并且恶性程度随着肿瘤最大径的增加而加剧。本研究结果支持这一结论。既往研究证实,在多种恶性肿瘤中,MCT4异常表达后参与糖酵解代谢。例如,在肝癌细胞中,下调MCT4表达可抑制肝癌细胞的糖酵解代谢[9]。MCT4在存在糖酵解代谢负荷的胰腺癌(常较大或有淋巴结转移)中更易异常表达。因此,MCT4可能是一些恶性肿瘤糖酵解代谢的特征指标之一。此外,MCT4异常表达还可通过导致癌细胞周围酸性环境和诱导促炎分子释放,参与形成促癌转移的肿瘤微环境[10]。
综上所述,MCT4异常表达可预测乳腺癌、肺癌和食管癌等多种恶性肿瘤患者的不良预后。本研究证实,MCT4异常表达的胰腺癌患者根治性切除术后复发时间和生存时间均较短。在肺癌细胞中,靶向MCT4的抑制剂可显著下调乳酸转运和糖酵解代谢水平,阻止细胞增殖与侵袭转移[11]。同样,MCT4表达的调控可促进胰腺癌细胞的侵袭与转移[12]。因此,MCT4可作为监测胰腺癌患者术后预后的指标,同时可作为潜在的治疗靶点,但还需要进一步证实。
