柔肝化纤颗粒促进BMSC向肝脏归巢及其机制研究*
2020-11-25吴姗姗王振常吕艳杭
吴姗姗,黎 妍,王振常,吕艳杭
(1. 广西中医药大学研究生学院 南宁 530222;2. 广西国际壮医医院脾胃肝病科 南宁 530201)
肝纤维化(Hepatic fibrosis,HF)是由各种损肝因素所致的肝脏内结缔组织异常增生的病理过程,细胞外基质(Extracellular matrix,ECM)弥漫性沉积过多而降解减少及肝窦毛细血管化是其主要的病理特征,是各种慢性肝病向肝硬化甚至肝癌转化的必经途径[1]。在我国,乙型肝炎病毒(HBV)的持续感染是造成肝纤维化以及终末肝硬化的主要原因[2]。我国八桂大地属乙型肝炎高流行区:乙肝感染阳性率高达10%,近16年来流行病学调查发现乙肝的发病率呈明显的逐年增高趋势[3]。
目前,治疗肝纤维化的药物十分匮乏,针对肝纤维化的治疗缺乏特异性靶向药物。现有如皮质类固醇激素、秋水仙碱、水飞蓟素、干扰素等药物效果单一,且疗效与预后均不理想。近年来,间充质干细胞(Marrow stem cells,MSCs)移植无疑是肝硬化患者的希冀。MSCs 属于基质干细胞异质亚群,可从骨髓、脂肪组织、胎盘、脐带血等不同组织中获取,来源充沛。间充质干细胞在骨髓中含量最为丰富,同时也最容易获得,而临床上,骨髓穿刺是一种简单、常规、安全的技术。国内外众多研究表明,即使经过经多次传代,间充质干细胞仍具有稳定的生物学特性,并且具有低免疫原性,如来源于患者自身,免疫相容,无排异反应[4]。所以BMSCs 是干细胞移植治疗的理想的候选细胞,更是组织工程技术中自体组织细胞的首选。然而,BMSCs 作为种子细胞发挥其强大的修复功能的关键是归巢到组织的损伤部分[5]。
国际上对干细胞的研究多着眼于移植和克隆,而通过药物激活内源性的干细胞从而改善再生反应与从外部植入干细胞是全然不同的新思路,在移植干细胞数量不够替代肝功能且内源性干细胞自身遭到破坏、修复能力有限的情况下,采用内源性干细胞动员方案可以促进MSCs 等体内干细胞归巢肝脏分化为肝细胞及残留肝细胞群扩展至足够的数量和质量,充分发挥中医药在维持或促进机体的正常再生修复的作用,且更关注如何利用中医药调控再生修复机制,减少对细胞数量的需求及无需培养扩增的繁琐操作,为干细胞动员提供新的思路。
肝干细胞在不同状态下分化能力的良莠不齐使研究者面临另一个重要的问题,未来的研究需要证实干细胞衍生的人肝细胞样细胞(HLCs)在患者体内是否与内源性肝细胞具有同等功能。目前,中药成分诱导干细胞分化为肝细胞的报道很少,特别是对于细胞再生过程中干细胞的时空分布、分化过程及分化结果的影响尚未见报道。本研究采用先进的实验研究技术系统从促BMSCs 富集、归巢、分化、功能表达等方面调控肝脏再生,深入探讨中药联合BMSCs 移植治疗肝纤维化/肝硬化的协同增效的作用,用现代语言客观阐述名老中医学术理论,是本课题研究的必要性、目的、意义以及创新性。
中药可以通过提高移植干细胞的存活和增殖能力、诱导其向肝细胞定向分化、改善移植后的病理环境等参与干细胞移植治疗肝硬化,展现了其独特的价值,且与其他诱导方法相比,具有安全、易于在临床推广使用等特点。柔肝化纤颗粒是广西名中医王振常结合自身26 年肝病临床经验与全国名老中医林沛湘的“壮肝逐瘀煎”内涵及关幼波教授治疗肝炎肝硬化有效验方基础上组方而成的。本课题的前期研究显示,柔肝化纤颗粒含药血清条件培养液可诱导BMSCs 向肝样分化,但其具体作用机制尚不明确[6]。本研究拟通过动物模型实验及体外细胞培养实验,研究柔肝化纤颗粒促进大鼠BMSC 归巢的机制。
1 材料与方法
1.1 细胞分离及培养
取5周龄雄性SD 大鼠,颈椎脱臼处死。取股骨胫骨,保留骨骺,无菌处理后转移至超净工作台内,无菌血管钳夹碎两端骨骺,用吸满PBS 的注射器把骨髓腔内的骨髓冲洗出来,收集到离心管内。将采集到的骨髓用密度为1.073 g·mL-1的Percoll分离液按照3∶2的比例缓慢滴加进行分离,依照3000 r·min-1,离心30 min,弃上清,用含10%胎牛血清的DMEM 培养基重悬,接种于细胞培养器皿中,在条件为37℃,5% CO2的培养箱内培养。24 h 后更换培养液,此后每3 天换液一次,待细胞汇合度至70%时传代。使用Lipofectamine™2000 Transfection Reagent(Invitrogen,11668019),转染p-EGFP-N1 质粒,转染后48 h 开始进行药物筛选,筛选两周后获得稳定转染细胞株,常规培养。
含药血清制备:选取40只SD 大鼠,使用中药柔肝化纤颗粒(组方:生黄芪45 g,生牡蛎30 g,黄精20 g 枸杞20 g,薏苡仁45 g,橘红10 g,泽兰30 g,鸡内金15 g,鳖甲30 g,虎杖20 g,丹皮12 g,大枣15 g)药物配成中药免煎颗粒,由广西国际壮医医院药房配制(浙江江阴天药业有限公司,规格:每1 g 配方颗粒相当于饮片6 g),按1.1 g/kg的量灌胃,1次/d,干预15天后,戊巴比妥钠腹腔注射麻醉,常规消毒后暴露颈部动脉,颈动脉插管取血,分管盛装,分组放置。血清过滤除菌后在4℃环境下保存备用。细胞实验分为:对照组,柔肝化纤含药血清(低、中、高浓度)组,经含药血清干预48 h后,收集用于后续实验。
1.2 纤维化模型构建及干预
取健康SPF 级雄性Wistar 大鼠24 只,体质量100-120 g,采用CCL4复合因素肝硬化造模方法进行造模,大鼠随机分为纤维化模型+干细胞注射组和纤维化模型+干细胞注射+柔肝化纤灌胃组,每组12只。由于肝脏具有强大的自然修复能力,为避免肝脏自然修复对实验结果产生的误差,于用药开始后仍每周注射40%CCL4 油剂3 ml·kg-(1体质量)一次。造模8 周后各组分别予以干细胞尾静脉注射或干细胞尾静脉注射+柔肝化纤颗粒灌胃,
1.3 qPCR检测
RNA 提取及逆转录PCR:将30 mg 肝脏组织置于1000 μL Trizol 裂解液(Solarbio,R1100)中,充分裂解混匀后,加入500 μL 的氯仿,4℃,12000 g 离心15 min后取 400 μL 上层水相,加入 400 μL 异丙醇后,4℃,12 000 g 离心10 min 获得RNA 沉淀,经70%酒精洗涤后,晾干,使用无RNA酶水进行溶解,使用超微量核酸检测仪(Suizhen,FC-1100)进行 RNA 浓度及纯度检测,后按照逆转录试剂盒(Monad,RN05004M)说明书进行逆转录操作,所得cDNA 置于-20℃保存待用。(见表1)
qPCR 反应体系为:SYBR Green Premix Taq(Monad,RN04006M):5 μL,cDNA:1 μL,Primer Forward(10 μM):0.3 μL,Primer Reverse(10 μM):0.3 μL,H2O:3.4 μL,反应程序:预处理 95℃:30 s;PCR 循环(40 循环):95℃:5 s,60℃:30 s,72℃:15 s;溶解曲线:标准溶解曲线程序。实验仪器为ABI 7500 定量PCR仪(ABI 7500)。经实验获得的数据使用SPSS 软件进行整理及分析,采用2-ΔΔCT 法进行分析,公式为:ΔCt= (Ct gene-Ct ACTB),ΔΔCt= (ΔCt treat- ΔCt control)。所得数据使用GraphPad(GraphPad Software 5.0)进行整理制图。
1.4 WesternBlot检测
组织蛋白提取:取30 mg组织块置于离心管中,加入400 μL RIPA-PMSF 裂解液(Solarbio,R0010),组织匀浆机匀浆后于4℃,12 000 r·min-1离心5 min,取上清采用BCA 法测定蛋白含量。细胞蛋白提取:向细胞培养板中加入加入150-200 μL RIPA-PMSF 裂解液(Solarbio,R0010),于冰上充分吹打裂解后,于 4℃,12000 rpm 离心5 min,取上清采用BCA 法测定蛋白含量。4 × 蛋白上样buffer(Solarbio,P1016)100℃变性5-10 min。蛋白电泳:80 V 恒压电泳约20 min,待样品进入分离胶层后,换用100 V 恒压电泳1-1.5 h;转膜:200 mA 恒流转膜60-90 min。抗体孵育:用TBST(Solarbio,T1081)配制体积分数为8%的脱脂奶粉(Solarbio,D8340)作为封闭液,将膜放入封闭液中封闭3 h。按抗体说明书上的推荐比例使用封闭液将一抗(Anti-SDF1 抗体(Abcam,ab9797),Anti-CD62P 抗体(Abcam,ab59738),Anti-CD62E抗体(Abcam,ab18981),Anti-CD44抗体(Abcam,ab157107),重组Anti-CXCR4抗体[UMB2](Abcam,ab124824),重组Anti-VCAM1 抗体[EPR5047](Abcam,ab134047),Anti-Integrin alpha 4/CD49D 抗体(Abcam,ab202969)进行稀释,将膜放入稀释后的一抗中4℃孵育12 h。一抗孵育完成后,使用 TBST 洗膜 3 次,每次15 min。将膜放入按1∶3 000比例稀释的二抗(goat anti-rabbit:Abcam,ab6721)中37℃孵育 1 h,使用 TBST(Solarbio,T1081)洗膜 3 次,每次 15 min 使用 ECL 显色剂(Solarbio,PE0010)对膜进行显色,于凝胶成像仪(Tanon,5200)中进行曝光成像。
1.5 肝脏组织冰冻切片及荧光拍照
新鲜肝脏组织固定液固定30 h,用手术刀把从固定液中取出的组织的目标部位修平整。将修切好的组织先经15%的蔗糖溶液内4℃冰箱脱水沉底后再转入30%的蔗糖溶液内4℃冰箱脱水沉底。将脱水后的组织取出放于包埋台上,使用OCT 包埋剂进行包埋,冰冻切片机切片,厚度8-10 μm,将组织贴于载玻片上,-20℃保存备用。冰冻切片从冰箱拿出来复温,晾干水分,冷丙酮固定10 min,待丙酮完全干后于PBS(pH 7.4)中在脱色摇床上晃动洗涤3 次,每次5 min。滴加DAPI,避光室温孵育10 min。充分洗脱DAPI后,使用抗淬灭封片剂封片,于尼康倒置荧光显微镜下拍照。

表1 引物设计
1.6 组织学检测
取肝脏组织使用4%多聚甲醛固定,梯度经久脱水,石蜡包埋,经组织切片后进行H&E 染色及Masson染色,封片后使用显微镜拍照,分析肝脏病理及纤维化情况。
1.7 统计学分析
本研究使用统计学软件SPSS 22.0 对实验数据进行统计分析,结果以均值±标准差()表示,使用单因素方差分析(One-way ANOVA)对实验数据进行统计学处理;P<0.05为差异有统计学意义。
2 结果与分析
2.1 柔肝化纤颗粒可明显改善肝纤维化情况
经H&E 染色及Masson 染色,发现与对照组相比,BMSC移植组及柔肝化纤颗粒联合BMSC移植后,大鼠肝纤维化程度显著降低(见图1)。
2.2 柔肝化纤颗粒可促进BMSC向肝脏富集
组织冰冻切片荧光拍照结果显示,使用柔肝化纤颗粒联合BMSC 移植后,大鼠肝脏内携带绿色荧光蛋白细胞数量明显高于BMSC单独移植组(见图2)。
2.3 柔肝化纤颗粒可通过上调SDF-1/CXCR4 促进肝脏吸引BMSC
经qPCR及WesternBlot检测(见图3),发现与单纯干细胞干预组相比,柔肝化纤颗粒联合干细胞干预组大鼠肝脏干细胞粘附相关基因(SDF-1、CD62P 和CD62E)mRNA 和蛋白表达量显著上调(P<0.05),干细胞归巢相关基因(CD44、CXCR4、VCAM-1 和CD49D)mRNA和蛋白表达量显著上调(P<0.05)。

图1 肝组织石蜡切片H&E染色及Masson染色观察肝纤维程度

图2 肝组织冰冻切片观察外源注射荧光标记BMSC在肝脏内分布情况
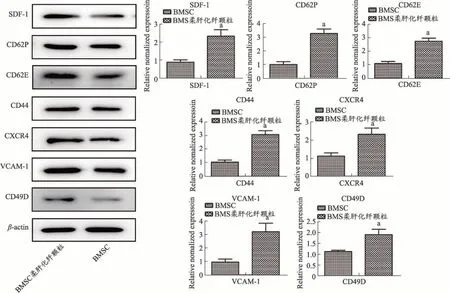
图3 qPCR及WesternBlot检测干细胞粘附相关基因(SDF-1、CD62P和CD62E)及干细胞归巢相关基因(CD44、CXCR4、VCAM-1和CD49D)mRNA及蛋白表达水平
2.4 柔肝化纤颗粒在体外可增加BMSC的迁移能力
经qPCR 及 WesternBlot 检测(图 4),与对照组相比,添加低浓度柔肝化纤含药血清对干细胞归巢相关基因(CD44、CXCR4、VCAM-1 和 CD49D)mRNA 和蛋白表达有上调作用,但差异不显著(P>0.05),随浓度升高,基因上调趋势逐渐显著(P<0.05)。
3 讨论
肝硬化是各种慢性肝病的终末期表现,随着生活水平的提高,酒桌餐饮文化的兴起,人们的饮食结构以高糖、高脂为主,由此产生的酒精性和(或)非酒精性脂肪肝日益增多,这些患者均有肝硬化的潜质或已经发展为肝硬化,因此肝硬化群体是十分巨大的。有研究表明,间充质干细胞对肝纤维化或肝硬化等有潜在的治疗作用,能够定植于损伤部位,通过下调IL-17来改善肝脏炎症[7]或抑制肝星状细胞的增殖或诱导其凋亡,阻断肝纤维化进程[8-9]。我国部分学者及本课题的小样本临床研究表明[6,10],输注BMSCs的耐受性和安全性良好并能使肝硬化患者获益:改善肝功能、降低Child-Pugh 和 MELD 评 分 ,减 少 腹 水 及 死 亡 率[11]。BMSCs 需要归巢到损伤部分才能发挥其修复作用,但BMSCs 在骨髓中含量极少(需要经体外扩增才能满足应用要求,而体外培养、扩增条件的要求比较严格)及其向损伤部位归巢的能力相对有限,影响了其临床预期效果。
中医学认为,肾藏精,主生殖、生长、发育,与现代医学研究发现的干细胞具有的“自我更新”与“高度分化”特性不谋而和。两者都在旨在揭示机体生长发育与生殖的基本生命规律。本研究的前期研究结果证实[6]柔肝化纤颗粒含药血清条件培养液(以肝组织匀浆+10%胎牛血清为条件培养基)可诱导BMSCs 肝样分化:可见细胞贴壁生长,透光度良好,21 天后细胞变大变圆,呈集落生长,表现为肝样细胞形态,但其在体内的具体作用途径及干细胞归巢机制尚不明确。

图4 qPCR及WesternBlot检测干细胞归巢相关基因(CD44、CXCR4、VCAM-1和CD49D)mRNA及蛋白表达水平
BMSCs 的归巢和植入的过程与白细胞迁移至炎症部位再归巢至淋巴结相似。此过程中,BMSCs 需跨越血管内皮细胞与细胞外基质进入骨髓龛位,与基质细胞在黏附分子、SDF-1 及生长刺激因子作用下进行自我更新和增殖分化,从而实现了归巢和植入[12]。黏附分子E-选择素和P-选择素介导干细胞在内皮细胞层的滚动,随后内皮细胞分泌的SDF-1 激活CXCR4 阳性的干细胞并触发了LFA-1/ICAM 和VLA-1/VCAM-1 之间相互作用而使干细胞黏附于内皮细胞上[13]。而VLA-1 和VLA-5 与细胞外基质纤维结合素的作用使干细胞穿过细胞外基质并顺着SDF-1 浓度梯度迁移至骨髓龛位[14]。可见,BMSCs的归巢和植入过程中SDF-1/CXCR4 相互作用从始至终都发挥着决定性作用[15]。在动物实验中,本研究发现与单纯干细胞干预组相比,柔肝化纤颗粒联合干细胞干预组大鼠肝脏干细胞粘附相关基(SDF-1,CD62P 和 CD62E)mRNA 和蛋白表达量显著上调(P<0.05),说明经柔肝化纤颗粒干预后,大鼠肝脏粘附分子表达量显著上调,可募集更多的干细胞迁移至肝脏区域,从而进行后续的转分化及修复。通过对BMSC 干预后大鼠肝脏中干细胞归巢相关基因CD44、CXCR4、VCAM-1 和 CD49D 的 mRNA 和蛋白表达量进行检测后,发现柔肝化纤颗粒干预下可显著提高肝脏内干细胞归巢相关指标的上调(P<0.05),此发现证实经柔肝化纤颗粒干预后,肝脏可有效募集BMSC 归巢至受损肝脏区域。在体外BMSC 细胞实验中,经较高浓度柔肝化纤含药血清干预后,本研究发现BMSC 干细胞归巢相关基因的mRNA 和蛋白水平显著上调(P<0.05),此结果与动物实验结果相吻合,证明柔肝化纤颗粒是激活BMSC 活跃归巢的关键因素。
BMSC 移植是公认的最具应用前景的肝纤维化及肝硬化干细胞治疗手段,随着对BMSC 归巢及肝脏募集作用机制的不断深入研究,并对其后续定向分化为肝细胞的微环境作用进行深入探讨,利用我国宝贵的中医药资源,促进BMSC 向干细胞归巢并分化,修复受损肝脏组织,将为肝纤维化与肝硬化的治疗带来全新的变革。中药柔肝化纤颗粒可通过SDF-1/CXCR4 轴促进BMSC 归巢相关基因及蛋白表达,促进干细胞向肝纤维化肝组织归巢,并提高受损肝脏募集干细胞的水平,修复受损肝脏。
