水位和施氮对若尔盖高寒湿地土壤非共生固氮的影响
2020-11-24张骁栋王金枝吴海东康晓明
张骁栋,王金枝,颜 亮,李 勇,吴海东,康晓明,*
1 中国林业科学研究院湿地研究所,湿地生态功能与恢复北京市重点实验室, 北京 100091 2 四川若尔盖高寒湿地生态系统定位观测研究站, 阿坝藏族羌族自治州 624500
青藏高原是全球海拔最高的独特地域单元,具有复杂的地理成分与生物区系,也是具有全球重要性的脆弱生态区[1]。青藏高原湿地多为高寒沼泽、高寒沼泽化草甸等,面积约4.91×105km2,在补给水源、调节区域气候、维持区域生态平衡和保护生物多样性等方面具有不可替代的作用[2]。位于青藏高原东南缘的四川省阿坝州若尔盖高原是我国面积最大的高原泥炭沼泽分布区。1955—1980年期间,为了开辟牧场,在若尔盖高原泥炭沼泽中开挖了人工沟渠,建设了排水工程[3]。水位下降加速沼泽湿地土壤有机质分解和营养物质流失[4],植被从沼生型向中生型演替,沼泽向草甸转变[5- 6]。尽管目前青藏高原地区的氮沉降低于全国其他地区,但1980—2013年青藏高原的湿沉降从低于 2 kg N hm-2a-1升至高于10 kg N hm-2a-1[7- 8]。湿地氮沉降不仅影响了生态系统生产力和生物群落结构[9],还影响了枯落物分解[10]和碳、氮循环等生物地球化学过程[11- 12]。
生物固氮是氮元素进入自然生态系统的主要途径之一,对生态系统物质循环过程和植被演替起重要作用[13]。沼泽湿地中生物固氮过程的主要参与者是土壤自由微生物,也称为非共生固氮。土壤非共生固氮受土壤温度、含水量、pH、碳、氮含量及植被类型等多种环境因素的影响[14]。目前有关土壤非共生固氮的研究集中在北方泥炭地[15- 16]、滨海湿地[17- 18]和海洋生态系统[19- 20],而关于第三极生态系统土壤固氮的研究还较少[21-22]。在芬兰中部泥炭地的研究表明,淹水的泥炭藓沼泽中的土壤非共生固氮速率(RNfix)随着水位升高而提高,但是这种现象在排干后的林地中并未发现[16]。沼泽中水位对土壤非共生固氮的影响主要是通过含氧量变化引起的,因为氧气对微生物固氮酶有抑制作用,固氮微生物群落和活性随着土壤含氧量变化相应改变[23]。另一方面,生物固氮是高耗能过程,所以一般认为在无机氮充足的环境中固氮微生物会降低RNfix,表现为无机氮对RNfix的抑制作用[14, 24]。同时,也有研究表明无机氮对RNfix的抑制作用并非线性,微生物能在高无机氮的环境中仍能以较低的速率固氮[20, 24]。
沼泽湿地水位变化和氮沉降对土壤固氮过程具有潜在效应,但受自然条件下植被演替、土壤质地、气候等环境因子干扰,土壤水分和氮含量以及它们的交互作用对沼泽湿地土壤RNfix的影响格局和机制仍不清楚,野外调查研究难以剖分人类活动引起的高寒沼泽湿地水位下降和氮沉降产生的效应。本研究采用中宇宙实验方法控制水位和模拟氮沉降,研究青藏高原若尔盖高寒湿地土壤非共生固氮对水位和施氮及其交互作用的响应特征。本研究将有助于理解人类活动对高寒湿地生态系统氮循环过程的影响机制。
1 研究方法
1.1 研究区域的自然概况
本研究在四川省阿坝州若尔盖高原(101.60°—103.50°E,32.33°—34.00°N)开展,位于青藏高原东北缘,海拔为3400—3600 m。若尔盖县年平均气温-0.7—1.1℃,最热月(7月)平均气温11℃,最冷月(1月)平均气温-10.5℃;年均降水量650—750 mm,主要集中在6—9月,相对湿度78%。中宇宙实验的原状土采自若尔盖县的阿西乡(33.47°N,102.57°E),主要植被类型为一年及多年生草本组成的沼泽草甸,优势物种为木里薹草(Carexmuliensis)、西藏嵩草(Kobresiatibetica)、蕨麻(Potentillaanserina)等[25]。于2014年设立围栏,使牦牛不能进入围栏内区域[26],本研究所用的原状土在围栏内挖取。围栏区域附近的自然水位根据牧民用的采水井测定,约 -90 cm—-60 cm,表层10 cm土壤的平均pH值 7.81,平均含水量46%。
1.2 中宇宙实验设计
中宇宙实验系统建于若尔盖高寒湿地生态系统定位观测研究站。2017年5月中旬,在阿西乡的围栏内选取地形与植被较均一的区域,挖取60 cm(长)×60 cm(宽)×40 cm(高)的原状土块,置于60 cm(长)×60 cm(宽)×60 cm(高)的不锈钢箱(以下称“生态模拟箱”)中。生态模拟箱四周用泡沫隔热膜包裹,以减少箱体受太阳辐射而温度过高。共有27个装有原状土的生态模拟箱,设3个水位水平(WT-30,WT0和WT10)×3个施氮水平(N0,N4,N8)×3个重复,实验采用完全随机设计。三个水位水平分别使表层土处于未淹水(WT-30:-30 cm)、水气交界(WT0:0 cm)和淹水(WT10:10 cm)的状态。施氮处理参照青藏高原高寒草甸生态系统的氮饱和阈值约4 g N m-2a-1 [7],设计对照(N0:不施氮),饱和(N4:4 g N m-2a-1)和过饱和(N8:8 g N m-2a-1)三个水平。水位设计在每个生态模拟箱角上插1根70 cm 的PVC管,伸至原状土块底部。将水位探头伸入PVC管中监测生态模拟箱水位。箱中水位用自动水位控制继电器与小型水泵根据水位探头的信号联合控制,可使实际水位在设计水位的±1.5 cm范围内浮动。施氮时间分别为6月22日、7月29日和8月24日,将NaNO3溶解于湿地水中,均匀喷洒于生态模拟箱中。
1.3 样品采集与理化指标测定
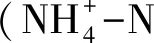
1.4 土壤非共生固氮速率测定
土壤RNfix测定采用稳定同位素15N2标记法[18]。每个生态模拟箱的新鲜土样去除植物组织后过2 mm筛,取约20 g,平均分成两份,分别置于两个普通60 mL广口试剂瓶中。对照组试剂瓶直接密封;处理组试剂瓶用橡胶塞密封,用针筒抽出部分空气,使瓶内气压降至约0.7 kPa时注入15N标记的混合空气(20% O2和80%15N2,15N2>98%分子比)。将对照组和标记组一起置于20℃培养10 d,结束培养后土壤60℃烘干72 h,研磨过100目筛后用稳定同位素分析仪(EA Flash2000-Delta Advantage,Thermo Electron Corporation,美国)测定δ15N。土壤RNfix计算[27]如下:
(1)
其中,RNfix是土壤非共生固氮速率(μg N g-1d-1),Nsoil_labeled是标记样品的TN含量(μg/g),t是培养天数(d),m是培养的样品干重(g),Atom%15Nsoil_labeled是标记后土壤的15N原子百分含量,Atom%15Nsoil_unlabeled是未标记土壤15N原子百分含量,Atom%15Ngas_labeled是标记气体的15N原子百分含量,Atom%15Ngas_unlabeled是未标记气体的15N原子百分含量。
1.5 数据分析
统计分析和作图均采用R 3.5[28]完成。采用双因素方差分析(Two-way ANOVA)检验水位和施氮对土壤RNfix、土壤含水量、pH、无机氮、总有机碳、氮、植物生物量及植物氮含量等指标的影响,并用duncan.test进行多重比较(Package "agricolae")。不同氮处理下土壤RNfix对土壤含水量的响应采用协方差分析,以土壤含水量为协变量,施氮处理为固定因子。用Pearson′s相关系数分析变量间的相关性。
2 结果与分析
2.1 水位与施氮处理对土壤非共生固氮速率的影响
生态模拟箱表层土壤RNfix范围是0.003—7.35 μg N g-1d-1,平均值为(2.43±1.03) μg N g-1d-1(图1)。水位处理对土壤RNfix效应显著(表1),WT0和WT10处理中土壤Rnfix高于WT-30处理(图1),WT0处理下RNfix平均值最高,为(3.30±1.23) μg N g-1d-1。虽然方差分析显示施氮,以及水位与施氮的交互作用对RNfix都无显著影响(表1),但协方差分析表明土壤RNfix随着土壤含水量变化的斜率因施氮处理而显著不同(表2)。对照处理(N0)中RNfix关于土壤含水量的斜率为0,而N4和N8施氮处理中土壤RNfix随着含水量的斜率分别为0.30和0.50(图1)。
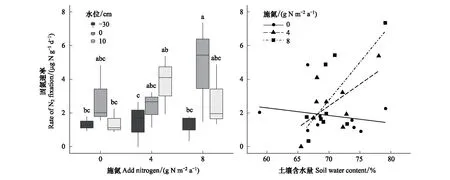
图1 不同水位与施氮处理下的土壤非共生固氮速率及其与土壤含水量的关系Fig.1 Rate of non-symbiotic N2 fixation under different water table and nitrogen addition treatments and its relationship with soil water content 不同小写字母表示9个处理间差异显著
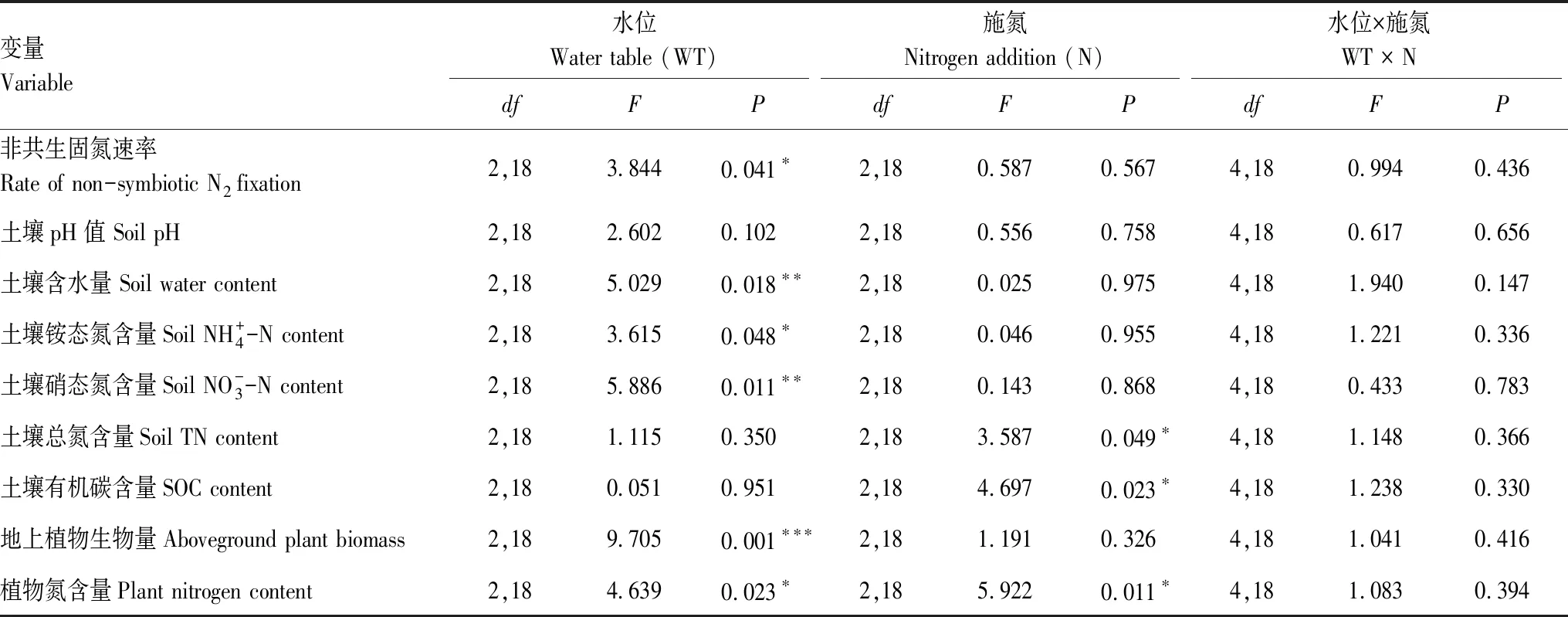
表1 不同水位与施氮处理对植物与土壤性质影响的方差分析
2.2 不同水位与施氮处理对土壤理化性质的影响
施氮处理对土壤TN和SOC含量效应显著(表1)。N4和N8处理的土壤TN为(18.84±0.64) g/kg和(18.71±1.66) g/kg,高于N0处理的土壤TN含量(15.93±2.20) g/kg(图2)。N8处理的SOC含量为(282.37±13.60) g/kg,高于N0和N4处理的土壤SOC含量 (239.79±21.28) g/kg和(226.62±33.84) g/kg(图2)。土壤TN与SOC和RNfix无显著相关关系(P>0.05)。
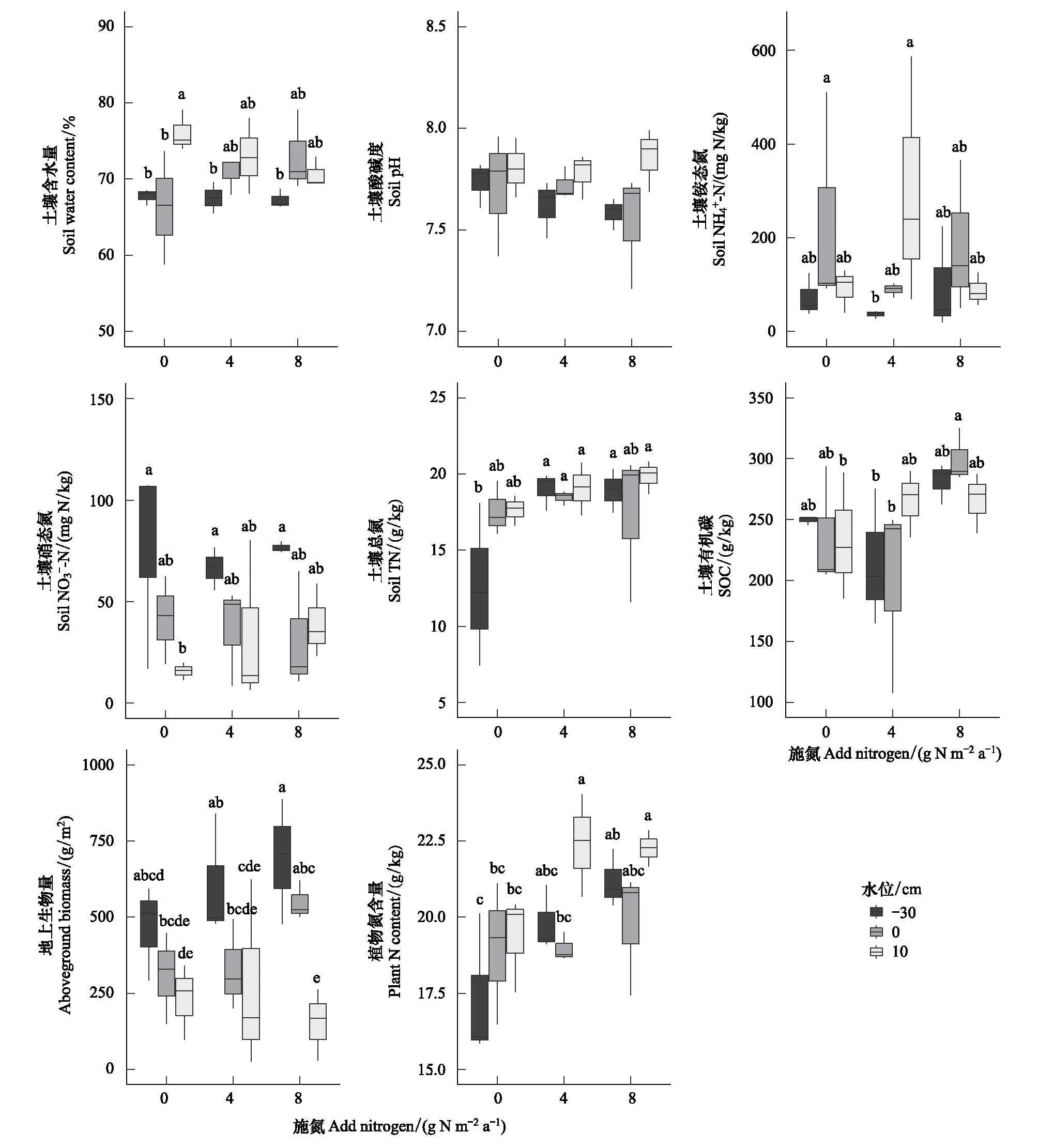
图2 不同水位与施氮处理下生态模拟箱土壤理化性质、植物生物量及氮含量Fig.2 Variations in soil properties, plant biomass, and plant nitrogen content among water table and nitrogen addition treatments不同小写字母表示9个处理间差异显著
2.3 不同水位与施氮处理对植物地上生物量与氮含量的影响
生态模拟箱中水位升高显著降低植物地上生物量(表1),且在不淹水的WT-30和WT0处理中的植物地上生物量随着施氮增加呈升高趋势(图2)。水位和施氮处理对植物氮含量均有显著效应(表1),随着水位升高和施氮增加,植物氮含量呈增加趋势,从WT-30N0的(18.97±1.34) g/kg 升至WT10N4的(22.41±0.97) g/kg(图2)。植物地上生物量及其氮含量与RNfix无显著相关关系(P>0.05)。
3 讨论
3.1 水位对土壤非共生固氮速率的影响
初步研究了水位和施氮对若尔盖高寒湿地土壤RNfix的影响。当水位从不淹水升至淹水状态时,土壤RNfix提高,且对含水量的响应在施氮处理下更敏感(图1)。研究结果与芬兰中部泥炭沼泽的研究结果相似,淹水的沼泽中土壤RNfix高于排干的沼泽[16]。水位升高使土壤含水量增加的同时降低了土壤氧气含量。由于氧气对固氮酶有抑制性,因此土壤中较低的含氧量有助于提高RNfix[23]。生态模拟箱的水位从-30 cm升至10 cm,土壤含水量提高了约6%(图2)。虽然土壤含水量变化不大,但RNfix从(1.34±0.47) μg N g-1d-1升至(3.30±1.23) μg N g-1d-1,提高了将近2倍。在北极地区的研究表明,土壤含水量低于60%时维管植物覆被的土壤固氮过程停止,因此60%土壤含水量可能是当地维管植物覆被的土壤RNfix的临界点[29]。生态模拟箱中的土壤含水量均在60%以上(图2),且植被以木里薹草、西藏嵩草、蕨麻等维管植物为优势种,因此研究系统中土壤非共生固氮能持续进行。然而,如果自然湿地中水位持续降低,土壤非共生固氮过程可能停止。
3.2 施氮对土壤非共生固氮速率的影响
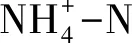
3.3 不同施氮处理下土壤非共生固氮速率对土壤含水量敏感性
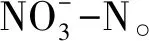
3.4 若尔盖地区的生物固氮过程
植被、水分、温度、营养等环境因子使土壤RNfix在不同生态系统间、不同微生境间和季节间呈现巨大差异[14]。本研究生态模拟箱中若尔盖夏季表层土壤RNfix平均值为(2.43±1.03) μg N g-1d-1,低于北欧森林泥炭沼泽6.02 μg N g-1d-1[16]和智利的巴塔哥尼亚泥炭地4.2—19.6 μg N g-1d-1[18],但高于亚北极苔原夏季0.24—0.37 μg N g-1d-1[15],与中国东部的长江口滩涂0.12—2.65 μg N g-1d-1[17]接近。总体来说,土壤非共生固氮在水分充足的环境中能维持较高速率。由于气候变化和人为排水引起的若尔盖湿地水位下降,可能使土壤非共生固氮过程减弱。水位下降引起的植被群落变化,如从莎草优势种向禾草、杂草优势种演替[6, 25],也会使根际固氮微生物的群落组成和活性发生改变[16]。若尔盖地区氮沉降水平较中国东部地区低,但近年来呈现持续增长趋势,至2013年已达15—21 kg N hm-2a-1[8]。依据本研究的结果,在氮沉降增多的背景下,若尔盖湿地自然水位抬升或实施还湿措施将促进土壤非共生固氮,从而加快生态系统富营养化过程;反之,湿地退化和水位持续下降可能使土壤非共生固氮减弱甚至停止。
4 结论
研究探索了若尔盖高寒湿地中水位和施氮处理对土壤非共生固氮速率的影响,表明水位是土壤RNfix的主要影响因子,土壤RNfix随着土壤含水量增加而提高。尽管施氮对土壤RNfix没有直接效应,但施氮可通过提高土壤有机碳间接促进非共生固氮。研究有助于加深理解湿地生态系统氮循环对人类活动的响应机制,为高寒湿地生态系统的适应性管理提供科学依据。
