圆斑星鲽(Verasper variegatus)wt1基因的克隆与表达分析*
2020-11-24杨珍珍陈四清张盛农刘长琳葛建龙
杨珍珍 边 力 张 岩 陈四清 常 青 张盛农 刘长琳 葛建龙
圆斑星鲽(Verasper variegatus)wt1基因的克隆与表达分析*
杨珍珍1, 2边 力1, 3张 岩1陈四清1, 3①常 青1张盛农1刘长琳1葛建龙1
(1. 中国水产科学研究院黄海水产研究所 青岛 266071;2. 上海海洋大学水产与生命学院 上海 201306;3. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071)
圆斑星鲽()雌鱼生长快, 成熟雌鱼个体大小是雄鱼的2倍以上, 开展性别相关基因的功能研究, 对于探究圆斑星鲽性别决定机制, 建立单性培育技术具有重要意义。本研究获得了及两个同源基因,基因全长为3263bp, 预测开放阅读框(ORF)长为1245bp, 编码415个氨基酸, 5′-UTR和3′-UTR分别长372bp和1640bp;基因全长为2312bp, 预测开放阅读框(ORF)长为1281bp, 编码427个氨基酸, 5’-UTR和3’-UTR分别长369bp和659bp。基因编码氨基酸分子量为46.2kDa, 理论等电点为9.24, 无跨膜结构及信号肽, 在ORF末端有4个锌指结构, 编码KTS三肽;基因编码氨基酸分子量为46.95kDa, 理论等电点为8.99, 无跨膜结构及信号肽, 在ORF末端有4个锌指结构, 并且编码 KTS三肽。基因表达结果表明:和基因主要在圆斑星鲽性腺中表达, 精巢的表达高于卵巢, 肾脏的表达量显著高于其他组织, 推测基因和基因在性腺和肾脏发育过程及功能方面均发挥重要作用;在早期发育阶段,基因在原肠期之前微弱表达, 从原肠早期开始逐渐上升至神经胚期表达量达到最高, 之后逐渐下降, 直至孵化阶段, 推测基因在圆斑星鲽原始生殖细胞分化过程及性腺发育中发挥重要作用。
圆斑星鲽;;基因克隆;表达分析
肾母细胞瘤系婴幼儿最常见的恶性肿瘤之一, 多发生于3岁以内儿童(Pelletier, 1991), 发病率约为1/10000(Sharma, 1992)。1899年Max Wilms首次对肾母细胞瘤进行了详细描述(Kreidberg, 1993), 因此, 又将其命名为Wilms瘤。1990年Gessler等分离克隆出一个与Wilms瘤相关的基因(Gessler, 1990), 命名为Wilms’tumor 1()。基因可编码含有锌指结构的蛋白质, 在性腺发育及分化过程中识别、结合和调控雄性性别决定基因(Hossain, 2001)类固醇生成因子-1(sf-1) (Wilhelm, 2002)及苗勒管抑制物(Hossain, 2003)等性别发育关键基因。人类基因突变会导致性腺和肾脏等器官发育异常及相关功能障碍(Klamt, 1998), 导致Denys-Drash综合征、Frasier综合征及小儿肾癌等疾病。敲除小鼠基因后, 其性腺及肾脏等器官均出现发育缺陷, 甚至导致肾功能衰竭(Wiener, 1996; Moore,1999)。由于鱼类特有的基因组复制,基因分化为了和两个同源基因, 目前已在斑马鱼()(Bollig, 2006)、青鳉()(Klüver,2009)、半滑舌鳎()(张红等, 2014)、牙鲆()(孙近近, 2016)、黄鳝()(胡青等, 2014)及尼罗罗非鱼()(江东能, 2016)等开展了基因的克隆及功能研究。
圆斑星鲽俗称花斑宝、花片等, 属脊索动物门(Chordata)、硬骨鱼纲(Osteichthyes)、鲽形目(Pleuronectiformes)、鲽科(Pleuronectidae)、星鲽属()。其外观漂亮, 体型较大, 食性范围广, 生长速度快, 出肉率高, 抗病能力强, 肉质细腻鲜美, 鳍边坚韧有弹性, 富含多种氨基酸、维生素及微量元素, 属于名贵的海水品种, 目前已成为我国北方优良的养殖对象。在生长过程中, 雄性个体3年可性成熟, 雌性个体需要4年才可达到性成熟, 而且雌性个体的生长明显快于雄性个体。目前, 在圆斑星鲽中仅对基因(柳学周等, 2013)、基因(张乐乐, 2018)、基因(张乐乐等, 2018)及基因(杨珍珍等, 2020)做了相关研究, 其性别决定和生殖调控的分子机制仍不清楚, 因此我们利用RACE末端扩增技术克隆了圆斑星鲽和基因cDNA全长并分析了其序列结构特征, 利用实时荧光定量PCR技术对其不同发育时期的胚胎、仔鱼以及雌雄成鱼的不同组织进行表达分析, 以阐明和基因在圆斑星鲽性腺分化及发育中的作用, 为研究圆斑星鲽性别决定及单性繁育等提供新的靶标基因。
1 材料与方法
1.1 样品制备及wt1基因全长序列克隆
从山东省烟台天源水产有限公司采集圆斑星鲽不同发育时期的胚胎, 包括单细胞期(卵裂前胚盘隆起时期)(0h)、2细胞期(4h)、8细胞期(10h)、16细胞期(12h)、32细胞期(13h)、桑椹期(18h)、高囊胚期(20h)、低囊胚期(26h)、原肠早期(27h)、原肠中期(29h)、原肠晚期(77h)、神经胚期(98h)、晶体形成期(136h)、心跳出现期(163h)、孵化前期(188h)、脱膜孵化期(197h), 不同时期的仔稚鱼(孵化后5d, 10d, 20d, 30d, 45d, 58d, 68d, 78d, 92d)及雌雄成鱼[体长(24.0±0.5)cm, 体重(330±20)g]的不同组织(脑、眼、鳃、心、肝、肠、脾、性腺、肾及肌肉), 将采集的样品用液氮充分研磨, 根据Trizol(TaKaRa)实际说明书提取各组织的总RNA, 经Thermo紫外分光光度计(NanoDrop 2000)和1.2%的琼脂糖凝胶电泳检测, 将高质量的RNA用SMARTTMRACE cDNA Amplification RACE (TaKaRa)试剂盒分别合成3’RACE和5’RACE cDNA。之后根据本实验室构建的转录组数据库获得和基因的EST序列, 利用Primer Primer 5.0软件设计和基因的3′RACE和5′RACE特异性引物(表1), 以圆斑星鲽成鱼性腺组织cDNA为模板分别进行扩增, PCR反应体系(20μL)为: Premix TaqTM(LA TaqTMVersion 2.0) 10μL、3’或5’特异性引物0.8μL、UPM(或NUP) 0.8μL、RACE-cDNA 1μL及ddH2O 6.4μL。PCR反应条件为: 94°C 5min;94°C 30s, 3’或5’特异性引物温度30s, 72°C 1min, 35个循环;72°C 10min。扩增产物经1.2%琼脂糖凝胶电泳检测, 并在紫外线下切胶, 并用SanPrep柱氏DNA凝胶回收试剂盒回收, 利用PMD18-T Vector试剂盒(TaKaRa)进行连接(PMD18-T Vector 1μL, Solution I 5μL及纯化产物4μL), 16°C反应3h。之后将连接液加入融化好的DH5α (Code No 9057, TaKaRa)中培养, 挑取阳性单克隆, 经菌落PCR鉴定后, 筛选目的菌液送至华大基因进行测序。
1.2 wt1基因序列分析
使用ORF Finder (http://www.ncbi.nlm.nih.gov/ projects/gorf/orfig.cgi), ExPASy (https://web.expasy. org/compute_pi/), SMART (http://smart.emblheidelberg. de/), Signal4.1 (http://www.cbs.dtu.dk/services/SignalP/)和NCBI (http://www.ncbi.nlm.nih.gov/Structure/cdd/ wrpsb.cgi)在线生物学软件分析基因的开放阅读框、分子量、理论等电点、信号肽及跨膜结构域。并用DNAMAN (Zemann,2006)和MEGA5.2 (Tamura,2011)软件, 进行多重序列比对及构建系统进化树。
1.3 wt1基因的表达特征分析
根据已获得的基因全长序列, 设计荧光定量特异性引物,-actin作为内参基因(表1)。使用Applied BiosystemsTM7500 Real Time PCR instrument定量仪检测, 反应程序: 95°C 10min;95°C 30s, 95°C 5s, 60°C 34s, 40个循环;95°C 15s;60°C 1min;95°C 15s。采用2–DDCT的计算方法分析相对表达量, 通过SPSS 20.0软件进行单因素分析, 利用OriginPro 2017作图,<0.05代表具有显著性差异。
2 结果
2.1 圆斑星鲽wt1基因全长和序列分析
通过扩增获得基因全长为3263bp, 经预测开放阅读框(ORF)长为1245bp, 编码415个氨基酸, 5’-UTR和3’-UTR分别长372bp和1640bp。经过生物学分析, 推断的415个氨基酸分子量为46.2kDa, 理论等电点为9.24, 无跨膜结构及信号肽, ORF末端有4个锌指结构, 编码KTS三肽(图1)。基因全长为2312bp, ORF长1281bp, 编码427个氨基酸, 5’-UTR和3’-UTR分别长369bp和659bp。的415个氨基酸分子量为46.95kDa, 理论等电点为8.99, 无跨膜结构及信号肽, ORF末端有4个锌指结构, 编码KTS三肽(图2)。
表1 本研究中所使用的引物

Tab.1 Nucleotide sequences of the PCR primers used in this study
2.2 wt1基因同源性和系统发育分析


图1 wt1a基因cDNA序列全长及其编码的氨基酸序列
注: 起始密码子(ATG)与终止密码子(TGA)用单线边框标出, KTS是选择性剪接, 锌指结构区用单下划线标出, polyA结尾用双下划线标出

图2 wt1b基因cDNA序列全长及其编码的氨基酸序列
注: 起始密码子ATG与终止密码子TGA用单线边框标出, KTS是选择性剪接, 锌指结构区用单下划线标出, polyA结尾用双下划线标出
2.3 Wt1基因在不同发育时期及不同组织中的表达分析
胚胎发育期研究结果显示(图6),基因在原肠期之前微弱表达, 从原肠早期开始逐渐上升至神经胚期表达量达到最高, 之后开始呈下降趋势, 直至孵化阶段;基因从原肠晚期开始表达量逐渐升高, 上升至神经胚期后开始下降, 并逐渐稳定。研究基因和基因在仔稚鱼不同发育时期中的表达量, 结果显示(图7)基因在孵后10d时的表达量显著高于本实验中的其他时期,基因在孵后5d时的表达量显著高于本实验中的其他时期, 之后逐渐下降。

图3 wt1a基因编码氨基酸与其他物种wt1a基因编码氨基酸的多序列比对
注: 黑色边框为锌指结构区, 红色边框为KTS。各物种WT1a蛋白序列登录号: 尼罗罗非鱼(XP_013121197.1)、点带石斑鱼(AFV66805.1)、大黄鱼(XP_027128155.1)、黄尾鰤(XP_023262779.1)、黄鳝(XP_020460125.1)、斑马鱼(NP_571121.1)和青鳉(NP_001098171.1)

图4 wt1b基因编码氨基酸与其他物种wt1b基因编码氨基酸的多序列比对
注: 黑色边框为锌指结构区, 红色边框为KTS。各物种WT1b蛋白序列登录号: 牙鲆(XP_019954195.1)、大菱鲆(AWP01692.1)、尼罗罗非鱼(ARU81315.1)、黄鳝(XP_020471329.1)、大黄鱼(XP_010740189.1)、点带石斑鱼(AFV66806.1)、攀鲈(XP_026234955.1)、红鳍东方鲀(XP_011617397.1)和青鳉(NP_001098390.1)
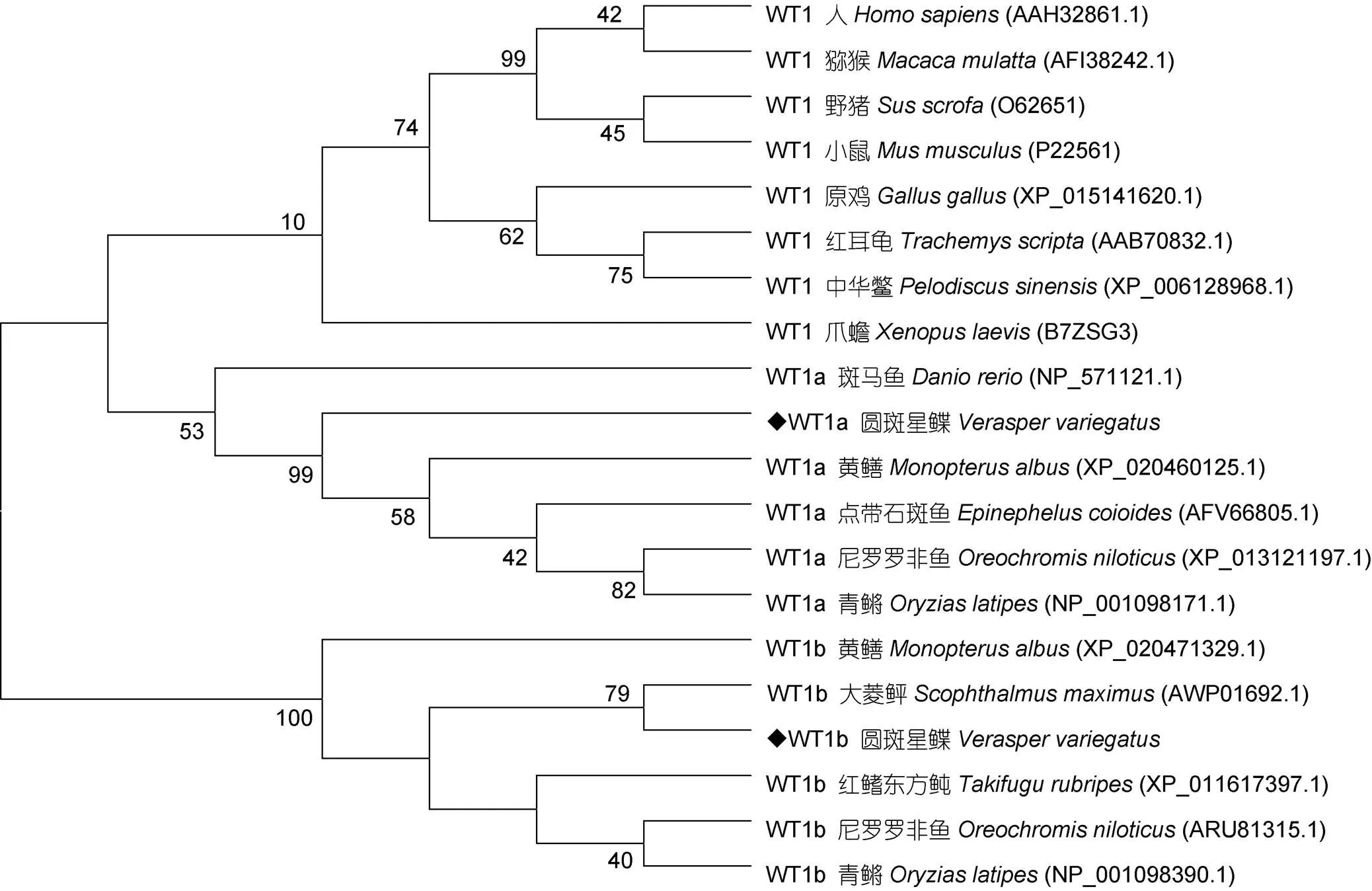
图5 wt1基因编码氨基酸序列的系统进化树
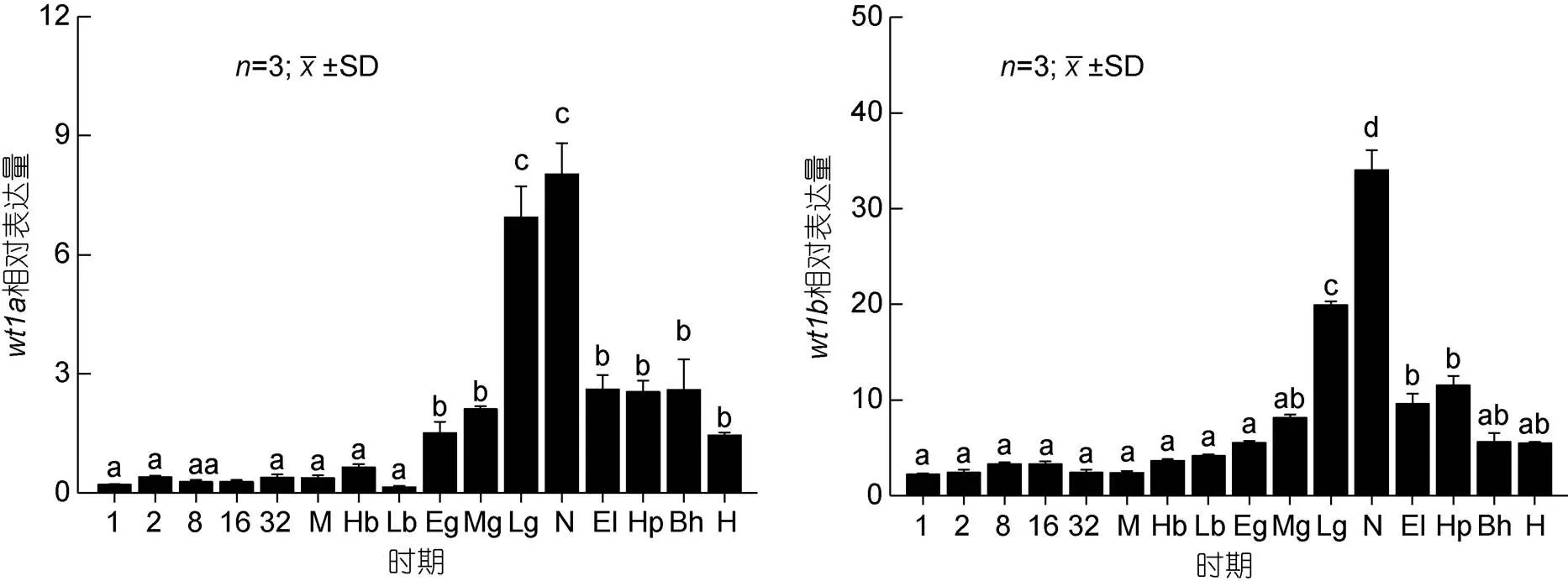
图6 wt1 基因在胚胎发育不同阶段中的表达
注: 1: 单细胞期; 2: 2细胞期; 8: 8细胞期; 16: 16细胞期; 32: 32细胞期; M: 桑椹胚期; Hb: 高囊胚期; Lb: 低囊胚期; Eg: 原肠早期; Mg: 原肠中期; Lg: 原肠晚期; N: 神经胚期; El: 晶体形成期; Hp: 心跳出现期; Bh: 孵化前期; H: 脱膜孵化。不同字母间表示差异显著(<0.05), 下同
组织表达结果显示(图8)基因和基因在雌雄成鱼的各个组织中均有表达。基因和基因在雄性成鱼精巢组织的表达量最高, 其次是雌性成鱼的卵巢组织, 肾组织中也有较高表达, 3个组织的表达量均显著高于其他组织。
3 讨论
本研究用RACE方法获得了圆斑星鲽和基因全长, 分别命名为基因和基因。两个同源基因在ORF末端均具有连续四个(Cys)2(His)2型锌指结构, 编码KTS三肽。同源性分析发现基因和基因编码氨基酸在羧基端锌指结构区域均具有很高的相似性。基因系统分析结果显示, 哺乳类、鸟类及爬行类聚为一大支, 鱼类的WT1a及WT1b分别为一大支, 其中圆斑星鲽WT1b与大菱鲆WT1b聚为一支, 关系较近。此外, 相较于WT1b, 鱼类WT1a与哺乳类等的WT1关系较近, 该结果与半滑舌鳎(张红等, 2014)相似。研究发现基因可通过锌指结构与DNA、RNA 结合, 从而正常行使其功能(Morrison,2008)。此外由于基因具有多个翻译起始位点及不同的选择性剪接方式, 可编码多种蛋白亚型(Dong, 2015), 其中较为常见的+KTS亚型蛋白主要在RNA加工过程中起重要作用, 并在小鼠的性别决定中起重要作用(Hammes, 2001)。综上, 我们推测基因和基因在圆斑星鲽性腺发育中具有重要作用。
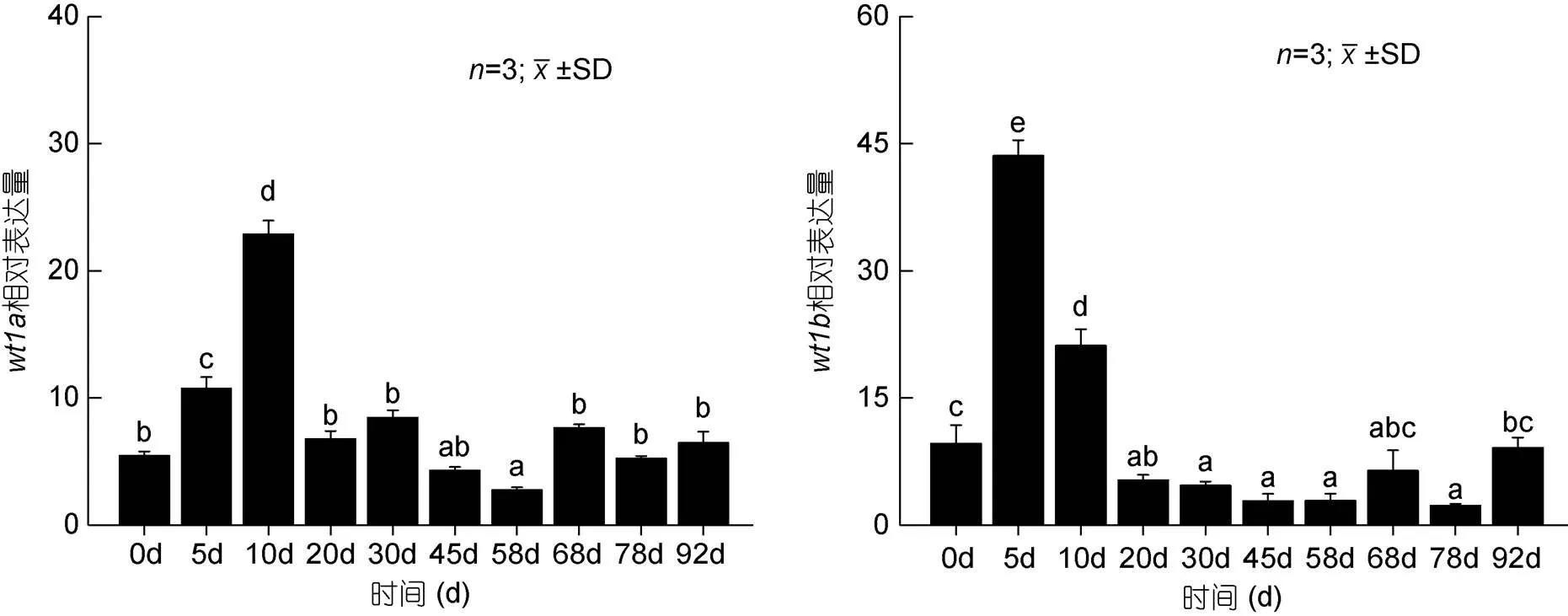
图7 wt1基因在不同发育时期仔鱼中的表达
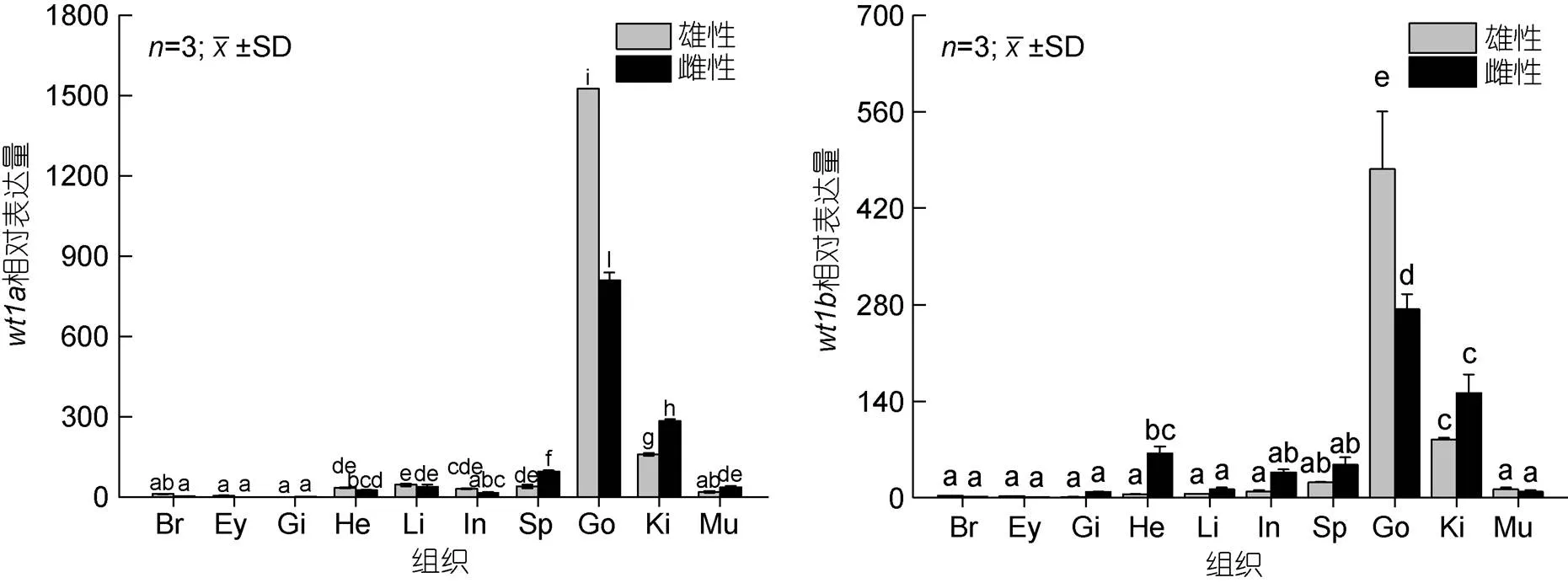
图8 wt1基因在不同组织中的表达
注: Br: 脑; Ey: 眼; Gi: 鳃; He: 心脏; Li: 肝脏; In: 肠; Sp: 脾; Go: 性腺; Ki: 肾; Mu: 肌肉
在哺乳动物中,基因的突变会导致其性腺及肾脏等器官发育异常。如小鼠中缺失基因后, 其肾单位将无法形成, 导致间充质细胞无法正常增殖(Davies, 2004)。性腺分化过程中, 仅在小鼠精巢的支持细胞及卵巢的颗粒细胞中表达的基因可以促进生殖细胞的成熟, 小鼠基因缺失后, 精原细胞的分裂过程将被中断(Zheng, 2013),
基因在原肠期前表达低, 从原肠早期开始逐渐上升至神经胚期表达量达到最高, 之后逐渐下降, 该结果与斑马鱼(Bollig, 2006)、半滑舌鳎(张红等, 2014)及牙鲆(孙近近, 2016)的表达模式相似。研究发现, 神经胚期是原始生殖细胞分化的关键时期(康现江等, 2010), 因此推测基因在圆斑星鲽原始生殖细胞分化过程中发挥作用。基因从原肠晚期开始表达量逐渐升高, 至神经胚期后下降, 并逐渐稳定, Bollig等(2006)研究发现在斑马鱼胚胎时期检测到基因在12h(原肠期之后)时的表达量显著增加, 同时原位杂交结果显示基因在间介中胚层(原肠胚末期)表达, 而间介中胚层将分化为泌尿生殖系统的主要器官, 因此推测基因在性腺分化形成中发挥作用。作为同源性基因,和基因在圆斑星鲽胚胎发育过程中的神经胚期表达量均达到最高, 表明和基因均在圆斑星鲽原始生殖细胞分化过程中发挥作用,基因在圆斑星鲽胚胎发育中表达量显著上升时间较早, 因此推测基因在圆斑星鲽胚胎发育中较早地发挥作用, 仍需进一步验证。
基因在孵后10d时的表达量显著高于其他时期, 这一表达模式与牙鲆相似, 在牙鲆中基因对其生殖脊细胞的存活起着重要作用(孙近近, 2016), 因而基因可能在圆斑星鲽性腺的发育过程中起作用;基因在孵后5d时的表达量显著高于其他时期, 之后逐渐下降, 其表达量显著升高的时间早于基因, 推测在仔稚鱼发育过程中基因更早地发挥作用, 但因相关研究较少, 其在圆斑星鲽性腺发育中的作用仍需进一步研究。
基因和基因在精巢与卵巢中的表达量均显著高于其他组织, 且精巢的表达量显著高于卵巢, 其次在肾脏组织中的表达量显著高于其他组织。在斑马鱼(Bollig, 2006)和青鳉(Klüver,2009)中,基因在性腺及肾脏中均具有较高表达, 且在青鳉中发现基因的突变会导致原始生殖细胞数量减少。在半滑舌鳎(张红等, 2014)中,基因在性腺及肾脏中也有较高表达, 且该研究显示基因在性腺分化及发育过程中持续表达。在牙鲆(孙近近, 2016)中,基因主要在性腺中表达, 同样在精巢中的表达量高于卵巢, 表明基因在性腺发育及功能维持方面起重要作用。在黄鳝(胡青等, 2014)中,基因在性腺及肾脏中高表达, 且该基因对黄鳝精母细胞及卵母细胞的生长及成熟起一定的作用。综上, 我们推测基因和基因在性腺和肾脏发育过程及功能维持方面发挥重要作用。
4 结论
本研究用RACE方法获得了圆斑星鲽和基因全长, 分别命名为基因和基因, 其均具有4个锌指结构, 编码 KTS三肽。基因表达结果表明:和基因主要在圆斑星鲽性腺中表达, 精巢的表达高于卵巢, 肾脏的表达量显著高于其他组织, 推测基因和基因在性腺和肾脏发育过程及功能方面均发挥重要作用;在早期发育阶段,基因在圆斑星鲽原始生殖细胞分化过程及性腺发育中发挥重要作用。基因在性腺分化过程的发挥作用仍需进一步研究。
江东能, 2016. Gsdf和Wt1在罗非鱼性别分化和性腺发育中的功能研究. 重庆: 西南大学博士学位论文, 53—74
孙近近, 2016. 牙鲆性腺相关miR-200b及dazl、wt1a基因的鉴定与表达. 上海: 上海海洋大学硕士学位论文, 29—53
杨珍珍, 边 力, 张 岩等, 2020. 圆斑星鲽基因的克隆与表达分析. 渔业科学进展, 41(2): 103—112
张 红, 陈松林, 刘 洋等, 2014. 半滑舌鳎基因的克隆与性别分化期的表达分析. 中国水产科学, 21(1): 26—36
张乐乐, 2018. 圆斑星鲽性腺分化过程及性别相关基因3、9的研究. 上海: 上海海洋大学硕士学位论文, 12—28
张乐乐, 边 力, 常 青等, 2018. 圆斑星鲽9基因的克隆与表达. 渔业科学进展, 39(6): 72—80
胡 青, 杨娇艳, 高 宇等, 2014. 黄鳝WT1基因序列分析及在性腺发育过程中的表达. 华中农业大学学报, 33(1): 73—79
柳学周, 徐永江, 廖梅杰等, 2013. 圆斑星鲽促性腺激素释放激素基因克隆及表达特性. 中国水产科学, 20(1): 12—24
康现江, 宁静允, 穆淑梅等, 2010. 半滑舌鳎早期胚胎性腺原基分化的组织学. 河北大学学报(自然科学版), 30(3): 296—300, 306
Bollig F, Mehringer R, Perner B, 2006. Identification and comparative expression analysis of a secondgene in zebrafish. Developmental Dynamics, 235(2): 554—561
Davies J A, Ladomery M, Hohenstein P, 2004. Development of an siRNA-based method for repressing specific genes in renal organ culture and its use to show that the Wt1 tumour suppressor is required for nephron differentiation. Human Molecular Genetics, 13(2): 235—246
Dong L H, Pietsch S, Englert C, 2015. Towards an understanding of kidney diseases associated withmutations. Kidney International, 88(4): 684—690
Gessler M, Poustka A, Cavenee W, 1990. Homozygous deletion in Wilms tumours of a zinc-finger gene identified by chromosome jumping. Nature, 343(6220): 774—778
Hammes A, Guo J K, Lutsch G, 2001. Two splice variants of the Wilms’ tumor l gene have distinct functions during sex determination and nephron formation. Cell, 106(3): 319—329
Hossain A, Saunders G F, 2001. The human sex-determining geneis a direct target of. The Journal of Biological Chemistry, 276(20): 16817—16823
Hossain A, Saunders G F, 2003. Role of Wilms Tumor 1 (WT1) in the transcriptional regulation of the Mullerian-Inhibiting substance promoter. Biology of Reproduction, 69(6): 1808—1814
Klamt B, Koziell A, Poulat F, 1998. Frasier syndrome is caused by defective alternative splicing ofleading to an altered ratio of WT1 +/-KTS splice isoforms. Human Molecular Genetics, 7(4): 709—714
Klüver N, Herpin A, Braasch L, 2009. Regulatory back-up circuit of medaka Wt1 co-orthologs ensures PGC maintenance. Developmental Biology, 325(1): 179—188
Kreidberg J A, Sariola H, Loring J M, 1993. WT-1 is required for early kidney development. Cell, 74(4): 679—691
Moore A W, McInnes L, Kreidberg J A, 1999. YAC complementation shows a requirement forin the development of epicardium, adrenal gland and throughout nephrogenesis. Development, 126(9): 1845—1857
Morrison A A, Viney R L, Ladomery M R, 2008. The post-transcriptional roles of WT1, a multifunctional zinc-finger protein. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer, 1785(1): 55—62
Pelletier J, Schalling M, Buckler A J, 1991. Expression of the Wilms’ tumor gene WT1 in the murine urogenital system. Genes & Development, 5(8): 1345—1356
Sharma P M, Yang X, Bowman M, 1992. Molecular cloning of rat Wilms’ Tumor complementary DNA and a study of messenger RNA expression in the urogenital system and the brain. Cancer Research, 52(22): 6407—6412
Tamura K, Peterson D, Peterson N, 2011. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 28(10): 2731—2739
Wiener J S, Marcelli M, Lamb D J, 1996. Molecular determinants of sexual differentiation. World Journal of Urology, 14(5): 278—294
Wilhelm D, Englert C, 2002. The Wilms tumor suppressor WT1 regulates early gonad development by activation of. Genes & Development, 16(14): 1839—1851
Zemann A, de Bekke A O, Kiefmann M, 2006. Evolution of small nucleolar RNAs in nematodes. Nucleic Acids Research, 34(9): 2676—2685
Zheng Q S, Wang X N, Wen Q, 2013.deficiency causes undifferentiated spermatogonia accumulation and meiotic progression disruption in neonatal mice. Reproduction, 147(1): 45—52
CLONING AND EXPRESSION OF THEGENE IN SPOTTED HALIBUT ()
YANG Zhen-Zhen1, 2, BIAN Li1, 3, ZHANG Yan1, CHEN Si-Qing1, 3, CHANG Qing1, ZHANG Sheng-Nong1, LIU Chang-Lin1, GE Jian-Long1
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China; 3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China)
The spotted halibut () is a rare and valuable marine fish species that inhabits the coast of the northern China. Mature females are much larger than males because of their faster growth. It will create substantial economic benefits to establish an all-female breeding technique for. A better understanding of sex-related genes will contribute to the improvement of a single-sex breeding technique. In this study, we successfully isolated thegene of, which is namedand. The total length ofwas3263bp, including a 1245bp open reading frame (ORF), encoding 415 amino acids, the 5′UTR was 372bp and the 3′UTR was 1640bp. The total length ofwas 2312bp, including a 1281bp open reading frame (ORF), encoding 427 amino acids, the 5′UTR was 369bp and the 3′UTR was 659bp. Through biological analysis, thegene encoded amino acids, with a predicted molecular weight of 46.2kDa and an isoelectric point of 9.24, no transmembrane structure or signal peptide site was detected, there were four zinc finger structures at the end of ORF and encode KTS. Thegene encoded amino acids, with a predicted molecular weight of 46.95kDa and an isoelectric point of 8.99, no transmembrane structure or signal peptide site was detected, there were four zinc finger structures at the end of ORF and encode KTS. Real-time fluorescence quantitative PCR technique was used to analyze the expression patterns of thegene at different stages of embryo and larvae. The results show that the expression level ofandgenes in gonads was significantly higher than other tissues’, and the expression level in the testis was significantly higher than in the ovary. Therefore, we speculated thatandgenes play important roles in gonad and kidney development and function. In the early stage of development,gene weakly expressed before the early gastrula, then the expression level gradually rose to the highest level in the neural embryo stage, followed by a decline until the hatching stage. It is speculated thatgene might played a role in the differentiation process of primitive germ cells and gonad development.
;; gene cloning; expression analysis
*中国水产科学研究院黄海水产研究所基本科研业务费项目, 20603022016005号。杨珍珍, 硕士研究生, E-mail: 1163603557@qq.com
陈四清, 博士生导师, 研究员, E-mail: chensq@ysfri.ac.cn
2020-03-04,
2020-06-08
S917.4
10.11693/hyhz20200300055
