吗替麦考酚酯治疗儿童神经系统自身免疫性疾病的疗效
2020-11-23曾意茹李小晶侯池梁惠慈陈文雄吴汶霖
曾意茹?李小晶?侯池?梁惠慈?陈文雄?吴汶霖
【摘要】目的 探討吗替麦考酚酯(MMF)治疗儿童神经系统自身免疫性疾病的疗效及安全性。方法 收集并分析12例被诊断为神经系统自身免疫性疾病且使用MMF治疗的患儿的临床资料、辅助检查结果、治疗及预后的资料。结果 12例的诊断分别为神经系统炎性脱髓鞘病8例,其中髓鞘少突胶质细胞糖蛋白(MOG) IgG相关疾病5例、水通道蛋白-4(AQP4)抗体阳性的视神经脊髓炎谱系疾病(NMOSD) 1例、多发性硬化(MS) 1例、慢性炎性脱髓鞘性多发性神经根神经病(CIDP)1例,自身免疫性脑炎(AE,抗体阴性)2例,免疫性小脑共济失调1例,眼阵挛肌阵挛综合征(OMS)1例。MMF起始剂量为0.25 g/d,维持剂量为0.25 ~ 0.5 g/d。每1 ~ 3个月定期随诊,根据临床症状和检验结果调整MMF的剂量。使用MMF前共复发39次,用药后8例患儿无复发,分别为MOG IgG相关疾病3例、AE 2例、MS 1例、CIDP 1例、免疫性小脑共济失调1例。4例患儿复发,分别为MOG IgG相关疾病2例、AQP4 IgG NMOSD 1例、OMS 1例。MMF治疗后年平均复发率较治疗前下降(中位数1.92次/年 vs. 0.00 次/年, P = 0.034)。MMF治疗前、后的改良Rankin评分比较差异有统计学意义(中位数3.00分 vs. 1.00分,P = 0.002)。治疗过程中2例患儿出现严重不良反应,分别为结核潜伏感染和重症肺炎,个别患儿仅表现为轻度胃肠反应,给予对症治疗后症状消失。结论 MMF或可降低儿童神经系统炎性脱髓鞘病及AE的复发率以及改善神经功能障碍,MMF治疗仍有复发的OMS患儿需启动其他免疫治疗,MMF治疗有可能会出现严重不良反应。
【关键词】吗替麦考酚酯;儿童;自身免疫性神经疾病;复发
Efficacy and safety of mycophenolate mofetil in treatment of pediatric immune-mediated disease of the nervous system Zeng Yiru, Li Xiaojing, Hou Chi, Liang Huici, Chen Wenxiong, Wu Wenlin. Department of Neurology, Guangzhou Women and Childrens Medical Center, Guangzhou 510623, China
Corresponding author, Li Xiaojing, E-mail: lixiaojingfy@ 163. com
【Abstract】Objective To evaluate the efficacy and safety of mycophenolate mofetil (MMF) in the treatment of pediatric immune-mediated disease of the nervous system. Methods Clinical data, auxiliary examination results, treatment and clinical prognosis of 12 children diagnosed with immune-mediated disease of the nervous system were collected and retrospectively analyzed. Results Among 12 children, 8 cases were diagnosed with inflammatory demyelinating disease including myelin oligodendrocyte-glycoprotein (MOG-IgG)-associated disease (n = 5), aquaporin-4 immunoglobulin G-positive neuromyelitis optica spectrum disorder (NMOSD-AQP4) (n = 1), multiple sclerosis (MS) (n = 1), chronic inflammatory demyelinating polyradiculoneuropathy (CIDP) (n = 1);two children were diagnosed with autoimmune encephalitis (AE, negative antibody), one child was diagnosed with autoimmune cerebellar ataxia and one child of oculomotor myoclonus syndrome (OMS). The initial dose of MMF was 0.25 g/d and the maintenance dose was ranged from 0.25 to 0.5 g/d. All children were followed up every 1-3 months. The dose of MMF was adjusted according to clinical symptoms and examination results. Before MMF treatment, all patients developed 39 times of episode, whereas 8 children had no episode after MMF treatment including 3 cases of MOG-IgG-associated disease, 2 cases of AE, 1 case of MS, 1 case of CIDP and 1 case of autoimmune cerebellar ataxia. Four patients recurred including 2 cases of MOG-IgG-associated disease, 1 case of NMOSD-AQP4 and 1 case of OMS. The median annual recurrence rate after MMF treatment was 0.00, significantly lower than 1.92 times/year before MMF treatment (P = 0.034). The median modified Rankin score significantly differed before and after MMF treatment (3.00 vs. 1.00, P = 0.002). During MMF treatment, 2 children experienced severe adverse events including latent tuberculosis infection and severe pneumonia. Two patients developed mild gastrointestinal symptoms, which were alleviated after symptomatic treatment. Conclusions MMF probably could reduce the recurrence of pediatric inflammatory demyelinating disease and AE and mitigate neurological dysfunction. Immunotherapy should be considered for OMS children with recurrence after MMF treatment. However, MMF treatment might induce severe adverse events.
【Key words】Mycophenolate mofetil;Child;Immune-mediated disease of the nervous system;
Recurrence
吗替麦考酚酯(MMF)是一种免疫抑制剂,在上世纪90年代中期首次被用于预防移植抗排斥反应。MMF在体内迅速被吸收转化为麦考酚酸(MPA), MPA可选择性抑制次黄嘌呤核苷酸脱氢酶,影响DNA复制,从而干扰T、B淋巴细胞增殖,而体细胞可通过补救途径继续合成DNA,因此对正常的体细胞无影响[1]。文献报道,MPA可以抑制细胞因子分泌,抑制B细胞激活、分化,减少浆细胞数量[2-3]。目前MMF被广泛应用于自身免疫性神经疾病中,尤其是复发性炎性脱髓鞘疾病,且疗效确切,但在儿童神经系统自身免疫性疾病中的应用报道较少[4-8]。我们发现既往未有MMF治疗儿童神经系统自身免疫性疾病的相关报道,遂对12例使用MMF治疗的患儿的临床特征、治疗、预后和不良反应进行了总结分析,探讨MMF治疗儿童自身免疫性神经疾病的疗效及安全性。
对象与方法
一、研究对象
纳入我科2013年10月1日至2020年4月1日使用MMF治疗的复发性神经系统自身免疫性疾病患儿为研究对象。纳入标准:①起病年龄 < 18岁。②复发病例,临床复发定义为病情稳定2个月后,出现新的神经系统功能缺损症状,持续 ≥ 24 h,伴或不伴影像学新病灶[9-10]。③中枢神经系统脱髓鞘病的诊断符合国际儿童多发性硬化(MS)研究组对儿童MS和免疫介导的中枢神经系统脱髓鞘疾病的诊断标准[11]。慢性炎症性脱髓鞘性多发性神经根神经病(CIPD)的诊断符合2010年欧洲神经病学联盟和周围神经病学会关于CIPD的管理指南的诊断标准[12]。免疫性小脑共济失调和眼阵挛肌阵挛综合征(OMS)的诊断符合2019年免疫介导小脑共济失调指南的诊断标准[13]。抗体阴性的自身免疫性脑炎(AE)符合Graus等(2016年)提出的诊断标准[11-14]。排除标准:①有神经系统遗传代谢性疾病、颅内感染、中毒、退行性疾病、外伤、肿瘤者。②合并结核等严重的潜在感染。本研究经我院伦理委员会批准(穗妇儿伦审批第2019052419364384号),患儿监护人均签署知情同意书。
二、研究方法
收集并分析12例被诊断为神经系统自身免疫性疾病并使用MMF治疗的患儿的临床资料、辅助检查结果、治疗及预后的资料。MMF治疗的有效性以年平均复发率(ARR,ARR = 复发次数/
年数)、改良Rankin评分(mRS)为评价指标。mRS评分用于评估患儿首次发病及末次随访时的临床神经功能缺陷程度[4]。比较患儿治疗前、后的实验室检查等结果。采用不良反应常见术语标准(CTCAE)对患儿不良反应进行分级,统计不良反应的发生情况。
三、统计学处理
采用SPSS 22.0进行统计分析。正态分布的计量资料采用描述,治疗前后各项指标比较采用配对t检验;非正态分布数据采用中位数(四分位数间距)描述,治疗前后各项指标比较采用符号秩和检验;计数资料用频数表示。P < 0.05 (双尾)为差异有统计学意义。
结果
一、纳入患儿的臨床特点
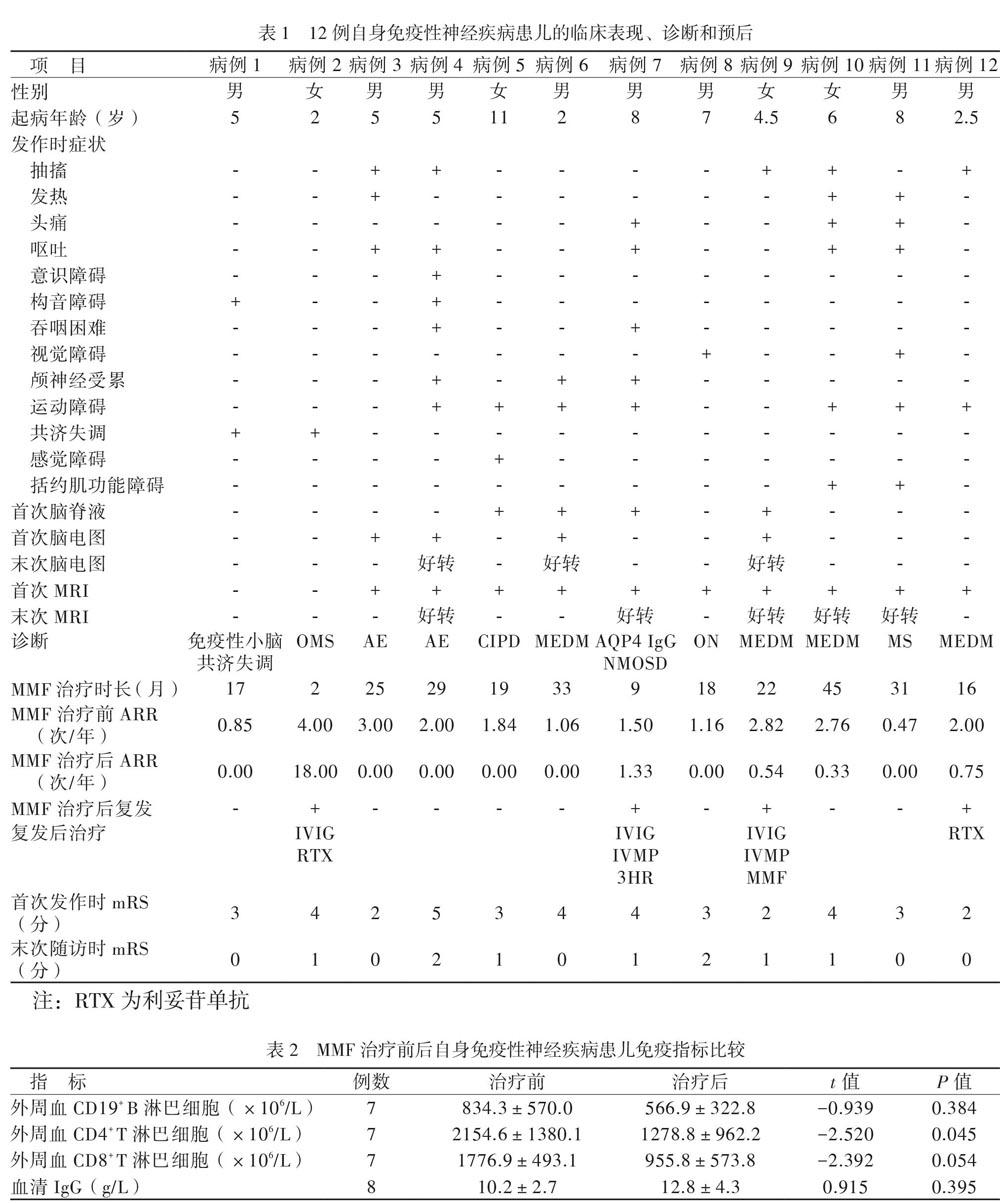
本研究共纳入12例患儿,均来自中国华南地区,男∶女为2∶1,起病年龄为(5.5±2.7)岁。12例中神经系统炎性脱髓鞘病8例:髓鞘少突胶质细胞糖蛋白(MOG)IgG相关疾病5例[4例为MOG IgG相关的多相性播散性脑脊髓炎(MEDM)、1例为MOG IgG相关的复发性视神经炎],水通道蛋白-4(AQP4)抗体阳性的视神经脊髓炎谱系疾病(NMOSD) 1例,MS 1例,CIDP 1例。其余4例为AE(抗体阴性)2例、免疫性小脑共济失调1例、OMS 1例。患儿的临床表现见表1。
二、纳入患儿的治疗方法
1.急性期治疗方案
静脉滴注人Ig(IVIG),复发急性期给予2 g/kg,总量分3 ~ 5 d滴注。静脉滴注甲泼尼龙(IVMP)冲击治疗,10 ~ 15 mg/(kg·d),共3 d,之后阶梯式减量。
2. 维持治疗
MMF使用适应证:①一线免疫治疗效果不佳;②复发≥2次。对于在肾上腺皮质激素(激素)口服减停过程中复发的患儿,在急性期病情稳定后给予MMF口服维持治疗,起始剂量为0.25 g/d,维持剂量为0.25 ~ 0.5 g/d。每1 ~ 3个月定期随诊,根据临床症状和检验结果调整MMF的剂量。
三、纳入患儿的病程
12例患儿首次发病至末次随访的时间为(41.7±16.8)个月,均接受过IVIG和IVMP治疗。12例患儿使用MMF前共复发39次,观察时间为(24.0±19.9)个月;使用MMF后共有4例复发,其中3例停用MMF,2例后续使用利妥昔单抗治疗,2例再次予IVIG和IVMP冲击治疗后病情缓解。其余8例患儿在接受MMF治疗后随访(26.5±9.0)个月,均暂无复发。
四、纳入患儿MMF治疗前、后的实验室检查结果
7例患儿MMF治疗前后行外周血CD19+ B淋巴细胞测定,治疗后较治疗前有下降趋势,但差异无统计学意义(P = 0.384)。7例患儿MMF治疗前后行外周血CD4+ T淋巴细胞测定,治疗后较治疗前下降(P = 0.045)。7例患儿MMF治疗前后行外周血CD8+ T淋巴细胞测定,治疗后较治疗前有下降趋势,但差异无统计学意义(P = 0.054)。8例患儿MMF治疗前后行血清IgG测定,治疗后与治疗前比较差异无统计学意义(P = 0.395),见表2。
五、MMF治疗的安全性
入组的12例患儿中有2例出现严重不良反应,包括1例重症肺炎,予停用MMF,行呼吸机辅助通气治疗(CTCAE 4级);1例合并结核潜伏感染,停用MMF,采用3HR方案(异烟肼加利福平,1次/日,共3个月)抗结核治疗(CTCAE 3级)。2例患儿有一过性轻度胃肠道反应(CTCAE 1级),其余患儿未出现明显不良反应。
六、MMF治療前、后的复发情况及有效性
12例患儿治疗前mRS为3.00(1.75)分,治疗后为1.00(1.00)分,治疗后较治疗前降低(Z = -3.108,P = 0.002)。
12例患儿MMF治疗前ARR为1.92(1.72)次/年。MMF治疗后4例患儿在随访过程中出现复发,12例患儿MMF治疗后的ARR为0.00(0.70)次/年,治疗前、后比较差异有统计学意义(Z = -2.118,P = 0.034)。12例患儿的临床表现、诊断、复发、预后等情况见表1。
讨论
目前对于MMF、利妥昔单抗或每月IVIG治疗作为预防MOG抗体相关脱髓鞘疾病的复发均有报道,但哪种治疗方案疗效更佳暂无统一意见[5, 15-16]。本研究纳入5例MOG IgG阳性的炎性脱髓鞘病患儿,经MMF治疗后其mRS和ARR较治疗前低,与之前的研究结果一致,提示MMF作为MOG抗体相关脱髓鞘疾病的免疫抑制维持治疗可能有助于患者神经功能的恢复及降低复发率[5, 15-16]。
本研究中的1例AQP4 IgG NMOSD患儿经MMF治疗后的mRS较治疗前低,但ARR无明显改善。MMF是成人AQP4 IgG NMOSD序贯免疫抑制治疗的一线药物,有研究显示MMF可降低AQP4 IgG NMOSD患者复发率和改善神经功能状态[17]。但本研究中的患儿治疗前后ARR下降不明显,可能与以下原因有关:①病例数过少;②治疗后随访时间尚短;③MMF用量不足,本例患儿MMF用量为5 mg/(kg·d),相对其他研究剂量偏低[18-19]。
儿童MS以复发缓解型为主,较成人患者复发率高,复发时病情更严重,预后也更差[20-22]。复发缓解型MS的治疗包括急性期治疗和疾病修饰治疗(DMT)。本研究中的1例MS患儿MMF治疗前ARR为0.47次/年,治疗后随访31个月无复发,提示MMF或可降低儿童MS的复发率。另外MMF为口服用药,有更好的接受度。我们认为MMF或可作为儿童DMT的选择。
MMF治疗周围神经脱髓鞘病鲜有报道,本研究中1例CIPD患儿在使用MMF后病情得到长期缓解,提示MMF对于中枢神经和周围神经炎性脱髓鞘疾病可能有良好的疗效。
MMF主要用于复发或一线免疫治疗不佳的AE患者[23]。本研究2例AE患儿分别在第3次和第4次复发后采用MMF治疗,分别治疗25个月和29个月,均无复发,mRS也均较治疗前低,结果与其他同类研究相似[4, 18]。
目前治疗OMS多采用激素、ACTH、Ig和血浆置换,但治疗后复发率可达50%。本研究中的1例OMS患儿在起病6个月时加用MMF治疗,但在用药2个月内出现2次复发,其后采用利妥昔单抗联合每1 ~ 3个月输注IVIG治疗,目前随访13个月无复发。与既往报道中对于多次复发的OMS患者选择单用利妥昔单抗或与其他免疫抑制剂(如Ig)联用可改善临床症状以及减少复发相似[24]。
本研究中有2例患儿因出现较严重感染而停用MMF。MMF可通过抑制T、B淋巴细胞增殖和细胞因子的产生达到免疫抑制作用,但也可增加感染的风险[2-3]。我们发现经MMF治疗后患儿的CD4+ T淋巴细胞水平较治疗前降低,这提示在以后的研究中既应考虑MMF治疗的效果,也应根据疾病的免疫致病机制动态监测相关的免疫指标,从而选择适合的MMF剂量和疗程,在达到抑制免疫的同时又能降低感染的风险。综上所述,MMF或可降低儿童神经系统炎性脱髓鞘病及AE的复发率以及改善神经功能障碍,MMF治疗仍有复发的OMS患儿需启动其他免疫治疗,MMF治疗有可能会出现严重不良反应,但发生率较低,仍较为安全。
参 考 文 献
[1] Nosadini M, Sartori S, Sharma S, Dale RC. Immunotherapeutics in pediatric autoimmune central nervous system disease: agents and mechanisms. Semin Pediatr Neurol,2017,24(3):214-228.
[2] Broen JCA, van Laar JM. Mycophenolate mofetil, azathioprine and tacrolimus: mechanisms in rheumatology. Nat Rev Rhe-umatol,2020,16(3):167-178.
[3] Allison AC, Eugui EM. Mycophenolate mofetil and its mec-hanisms of action. Immunopharmacology,2000,47(2-3):85-118.
[4] Nosadini M, Mohammad SS, Toldo I, Sartori S, Dale RC. Mycophenolate mofetil, azathioprine and methotrexate usage in paediatric anti-NMDAR encephalitis: a systematic literature review. Eur J Paediatr Neurol, 2019,23(1):7-18.
[5] Hamid SHM, Whittam D, Saviour M, Alorainy A, Mutch K, Linaker S, Solomon T, Bhojak M, Woodhall M, Waters P, Appleton R, Duddy M, Jacob A. Seizures and encephalitis in myelin oligodendrocyte glycoprotein IgG disease vs aquaporin 4 IgG disease. JAMA Neurol,2018,75(1):65-71.
[6] Hacohen Y, Banwell B. Treatment approaches for MOG-Ab-associated demyelination in children. Curr Treat Options Neurol, 2019,21(1):2.
[7] 徐曉璐. 吗替麦考酚酯治疗自身免疫性脑炎临床与免疫指标观察. 北京:北京协和医学院, 2017.
[8] 黄艳露, 邱伟. 吗替麦考酚酯在神经系统免疫性疾病中的临床应用进展. 新医学,2016,47(4):210-213.
[9] Kleiter I, Gahlen A, Borisow N, Fischer K, Wernecke KD, Wegner B, Hellwig K, Pache F, Ruprecht K, Havla J, Krumbholz M, Kümpfel T, Aktas O, Hartung HP, Ringelstein M, Geis C, Kleinschnitz C, Berthele A, Hemmer B, Angstwurm K, Stellmann JP, Schuster S, Stangel M, Lauda F, Tumani H, Mayer C, Zeltner L, Ziemann U, Linker R, Schwab M, Marziniak M, Then Bergh F, Hofstadt-van Oy U, Neuhaus O, Winkelmann A, Marouf W, Faiss J, Wildemann B, Paul F, Jarius S, Trebst C; Neuromyelitis Optica Study Group. Neuromyelitis optica: Evaluation of 871 attacks and 1,153 treatment courses. Ann Neurol,2016,79(2):206-216.
[10] Titulaer MJ, McCracken L, Gabilondo I, Armangué T, Glaser C, Iizuka T, Honig LS, Benseler SM, Kawachi I, Martinez-Hernandez E, Aguilar E, Gresa-Arribas N, Ryan-Florance N, Torrents A, Saiz A, Rosenfeld MR, Balice-Gordon R, Graus F, Dalmau J. Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis: an observational cohort study. Lancet Neurol,2013,12(2):157-165.
[11] Krupp LB, Tardieu M, Amato MP, Banwell B, Chitnis T, Dale RC, Ghezzi A, Hintzen R, Kornberg A, Pohl D, Rostasy K, Tenembaum S, Wassmer E; International Pediatric Multiple Sclerosis Study Group. International pediatric multiple sclerosis study group criteria for pediatric multiple sclerosis and immune-mediated central nervous system demyelinating disorders: revisions to the 2007 definitions. Mult Scler,2013,19(10):1261-1267.
[12] Van den Bergh PY, Hadden RD, Bouche P, Cornblath DR, Hahn A, Illa I, Koski CL, Léger JM, Nobile-Orazio E, Pollard J, Sommer C, van Doorn PA, van Schaik IN; European Federation of Neurological Societies; Peripheral Nerve Society. European federation of neurological societies/peripheral nerve society guideline on management of chronic inflammatory demyelinating polyradiculoneuropathy: report of a joint task force of the european federation of neurological societies and the peripheral nerve society-first revision. Eur J Neurol,2010,17(3):356-363.
[13] Mitoma H, Manto M, Hampe CS. Immune-mediated cerebellar ataxias: practical guidelines and therapeutic challenges. Curr Neuropharmacol,2019,17(1):33-58.
[14] Graus F, Titulaer MJ, Balu R, Benseler S, Bien CG, Cellucci T, Cortese I, Dale RC, Gelfand JM, Geschwind M, Glaser CA, Honnorat J, H?ftberger R, Iizuka T, Irani SR, Lancaster E, Leypoldt F, Prüss H, Rae-Grant A, Reindl M, Rosenfeld MR, Rostásy K, Saiz A, Venkatesan A, Vincent A, Wandinger KP, Waters P, Dalmau J. A clinical approach to diagnosis of autoimmune encephalitis. Lancet Neurol,2016,15(4):391-404.
[15] Ramanathan S, Mohammad S, Tantsis E, Nguyen TK, Merheb V, Fung VSC, White OB, Broadley S, Lechner-Scott J, Vucic S, Henderson APD, Barnett MH, Reddel SW, Brilot F, Dale RC; Australasian and New Zealand MOG Study Group. Clinical course, therapeutic responses and outcomes in relapsing MOG antibody-associated demyelination. J Neurol Neurosurg Psychiatry,2018,89(2):127-137.
[16] Hacohen Y, Wong YY, Lechner C, Jurynczyk M, Wright S, Konuskan B, Kalser J, Poulat AL, Maurey H, Ganelin-Cohen E, Wassmer E, Hemingway C, Forsyth R, Hennes EM, Leite MI, Ciccarelli O, Anlar B, Hintzen R, Marignier R, Palace J, Baumann M, Rostásy K, Neuteboom R, Deiva K, Lim M. Disease course and treatment responses in children with relapsing myelin oligodendrocyte glycoprotein antibody-associated disease. JAMA Neurol,2018,75(4):478-487.
[17] Paolilo RB, Hacohen Y, Yazbeck E, Armangue T, Bruijstens A, Lechner C, Apostolos-Pereira SL, Martynenko Y, Breu M, de Medeiros Rimkus C, Wassmer E, Baumann M, Papetti L, Capobianco M, Kornek B, Rostásy K, da Paz JA, Ciccarelli O, Lim M, Saiz A, Neuteboom R, Marignier R, Hemingway C, Sato DK, Deiva K. Treatment and outcome of aquaporin-4 antibody-positive NMOSD: a multinational pediatric study. Neurol Neuroimmunol Neuroinflamm,2020,7(5):e837.
[18] Nosadini M, Gadian J, Lim M, Sartori S, Thomas T, Dale RC. Mycophenolate mofetil in paediatric autoimmune or immune-mediated diseases of the central nervous system: clinical experience and recommendations. Dev Med Child Neurol,2019,61(4):458-468.
[19] Montcuquet A, Collongues N, Papeix C, Zephir H, Audoin B, Laplaud D, Bourre B, Brochet B, Camdessanche JP, Labauge P, Moreau T, Brassat D, Stankoff B, de Seze J, Vukusic S, Marignier R; NOMADMUS study group and the Observatoire Fran?ais de la Sclérose en Plaques (OFSEP). Effectiveness of mycophenolate mofetil as first-line therapy in AQP4-IgG, MOG-IgG, and seronegative neuromyelitis optica spectrum disorders. Mult Scler,2017,23(10):1377-1384.
[20] Simone M, Chitnis T. Use of disease-modifying therapies in pediatric MS. Curr Treat Options Neurol,2016,18(8):36.
[21] Waldman A, Ghezzi A, Bar-Or A, Mikaeloff Y, Tardieu M, Banwell B. Multiple sclerosis in children: an update on clinical diagnosis, therapeutic strategies, and research. Lancet Neurol,2014,13(9):936-948.
[22] Chitnis T. Disease-modifying therapy of pediatric multiple sclerosis. Neurotherapeutics,2013,10(1):89-96.
[23] 中华医学会神经病学分会. 中国自身免疫性脑炎诊治专家共识. 中华神经科杂志,2017,50(2):91-98.
[24] Ma GM, Chow JS, Taylor GA. Review of paraneoplastic syndromes in children. Pediatr Radiol,2019,49(4):534-550.
(收稿日期:2020-06-30)
(本文編辑:洪悦民)
