SMI 联合BI-RADS-US 分类在乳腺癌诊断中的价值研究
2020-11-23王帅
王 帅
(锦州医科大学附属第一医院超声科,辽宁 锦州 121001)
乳腺癌成为女性最常见的恶性肿瘤之一[1],近年来,随着环境污染及饮食文化的改变,乳腺癌的发病率及死亡率呈逐年上升趋势[2],且趋于年轻化,严重影响女性身心健康,导致生活质量降低。因此,能够做到早发现、早诊断、早治疗,是降低乳腺癌死亡率的关键,能够使女性的生活质量得到改善,且生存时间得以延长[3]。
据研究[4-5],乳腺良恶性病变的血流信号特征不同,可作为鉴别病灶性质的依据之一,乳腺肿瘤的起源、进展、侵袭和转移均与血管生成有密切相关性[6]。新近发展起来的超微血管成像技术(Superb microvascular imaging,SMI)[7]通过自适应计算方法,可以将低速血流信号从组织移动产生的信号中分离并显示,已应用于甲状腺、乳腺、肝脏等部位,实现对肿瘤微血管低速血流的检测。本研究通过回顾性分析,旨在研究SMI 技术联合BI-RADS-US 分类在乳腺癌诊断的应用价值。
1 资料与方法
1.1 研究对象
2018 年12 月—2019 年12 月于锦州医科大学附属第一医院乳腺外科就诊的乳腺疾病患者136 例共174 个肿块,患者均为女性,年龄24~75 岁,平均(44.61±12.91)岁。所有病灶最终均经过手术后病理检查或细针穿刺抽吸细胞学检查确诊。排除标准:患者超声检查及术前均未行放化疗;由于病灶内囊性成分及钙化对病灶内部血流的判断有影响,于钙化部位出现快闪伪像,故排除囊性结节及伴有钙化结节。另由于乳腺腺体深方肿瘤血流显示不敏感,故排除位于腺体深方肿瘤。
1.2 检查方法
使用TOSHIBA 彩色多普勒超声仪,探头频率7~13 MHz,配备SMI 成像软件。检查时,患者取仰卧位,两臂外展90°,充分暴露胸部及腋窝,采用纵切、横切及放射状扫查方法,常规检查整个乳腺,然后重点检查病变区域,自肿瘤一侧缓慢移动至另一侧,选取肿瘤最大且尽可能清晰切面冻结,记录下肿瘤的位置、大小、边缘回声、是否有包膜及包膜完整程度、形态、纵横比、内部回声、是否有砂砾样钙化、与周围组织分界、测量肿块体积(长度×宽度×厚度×0.52)、腋窝淋巴结大小及形态;于肿瘤血管最丰富切面冻结图像,彩色多普勒显示肿块内部及周边部的血流分布情况与丰富程度,观察频谱多普勒测量收缩期峰值流速(PSV)、阻力指数(RI)。启动SMI 软件记录肿块内是否存在新生低流速血管,同时联合BIRADS-US 分类标准对病灶进行半定量诊断评价。
1.3 诊断标准
采用Alder 半定量分级法[8]提出的4 个等级:0级为病灶内未见血流;Ⅰ级为少量血流,可见1~2个点状血流或短柱状血流信号;Ⅱ级为中量血流,可见3~4 处点状血流或1 条长度超过或接近肿瘤半径的血流;Ⅲ级为血流丰富,可见5 处以上点状血流、或2 条以上重要血管或血管交织成网状。
超声BI-RADS-US 分类按照新版分类标准[9],BI-RADS 2 类,良性;3 类,恶性<2%;4a 类,恶性2%~<30%;4b 类,恶性 30%~<70%;4c 类,恶性70%~<95%;5 类,恶性≥95%。BI-RADS-US 分类≥4b 类为诊断乳腺癌标准。
所有病例由两位高年资超声医师操作并单独诊断得出结论,当出现结果不一致时,再次展开上述检查且最终诊断结果达成一致后得出结论。所有患者均以病理学诊断结论为金标准。
1.4 统计学方法
采用SPSS 21.0 统计软件进行分析,计量资料数据以均数±标准差(±s)表示,计数资料以例数表示,等级资料的比较采用秩和检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 病理结果
本研究136 例患者共174 个肿块,良性肿块98个(纤维腺瘤72 个,导管内乳头状瘤14 个,腺病7个,不典型增生3 个,脂肪坏死结节2 个);恶性肿瘤76 个(浸润性乳腺癌56 个,导管内原位癌15 个,浸润性小叶癌3 个,小叶原位癌2 个)。
2.2 良恶性肿瘤的SMI 血流Alder 分级比较
良性肿瘤以0~Ⅰ级为主(图1,2),其中0~Ⅰ级占96.94%(95/98),Ⅱ~Ⅲ级占3.06%(3/98);恶性肿瘤以Ⅱ~Ⅲ级为主(图3,4),其中0~Ⅰ级占10.53%(8/76),Ⅱ~Ⅲ级占89.47%(68/76)。差异均具有统计学意义(P<0.05),两组之间血流检出率无明显差异(P>0.05),见表1。
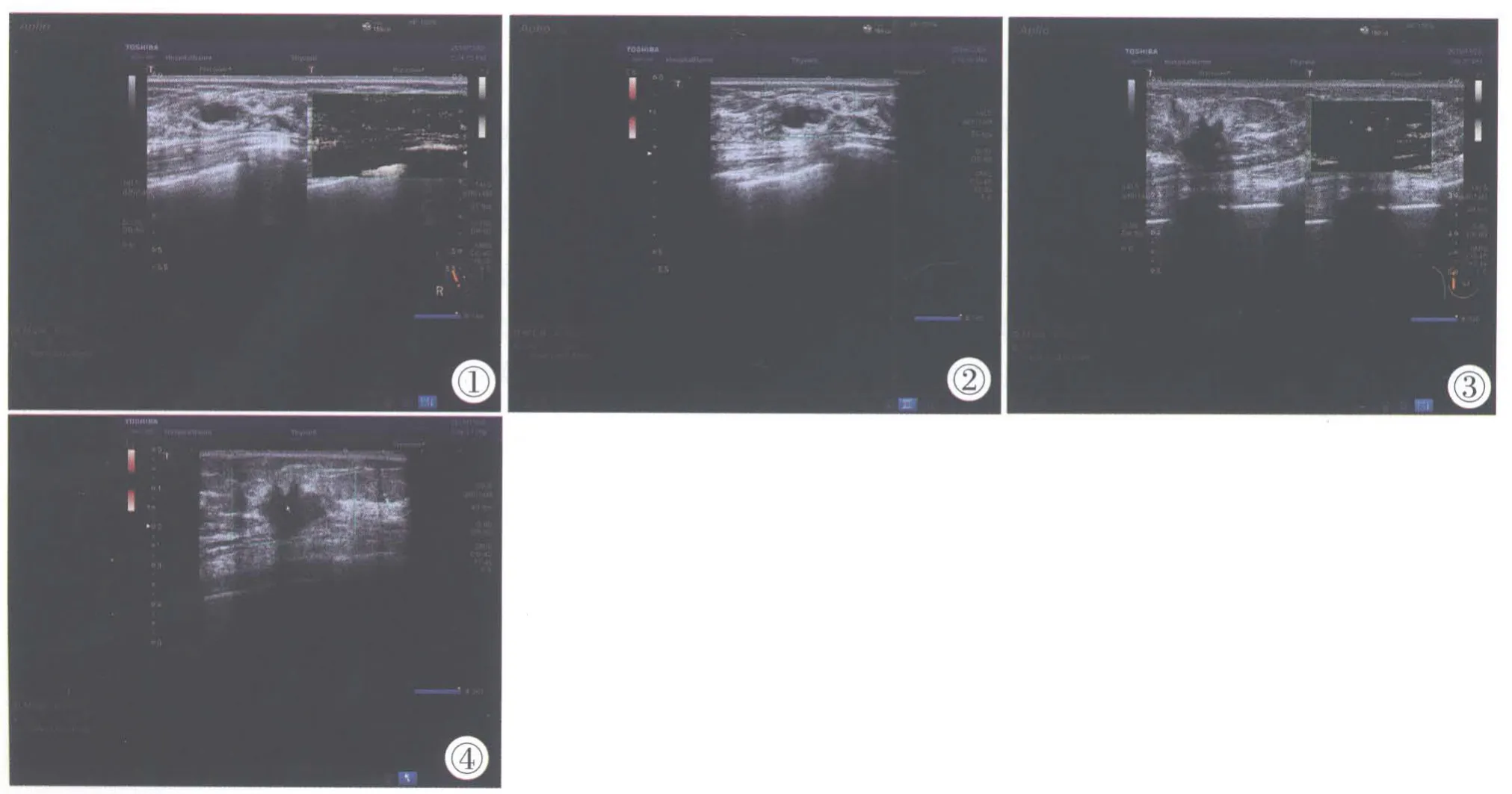
图1 良性肿瘤mSMI(灰阶模式)图像。图2 cSMI(彩色模式)图像。图3 恶性肿瘤mSMI(灰阶模式)图像。图4 cSMI(彩色模式)图像。Figure 1.mSMI of benign tumors (gray scale mode).Figure 2.cSMI of benign tumors(color mode).Figure 3.mSMI of malignant tumors (gray scale mode).Figure 4.cSMI of malignant tumors(color mode).
2.3 SMI 联合BI-RADS-US 分类评价诊断乳腺良恶性肿瘤的结果
单独应用BI-RADS-US 分类法诊断与SMI 技术联合BI-RADS-US 分类法诊断的结果进行比较见表2。以乳腺癌病理诊断作为金标准。单独应用BI-RADS-US 诊断方法的灵敏度为77.63%,特异度为83.67%,准确度为61.30%;SMI 技术联合BIRADS-US 分类诊断方法的灵敏度为94.74%,特异度为91.84%,准确度为86.58%。后者的灵敏度、特异度及准确度均有提高,且差异有明显统计学意义(χ2=9.108,4.117,10.895,均P<0.05),见表3。
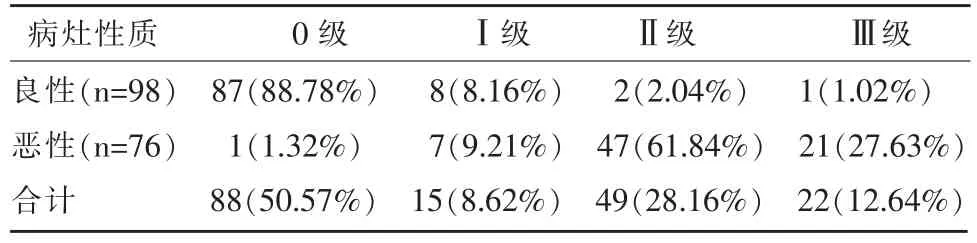
表1 良、恶性肿瘤的SMI 血流Adler 分级比较
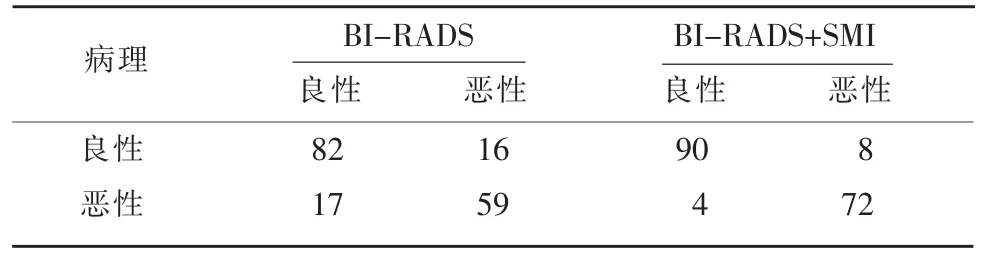
表2 单独应用BI-RADS-US 分类法诊断及SMI 技术联合BI-RADS-US 分类法诊断结果比较
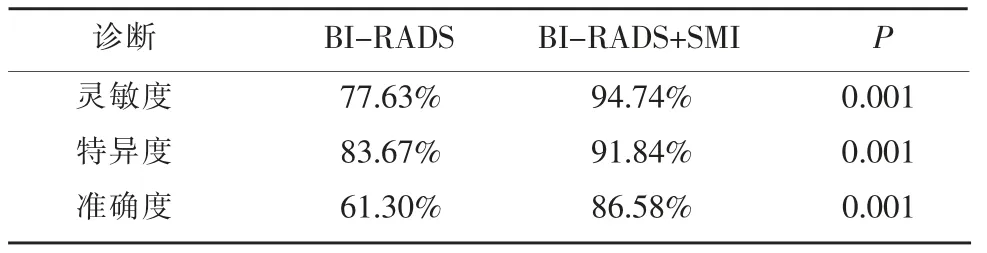
表3 单独应用BI-RADS-US 分类诊断方法与SMI 技术联合BI-RADS-US 分类诊断方法的灵敏度、特异度、准确度的比较
3 讨论
近年来,乳腺癌发病率居女性肿瘤的首位,乳腺癌的早期发现并治疗直接影响患者的预后[10]。目前,评价乳腺癌常用的检查方法有临床触诊、钼靶、MRI及彩色多普勒超声、超声造影等。临床触诊不可避免人为误差;钼靶对致密型乳腺较为敏感;MRI 诊断正确率较高,但费用较高;超声造影操作复杂、有致敏风险。
超声波具有无创伤、无辐射、可灵活实时使用、价格低廉、可短期内重复探查、容易被患者接受等诸多优势,已成为筛查乳腺疾病的重要检查方式,不仅能显示肿瘤的形态学特征,还可利用彩色多普勒和频谱多普勒显示肿瘤的血流分布、血流动力学等参数[11-13],而传统彩色多普勒(CDFI)只能对管径>0.2 mm 以及流速较高的血流信号显示较为敏感,对于肿瘤微血管显示不够清晰[14]。
近年来随着超声医学的发展及科技的进步,超微血管成像技术-SMI 技术包括灰阶模式mSMI 及彩色模式cSMI 应运而生,这是一种基于彩色多普勒机制基础上,利用高密度波束形成器和实时应用平台装置,采用多普勒新算法即自适应算法甄别,可对杂波运动特性进行准确性分析,过滤掉组织自身运动所产生的噪声,通过高帧频显像、使空间分辨率得到提高、同时减少运动产生的伪像,具有更高的灵敏度的技术,具有显示病变的微小血管及低速血流信号的能力[15],即管径>0.1 mm 的微小血管,能够弥补传统CDFI 在检测微血管内低速血流信号的不足,且无需使用造影剂进行超声造影即可获得病灶内微血流成像等特点[16-17]。此外,SMI 技术还可显示肿物内部血管数量及形态,本研究显示,良性肿瘤中血流显示以0~Ⅰ级为主,恶性肿瘤中血流显示以Ⅱ~Ⅲ级为主,这是由于在肿瘤血管生成因子的作用下,恶性肿瘤与良性肿瘤相比较存在许多新生的异常血管,不仅数量较良性肿瘤多,且形态及分布不规则,SMI 技术在提供乳腺肿物血管形态学特征信息方面具有一定优势[7]。与单独应用BI-RADS-US 诊断方法相比,SMI 技术联合BI-RADS-US 诊断方法的灵敏度、特异度、准确度均有提高,差异具有统计学意义(P<0.05)。这表明二者的联合应用能够使各自的优势得到充分发挥,诊断效能得到极大提高。
本研究的不足之处:首先,样本量偏小,其次,SMI 的血流Adler 分级存在着无法避免的人为主观性,对于研究结果存在一定程度的误差,仍需要今后进一步研究,使微血管血流成像对乳腺良、恶性肿瘤的评估更为全面。
SMI 技术对于微血管内低速血流的显示具有较为独特的优势,可为临床提供更多诊疗信息,联合BI-RADS-US 分类有助于评估乳腺疾病的良恶性,能够提高超声医师对于乳腺病灶良、恶性的诊断正确率,提高诊断信心,具有临床推广价值。
