基层医院1例肝巨大血管瘤成功切除的经验总结*
2020-11-23侯宝英赵春选张伟
侯宝英 赵春选 张伟
肝血管瘤是成人最常见的肝脏良性肿瘤,发病率为1.50%~2.95%[1-2]。随着健康体检的普及和影像学检查手段的进步,其检出率日益增多。体积较小的血管瘤无任何症状,且增长速度较慢或不增长,可以观察而非选择手术。但体积较大、特殊部位、增长较快的血管瘤或血管瘤压迫周围脏器产生相应症状者,以及某些较大血管瘤可引起合并有凝血功能障碍的Kasabach-Merritt 综合征,或引起血栓和栓塞的风险,应积极行手术治疗。现报告1例高原地区肝右叶巨大血管瘤患者成功实施右半肝切除术。
1 材料与方法
1.1 病例资料
患者,女性,48岁,因“反复发作上腹部疼痛两年余,频繁发作半月,伴纳差”于2020年5月19日收入院。体格检查:平卧位腹部饱满,右上腹可触及直径约40 cm×30 cm×30 cm质地中等肿物,上起肝脏肋缘下,下至盆腔。腹部无明显压痛,移动性浊音阴性。化验血常规:白细胞低伴贫血。白细胞数(WBC)1.89×109/L,血红蛋白浓度(HGB)89.0 g/L,血小板191×109/L。生化全项:丙氨酸氨基转移酶(ALT)34 U/L,天冬氨酸氨基转移酶(AST)44 U/L,谷氨酸氨基转移酶(GGT)116 U/L,碱性磷酸酶(ALP)118 U/L。凝血功能:凝血酶原时间(PT)12.7(9~14)秒。活化部分凝血活酶时间(APTT)23(23~40)秒。总胆红素(TB)13.9 μmol/L,直接胆红素(DB)4.8 μmol/L。肝功能Child-Pugh 评分5 分,分级为Child-Pugh A 级。流行病检测:乙肝病毒表面抗原(HBsAg)阴性;丙肝抗体(HCV-Ab)阴性。肿瘤标志物:甲胎蛋白(AFP)3.3 ng/mL(阴性),癌类抗原19-9(CA19-9)10.9 U/mL(阴性)。上腹强化CT提示(图1):肝右叶巨大血管瘤,直径35 cm×25 cm×20 cm。通过“IQQA 精准手术规划系统”建立肝脏三维可视化模型(图2),按照右半肝切除、保留左半肝的手术方案,计算残肝体积为1 260 mL。采用成都公式[3]计算标准肝脏体积:ESLV=11.5×BW+334=1 139 mL。残肝体积/标准肝体积>100%,手术切除方案安全。通过“IQQA精准手术规划系统”显示血管变异。该患者存在肝动脉变异,即肝右动脉直接发自肠系膜上动脉,肝中静脉与肝左静脉为最常见的共干类型。

图1 上腹强化CT显示肝右叶巨大血管瘤,直径35 cm×25 cm×20 cm
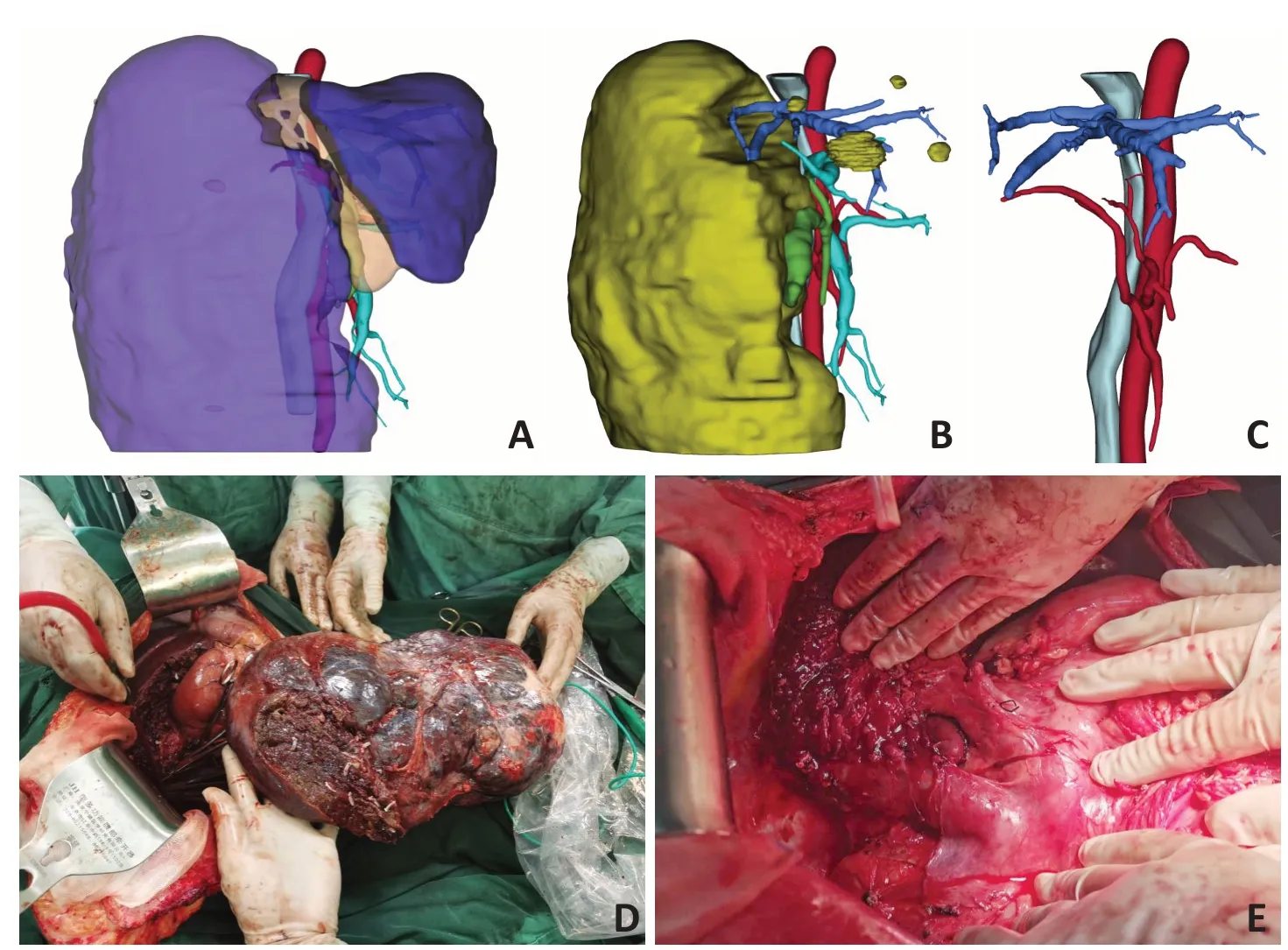
图2 术前三维可视化和手术导航成功施行肝巨大血管瘤切除
1.2 方法
经术前积极进行输血、营养支持、吸氧、心理支持等准备,输红细胞4个单位后复查HB 82.0 g/L,考虑贫血改善不明显与血管瘤关系密切,于2020年6月1日成功行肝巨大血管瘤切除术。
1.2.1 选择右半肝切除术而非血管瘤剥除术 血管瘤剥除可以最大程度保留肝体积,但由于血管瘤巨大,压迫周围管道结构可能出现解剖变异,切面不规则,容易造成胆道损伤、残留肝脏的缺血或淤血。而规则右半肝切除操作均在肝内进行,切面上除细小交通支血管外,主要为右侧Glisson分支和肝右静脉、肝短静脉,手术操作方便。该患者残肝体积足够,行规则的右半肝切除术安全。
1.2.2 术前模拟切除过程 通过“IQQA 精准手术规划系统”[4-5],对肝脏切除面上所有的动脉、门静脉分支、胆道分支、肝静脉的解剖形态进行仔细分析,精确处理,避免损伤肝内管道结构。
1.2.3 术中采用低中心静脉压技术(low central venous pressure,LCVP)[6-7]麻醉时保证患者的中心静脉压在5 mmHg以下,减少来自肝静脉的渗血。利用肝血管瘤以肝动脉供血为主的特点,术中先行分离并结扎肝右动脉,引起血管瘤张力减小、血管瘤萎缩,并通过物理挤压使得血管瘤内部的血液回输至全身循环,达到“自体输血”的目的,使得术中出血量明显减少。另外,术中应重视技术细节,结扎肝右动脉时力度应适中,如全力结扎容易损伤动脉内膜,有可能形成假性动脉瘤;而用60%的力量结扎肝右动脉,既能使肝右动脉管腔完全闭塞,又不损伤动脉内膜,从而预防可能出现的假性动脉瘤及其破裂出血等并发症。
劈肝过程中遵循先处理流入道后处理流出道的原则,并在肝内处理流入道和流出道,最大程度保证手术的安全性。依肝实质优先原则,先劈离肝脏,处理左右半肝之间小的交通支血管;处理至第一肝门处,于肝内处理右半肝的Glisson 分支。此时右半肝和血管瘤的流入管道完全关闭,但肝右静脉和肝短静脉的流出道仍可回流部分血液至下腔静脉及全身,从而达到自体输血的目的。之后沿肝右静脉与肝中静脉之间,分离肝脏至下腔静脉前方,此时双重钳夹肝右静脉主干根部,依次结扎或缝扎肝右静脉及各肝短静脉。
2 结果
术中共阻断第一肝门2次,时间分别为10 min和15 min。患者术中生命体征平稳,手术成功。患者术后第2 天即可下地活动,术后2 周出院。术后1 个月复查,患者体力恢复正常,血常规正常,肝脏体积增加到1 465 mL。术前计算保留的肝脏体积为1 260 mL,肝脏增生205 mL(图3)。
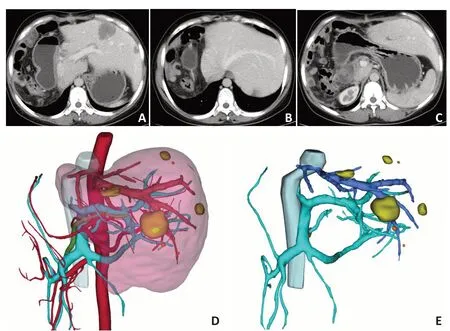
图3 显示术后复查残肝的三维重建:术后1个月复查,肝脏体积恢复到1 465 mL。术前计算保留的肝脏体积为1 260 mL,肝脏增生205 mL
3 讨论
该血管瘤体积巨大,患者一般状态差,贫血、白细胞降低严重,血氧饱和度偏低,术前邀请肝胆外科、介入科、影像科、麻醉科多学科联合会诊,制定最佳治疗方案。
影像科医生:肝血管瘤的影像学表现非常具有特征性,即动脉期呈周边结节样强化特点,而门脉期呈渐进性填充。本例诊断肝右叶巨大血管瘤特征明显,诊断明确。肝血管瘤直径超过10 cm即属于肝巨大血管瘤,本例血管瘤直径达35 cm,非常罕见。
介入科医生:介入治疗也是肝血管瘤的治疗手段之一[8-10]。介入治疗理论上通过栓塞血管瘤的供血动脉,可使血管瘤供血减少、体积缩小,但由于较大血管瘤常存在侧支血管,单支栓塞并非完全阻断血管瘤的动脉血供;且介入之后血管瘤缺氧可通过缺氧诱导因子(HIF-1α)从膈肌、网膜等周围组织诱导新生血管,逐渐代偿,因此对部分血管瘤而言,介入治疗可引起血管瘤体积缩小,但缩小的血管瘤经过数年的代偿还可继续生长;介入栓塞血管瘤导致血管瘤坏死后,还可能引起继发性感染、反复感染等并发症,可加重患者痛苦[11]。因此,如果有条件,对肝巨大血管瘤应积极行手术治疗。若患者一般情况较差,亦可考虑先行介入治疗,通过明胶海绵和(或)弹簧圈先行栓塞肝右动脉,1 个月后复查,再决定是否行手术治疗。
肝胆外科医生:肝血管瘤巨大,且患者反复发作上腹部疼痛两年余,近半个月频繁发作且伴纳差,考虑肿瘤压迫十二指肠及小肠、结肠,有手术切除指征;应根据术前三维可视化模型制定详细的手术方案,并请麻醉科医生会诊指导围手术期管理,确保手术安全。巨大血管瘤由于血管瘤内分流了大量血液,容易引起出血等风险,且术中一旦血管瘤破裂,由于血管瘤巨大,操作空间受限,可能引起大出血甚至生命危险。因此,血管瘤尤其是巨大血管瘤的切除应在有丰富肝脏外科经验的中心进行。手术切除肝巨大血管瘤应重视手术技术和技巧[12-13],对于基层医院,由于手术体量小,学习曲线的完成时间较长,可充分利用“IQQA精准手术规划系统”明确肝脏的三维可视化解剖结构,并对手术切面上管道的处理做好充分的预案[14-17]。可利用肝血管瘤动脉供血为主的特点,劈肝之前可先行阻断肝动脉,或结扎血管瘤的供血动脉,可在5 min 内迅速降低血管瘤的压力,从而使血管瘤萎缩[18]。劈肝过程中,应先处理流入道,后处理流出道,即采用“前入路”的肝切除技术,可以在术中进一步促进血管瘤内的血液回流全身循环。近期腹腔镜肝血管瘤切除手术也得到越来越多的报道,可以选择性采用。
麻醉科医生:患者重度贫血,且高原地区氧含量低,术前查血气分析和肺功能,并给予术前吸氧等措施完善术前准备。术中存在大出血风险,术前应充分备血,当术中出血过多过快时,应暂停手术,及时补充血容量,预防术中失血性休克和脏器功能损伤。术中血压控制非常重要,切肝过程中行LCVP(中心静脉压<5 mmHg,即0.665 kPa或6.78 cm H2O,最理想的是2.1~3.0 mmHg,即2.85~4.10 cm H2O),采取药物控制性降压,可减少肝癌肝切除术中出血量,缩短住院时间,降低住院费用,有利于患者的术后恢复[19-21]。
综上所述,肝血管瘤的手术切除应熟练掌握手术指征和技术,并与麻醉医师充分合作。通过精准的术前解剖评估和手术方案规划,采用LCVP、先阻断血管瘤供血动脉、先流入道后流出道的前入路整体手术策略,以及精细的手术操作技巧,肝巨大血管瘤的切除是安全可行的。
