代谢综合征与上皮卵巢癌发病风险及临床病理特征的相关性研究
2020-11-23窦金利李昉璇李世霞刘俊田
窦金利 李昉璇 李世霞 刘俊田
据统计,癌症已成为中国首要死亡原因,女性卵巢癌的发病率和死亡率呈明显上升趋势[1]。而卵巢癌中约95%是上皮性卵巢癌(epithelial ovarian cancer,EOC),死亡率居妇科恶性肿瘤之首。目前,对于卵巢癌的发病原因、患病机制尚未达成共识,但已有研究证实代谢综合征(metabolic syndrome,MetS)与多种癌症的发生发展相关[2]。MetS 是一组以多种代谢相关因素异常为特征的临床综合征,包括中心性肥胖、高血压、血糖升高、甘油三酯(triglyceride,TG)升高和高密度脂蛋白胆固醇(high-density liptein cholesterol,HDL-C)降低[3]。研究表明MetS 可增加女性患乳腺癌和子宫内膜癌风险[4]。但MetS与EOC的发病风险研究目前较少,本研究通过病例对照研究,分析MetS与EOC的发病风险及临床病理特征的相关性。
1 材料与方法
1.1 病例资料
回顾性分析2015年3月至2019年12月于天津医科大学肿瘤医院收治的1 138例EOC患者,排除合并其他恶性肿瘤的患者32例,最终纳入1 106例作为EOC组;根据EOC组不同年龄段(间隔5岁)选取同期本院行常规体检的1 136 例健康体检人员,排除患有卵巢疾病、子宫切除或癌症病史者16例,最终纳入1 120例作为对照组。
1.2 方法
1.2.1 检测方法 自行设计患者一般资料调查表,采用统一指导语进行问卷资料收集。病史采集时使用标准方法测量身高、体质量,取3 次测量平均值为最终值,对照组患者在体检前完成资料收集。取安静15 min后仰卧位或坐位血压测量值。空腹8~12 h后静脉采血10 mL,采用酶促比色试验检验TG,均质酶比色试验检验HDL-C,葡糖糖氧化酶法检验空腹血糖(fasting plasma glucose,FPG)。身体质量指数(body mass index,BMI)计算=体质量(kg)/身高(m)2。
1.2.2 MetS 诊断标准 MetS 根据中国糖尿病学会(CDS)定义[5]的具有下述3 种或3 种以上异常:1)BMI≥25.0 kg/m2;2)FPG≥6.1 mmol/L 或2 小 时血 糖(2-hour plasma glucose,2hPG)≥7.8 mmol/L 和(或)已确诊糖尿病并治疗者;3)收缩压≥140 mmHg 或舒张压≥90 mmHg 和(或)已确诊高血压并治疗者;4)TG≥1.7 mmol/L和(或)HDL-C<1.0 mmol/L。
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析。计量资料采用x±s描述,分类变量采用Fisher's 精确检验和χ2检验进行比较,Logistic 回归分析发病风险及相关性。以P<0.05为差异具有统计学意义。
2 结果
2.1 EOC组与对照组患者基本资料
EOC 组和对照组的平均年龄分别为(51.98±8.74)岁和(52.48±9.28)岁,绝经年龄分别为(50.90±7.13)岁和(50.10±7.82)岁,平均BMI 指数分别为(25.29±3.52)和(24.18±3.78),首次怀孕年龄分别为(23.59±4.20)岁和(23.87±4.65)岁。EOC组和对照组的年龄、怀孕次数、绝经年龄、是否使用激素、首次怀孕年龄、BMI 等进行比较差异均无统计学意义(P>0.05),MetS、TG、HDL-C 异常及高血压、糖尿病更多见于EOC 组患者,与对照组相比差异均具有统计学意义(P<0.01,表1)。
2.2 MetS与EOC发病风险的相关性分析
因MetS 的发生率随年龄增加而增加,且年龄与多项指标相关,故将年龄纳入Logistic 回归分析以矫正混杂因素,年龄矫正后发现除BMI 外,MetS(OR=4.844,95%CI:3.704~6.440)及其含的各项代谢因素均增加EOC发病风险(P<0.001,表2)。
2.3 EOC 组中合并MetS 与未合并MetS 患者的病理特征比较
合并MetS 与未合并MetS 患者的肿瘤分化等级、国际妇产科联合会(FIGO)分期、淋巴结转移进行比较差异均具有统计学意义(P<0.001)。271例EOC合并MetS 的患者中,99 例(36.5%)肿瘤分化程度较低,222 例(81.9%)FIGO 分期为晚期,59 例(21.8%)有淋巴结转移(表3)。
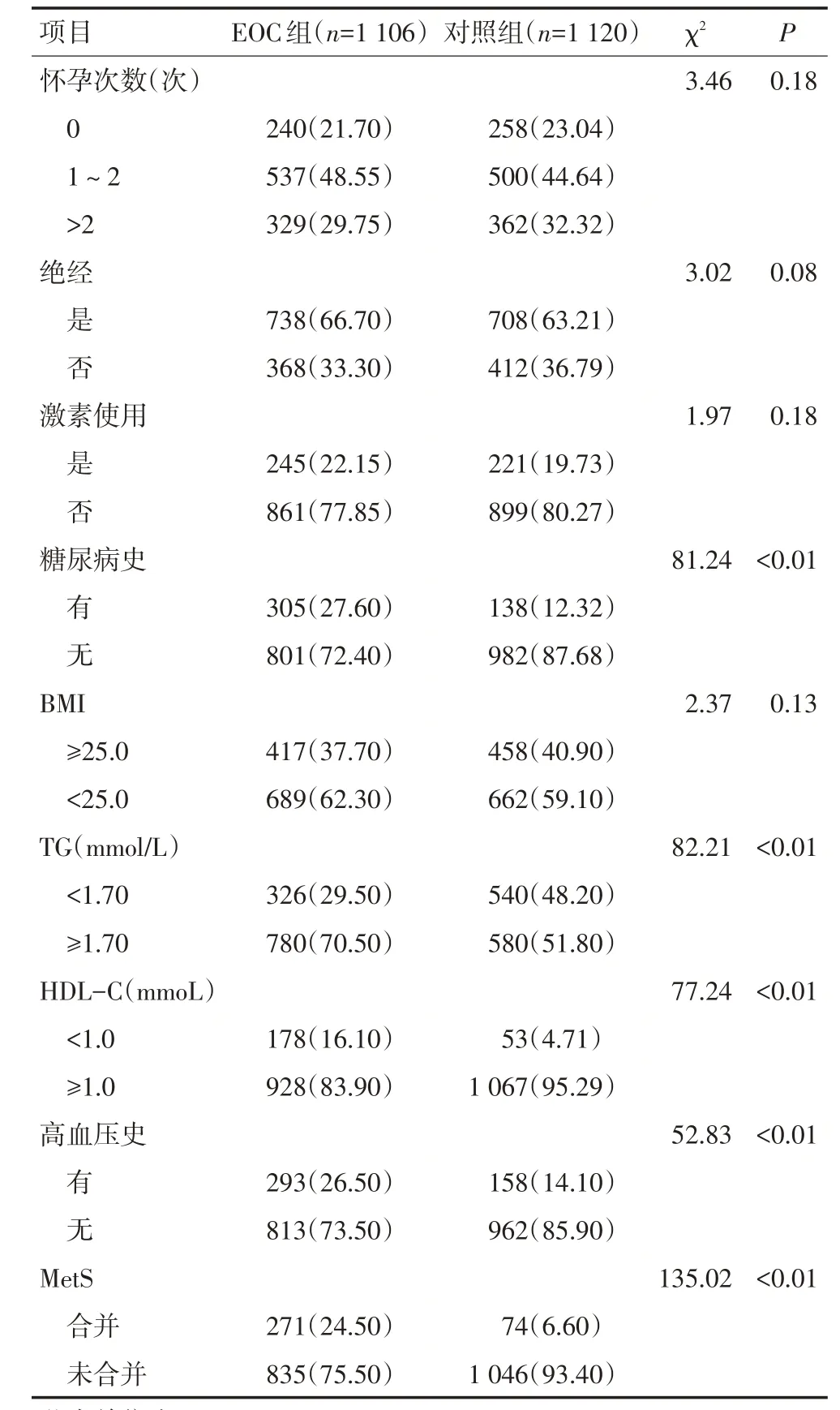
表1 EOC组和对照组患者的基本资料比较
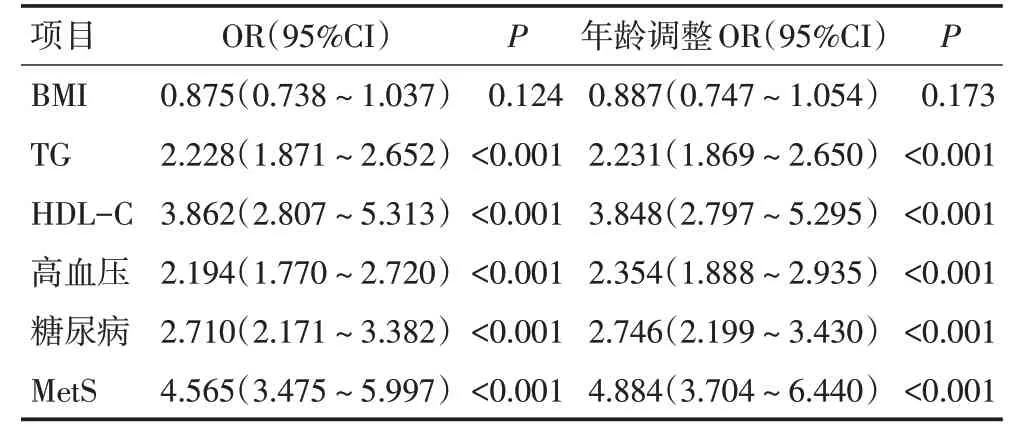
表2 MetS与EOC发病风险的相关性分析
2.4 MetS与EOC患者的临床病理特征相关性分析
将年龄作为调整变量代入Logistic回归分析发现,MetS 与EOC 患者的FIGO 分期(OR=1.724,95%CI:1.215~2.447)、肿瘤分化等级(OR=2.725,95%CI:0.990~3.732)、淋巴结转移(OR=2.084,95%CI:1.444~3.006)相关(P<0.001),BMI与FIGO分期,TG、HDL-C与肿瘤分化等级,高血压与FIGO分期、肿瘤分化等级,糖尿病与FIGO分期、淋巴结转移相关(表4)。

表3 EOC患者中合并MetS与未合并MetS患者的临床病理特征比较
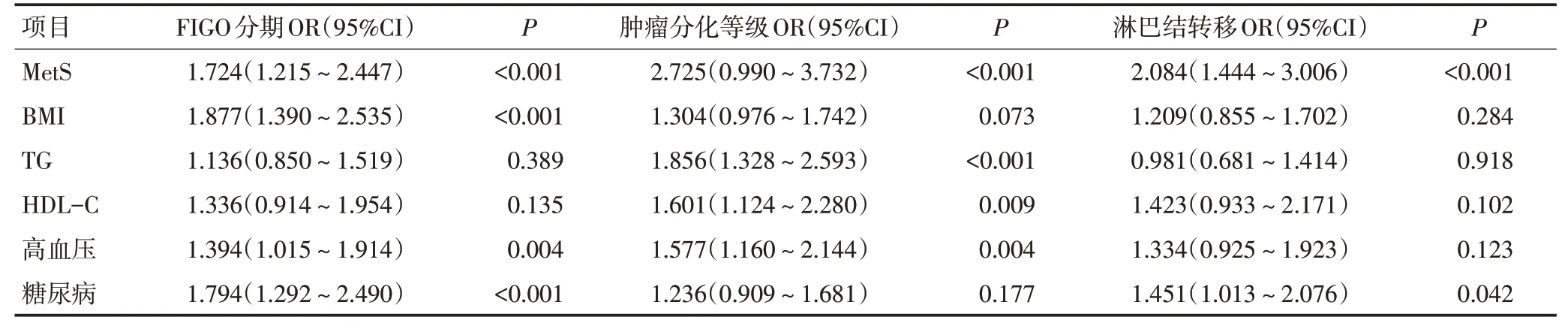
表4 MetS与EOC患者的临床病理特征相关性分析
3 讨论
MetS是由Reavan[6]于1988年首次提出并为公认的临床鉴定标准,最初被认为是一组能更好地预测心血管疾病和糖尿病发病率的风险因素。研究证实,MetS可增加多种癌症的发病风险[2],本研究发现1 106例EOC组的TG≥1.70 mmol/L患者为780例(70.50%)、HDL-C<1.0 mmol/L患者为178例(16.10%),明显多于对照组的580例(51.80%)、53例(4.71%),与Sun等[7]的研究结果一致。本研究Logistic回归分析发现,MetS及其包含的各项代谢因素均可增加EOC发病风险,与Michels等[8]的研究结果略有不同,该研究认为MetS与卵巢癌发病风险无相关性,但其中的高血压、TG、HDL-C与卵巢癌相关,这可能与研究对象的地域、种族不同有关,未来可多中心联合研究MetS与卵巢癌发病风险的相关性。
本研究发现,合并MetS 的EOC 患者比未合并者更易发生肿瘤分化等级较低、FIGO 分期为晚期和淋巴结转移,表明合并MetS 的EOC 患者的临床病理特征更易发生恶性转化。Logistic 回归分析显示,MetS预示了EOC患者有FIGO分期为晚期、肿瘤分化等级较低和淋巴结转移的风险,与梁晓峰等[9]的研究结果一致。这可能与肿瘤微环境代谢错综复杂有关,肿瘤组织中的癌细胞、成纤维细胞、内皮细胞、免疫炎性细胞等成分会分解消耗细胞能量和避免免疫破坏,导致肿瘤抗原特异性CD8+肿瘤浸润淋巴细胞“功能衰竭”,造成低氧和低血糖环境,进而促进肿瘤生长[2]。因此,MetS 与EOC 细胞的相互作用值得进一步研究,以减慢卵巢癌的发生发展。
研究证实,肥胖与食管癌、结肠癌、子宫内膜癌等多种癌症密切相关[10]。本研究以BMI≥25 kg/m2作为超重及肥胖标准,Logistic 回归分析显示BMI 与EOC患者的FIGO分期相关,与Erondu等[11]的研究结果一致。这可能是由于机体中的肥胖因子如肿瘤坏死因子(TNF)、白细胞介素-6(IL-6)、瘦素和脂连素等可直接或间接导致癌症发生[10],且瘦素在卵巢癌中存在高表达现象,通过多种信号通路参与调控卵巢癌的多种恶性表型[12]。
本研究中高TG、低HDL-C水平预示了EOC患者的肿瘤分化等级较低,与Zhang 等[13]的研究结果一致,表明脂代谢与EOC 的临床病理特征关系密切。脂肪细胞与脂肪来源的干细胞(adipose-derived stem cells,ADSC)可改变卵巢癌细胞的糖、脂代谢方式,ADSC 来源的精氨酸能诱导卵巢癌细胞中一氧化氮(nitrogen,NO)的合成,NO 浓度升高,线粒体有氧呼吸被抑制,使葡萄糖经无氧酵解及磷酸戊糖途径代谢,利于癌细胞的存活[14],因此及早调控EOC患者的TG、HDL-C水平,有可能阻止其恶化。
本研究发现,合并高血压的EOC患者有FIGO 分期为晚期、肿瘤分化等级较低的特点。这与合并高血压EOC 患者血清中的血管内皮生长因子(VEGF)作用机制有关,VEGF可侵蚀肿瘤组织的血管并获得营养,促进肿瘤组织的自我增殖[15]。因此,及早调节控制高血压,可能会降低EOC 患者的肿瘤恶性程度。本研究亦显示,糖尿病与EOC患者的FIGO分期为晚期及淋巴结转移相关,与Sun等[7]的研究结果一致。这可能与胰岛素抵抗、糖代谢异常、癌基因与抑癌基因的表达异常等相关,研究表明糖尿病患者体内胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)水平较高,而IGF-1 可诱导细胞分化,增加细胞恶变的可能[16]。
综上所述,MetS可增加EOC发病风险,MetS预示EOC 患者的FIGO 分期为晚期、肿瘤分化等级较低和淋巴结转移。
