胃肠道间质瘤病人中性粒细胞淋巴细胞比值和血浆纤维蛋白原对预后的判断价值
2020-11-23孙虎孙颖
孙虎 孙颖
胃肠道间质瘤是胃肠道最常见的间质肿瘤,占所有胃肠道肿瘤的1%~2%[1]。许多临床病理特征与胃肠道间质瘤预后相关,如有丝分裂指数、肿瘤大小等[2],但其预测预后的特异度低。全身性炎症可以通过抑制细胞凋亡和促进血管生成来促进肿瘤进展和转移[3]。中性粒细胞淋巴细胞比值(NLR)是反应全身性炎症反应的指标之一,据报道,高水平的NLR与多种实体肿瘤的不良预后有关[4]。研究表明,癌症属于血栓前状态,纤维蛋白原(FIB)-血小板轴在肿瘤生物学中的具有重要作用[5],但FIB对胃肠道间质瘤预后的影响仍不明确。本研究观察术前NLR以及血浆FIB水平对可手术胃肠道间质瘤预后的预测价值。
对象与方法
一、对象
我院2015年1月~2018年12月接受手术治疗的可手术胃肠道间质瘤病人85例,年龄34~71岁,平均年龄(48.2±7.5)岁,平均体质量指数(23.5±4.1)kg/m2,平均肿瘤直径(5.1±1.9)cm,肿瘤位于胃部45例,肠道40例,NIH危险度分级极低危5例,低危27例,中危19例,高危34例。纳入标准:接受手术治疗,术后病理证实为胃肠道间质瘤;病人年龄>18岁且<80岁;术前未接受放化疗、免疫治疗、伊马替尼治疗;签署研究同意书。排除标准:术前或术中可疑转移;纳入研究前存在凝血功能异常或近3个月服用阿司匹林等影响凝血功能药物;合并其他肿瘤、血液系统疾病、急慢性感染、精神疾病、严重心、脑、肝脏疾病者;类风湿疾病等可能影响NLR者。
二、方法
检测方法:术前24小时抽取外周静脉血约5 ml,检测中性粒细胞和淋巴细胞水平并计算NLR比值。血浆FIB水平采用免疫比浊法检测。
随访方法:自手术日开始随访,随访终止时间为2020年2月。术后2年内每3个月随访1次,术后3~5年每6个月随访1次。随访方式为门诊及电话随访,随访终点为死亡。观察无进展生存期(Progression-free survival,PFS)及总生存期(overall survival,OS)。PFS指出现进展或死亡的时间或随访终止时间减去开始随访时间,OS指出现死亡的时间或随访终止时间减去开始随访时间。40例中危和高危病人术后辅助伊马替尼[甲磺酸伊马替尼片(格列卫),产品编号D14200223061,规格0.1g,Novartis Pharma Schweiz AG]治疗,起始400 g/d剂量,疾病进展可增加至600~800 g/d。
三、统计学分析
使用SPSS26.0软件分析资料,采用Kaplan-Meier法并Log-rank检验绘制胃肠道间质瘤病人的生存曲线,比较不同资料病人的生存差异,采用多因素Cox分析胃肠道间质瘤病人预后的影响因素,采用ROC曲线观察NLR、FIB对胃肠道间质瘤死亡的预测价值,并使用约登指数获得NLR、FIB截断值。P<0.05为差异有统计学意义。
结 果
1.NLR、FIB对胃肠道间质瘤生存率预测价值:随访时间14~60个月,平均随访(46.9±6.8)个月,失访5例,随访率为94.1%,死亡10例。ROC曲线分析结果显示,NLR、FIB预测生存的曲线下面积为0.77(95%CI:0.60~0.86,P<0.05),0.72(95%CI:0.58~0.83,P<0.05),NLR、FIB最佳截断值分别为2.20、3.90 g/L。NLR联合FIB预测全部病人生存的灵敏度为68.2%,特异度为86.3%。见图1。分层分析显示,NLR联合FIB预测不同类型胃肠道间质瘤病人生存的价值见表1。其中NLR联合FIB预测中高危胃肠道间质瘤的价值较高。

表1 NLR联合FIB预测不同类型胃肠道间质瘤病人生存的价值

图1 NLR、FIB预测胃肠道间质瘤生存的ROC曲线
2.NLR、FIB与PFS和OS的关系:根据NLR、FIB最佳截断值将病人分为高NLR组(>2.20,30例)及低NLR组(≤2.20,50例),高FIB组(>3.90 g/L,32例)及低FIB组(≤3.90 g/L,48例)。Kaplan-Meier法并Log-rank检验结果显示,高NLR组PFS及OS较低NLR组短,差异有统计学意义(Log-rank χ2=5.580、4.566,P=0.018、0.033);高FIB组PFS及OS较低FIB组短,差异有统计学意义(Log-rank χ2=5.321、5.563,P=0.021、0.018)。见图2~5。
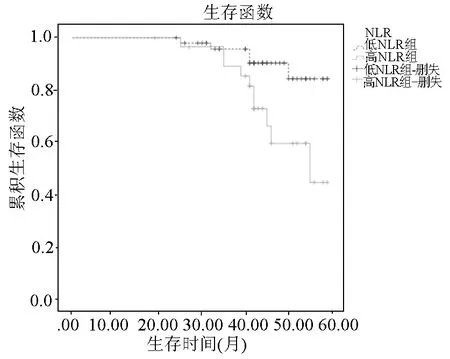
图2 不同NLR病人PFS曲线
3.PFS影响因素分析:Kaplan-Meier法并Log-rank检验显示,NLR、FIB、肿瘤危险度及肿瘤大小是PFS影响因素(P<0.05),见表2。多因素Cox分析显示,NLR(P=0.012,OR:2.103,95%CI:1.223~9.668)、FIB(P=0.020,OR:1.526,95%CI:1.102~8.214),肿瘤危险度(P=0.010,OR:2.225,95%CI:1.265~11.254)是PFS的独立影响因素。

图3 不同NLR病人OS曲线

图4 不同FIB病人PFS曲线

图5 不同FIB病人OS曲线

表2 PFS的单因素分析
4.OS影响因素分析:Kaplan-Meier法并Log-rank检验显示,年龄、NLR、FIB、肿瘤危险度是OS影响因素(P<0.05),见表3。多因素Cox分析显示,NLR(P=0.035,OR:1.355,95%CI:1.101~5.236)、FIB(P=0.040,OR:1.268,95%CI:1.069~4.215)、肿瘤危险度(P=0.015,OR:1.854,95%CI:1.203~8.998)是OS的独立影响因素(P<0.05)。

表3 OS的单因素分析
讨 论
原发性局部胃肠道间质瘤的主要治疗方法为切缘阴性的手术切除,但是手术后原始疾病的复发或转移是生存时间缩短的重要原因。据报道,接受手术治疗的胃肠道间质瘤病人约50%会复发,而且复发后的中位生存期不到2年[6]。如果胃肠道间质瘤复发或转移,则手术的价值较低。选择有效标志物可帮助临床早期筛选预后较差病人进行针对性治疗。
系统性炎症反应是癌症重要的预后指标,如NLR[7]。本研究证实,高NLR是可手术胃肠道间质瘤病人PFS和OS的危险因素,高NLR病人预后不良。Feng等[8]和Kargin等[9]研究认为,NLR高的胃肠道间质瘤病人预后明显低于低NLR,本研究结果与之相符。有研究发现,接受伊马替尼治疗的胃肠道间质瘤病人外周血中性粒细胞计数升高可预示不良的治疗反应[10]。NLR被视为体内炎症和免疫状态的综合标志物。NLR水平升高可反映炎症增加或(和)免疫反应降低。因此,高水平的NLR与肿瘤的预后不良有关。然而少数研究未发现NLR与胃肠道间质瘤预后之间存在相关性,可能与研究病例数不足及检测方法差异有关[11]。NLR可重复且廉价,作为预后指标价值较高。
本研究证实,高FIB水平的胃肠道间质瘤病人预后不良,与既往研究结果相符[12]。FIB是一种主要由肝细胞产生的糖蛋白,作为重要的凝血因子,有助于调节凝血途径。FIB可在凝血过程中促进细胞黏附和炎症。有研究表明,FIB水平升高的肿瘤侵袭和转移的风险增高,如胃癌和食管癌[13-14]。FIB在肿瘤的黏附和靶器官的血管转移中起着重要作用。另外,FIB可促进生长因子融合以及细胞黏附,与肿瘤细胞增殖和迁移有关。有研究证实,FIB片段通过抑制肿瘤血管生成和结合并下调血管内皮细胞的表达来促进肿瘤进展[15]。FIB在肿瘤进展中作用的确切机制仍不清楚,需要进一步研究。Cai等[15]研究认为,高FIB病人预后差可能与高FIB水平促进胃肠道间质瘤生长导致肿瘤进展有关。
本研究中,NLR联合FIB预测胃肠道间质瘤生存的特异度高,其中NLR联合FIB预测中高危胃肠道间质瘤的价值较高。Arigami等[16]研究证实,NLR联合FIB可用于预测胃肠道间质瘤的预后,本研究结果与之相符。血浆FIB及血常规的检测为常规检测指标,容易获得。在手术前,临床医生可通过NLR、FIB粗略预测胃肠道间质瘤病人的预后,给予早期干预治疗,从而获得更好的预后。特别是对于那些无法获得病理结果的病人,使用这些血液学指标来预测胃肠道间质瘤的预后尤为重要。本研究为单中心、非随机对照研究,样本量有限,需要更多的前瞻性研究来验证这些指标的预测价值。
综上,NLR、FIB升高的可手术胃肠道间质瘤病人预后较差。术前血浆FIB、NLR可用于预测病人预后,NLR联合FIB对预测胃肠道间质瘤生存率具有较高价值。
