叶螨乙酰胆碱酯酶在pColdⅡ中的表达及活性分析
2020-11-21韦显星张翼鹏李梦怡卜春亚
韦显星,李 博,张翼鹏,丁 超,杨 金,彭 博,李梦怡,卜春亚
(北京农学院 生物与资源环境学院/农业农村部华北都市农业重点实验室,北京 102206)
朱砂叶螨(Tetranychuscinnabarinus)是一种世界性害螨,对农业造成很大危害[1,2]。目前,对朱砂叶螨的防治有生物防治、农业防治与药剂防治等措施[3],其中农药防治应用最广泛,但现有杀虫剂存在影响非靶标生物以及残留等问题。
乙酰胆碱酯酶(acetylcholinesterase,AChE)是神经传导的关键酶[4],是有机磷和氨基甲酸酯类农药靶标[5,6]。目前,乙酰胆碱酯酶抑制剂[7-9],主要有植物源[10,11]、微生物源以及化学合成类[12,13]。随着有机磷和氨基甲酸酯类农药的大量使用,对哺乳动物发育中的神经的危害逐渐显现[14]。鉴于对环境和人畜的危害以及朱砂叶螨对其抗性问题,急需开发新型选择型杀螨剂。
AChE的体外高效表达,在选择性杀螨剂的研制中尤为重要。Lang[15]等比较了鳞翅类昆虫的两种AChE的抑制动力学。Ilg[16]等表达了两种蚤类AChE并测定抑制活性。Kim[17]等研究了马铃薯甲虫AChE突变体的功能。彭博[18]等采用重组朱砂叶螨AChE筛选体外抑制化合物,但重组蛋白的活性还有待提高。在AChE抑制化合物的筛选中,重组蛋白具有特异性和重复性好、干扰少以及方便易得等特点,是较好的选择。
此研究拟探究朱砂叶螨ace基因中疏水序列以及不同表达载体对其表达效果的影响,建立AChE体外高效表达纯化体系,为抑制朱砂叶螨AChE活性化合物的筛选以及新型选择性杀螨剂的研发提供试验指向。
1 材料与方法
1.1 材 料
菌株和载体:E.coliDH5α、E.coliBL21(DE3)购自天根生化科技(北京)有限公司;ace原核表达重组质粒pET-30a/ace-1842(基因全长)由农业农村部华北都市农业重点实验室保存。
主要试剂:限制性内切酶(EcoR Ⅰ、SalⅠ和XhoⅠ)、Primer STAR Max DNA Polymerase、dNTP购自Takara公司,蛋白Marker购自北京聚合美生物科技有限公司,江苏康为生化试剂有限公司的Cocktail蛋白酶抑制和One Step Western Kit HRP(rabbit),TIANpure Mini Plasmid Kit、DNA Marker购自天根生化科技(北京)有限公司,Ni-NTA购自GE Healthcare,BCA蛋白定量试剂盒购自Thermo Scientific公司。
1.2 方 法
1.2.1 pET-30a/ace-1782、pCold Ⅱ/ace-1842和pCold Ⅱ/ace-1782原核表达载体的构建 以保存的T/ace-1842质粒为模板,设计特有引物(见表1),F1、R1扩增ace-1782(pCold Ⅱ);引物F1、R2扩增ace-1842(pCold Ⅱ); F2、R1扩增ace-1782(pET-30a)。PCR扩增条件为:98 ℃预变性5 min,98 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃保温10 min。琼脂糖凝胶电泳鉴定并回收目的片段。
随后,T4连接酶分别连接用限制性内切酶消化的目的基因与空表达载体pCold Ⅱ和pET-30a,转化E.coliDH5α感受态,构建pET-30a/ace-1782、pCold Ⅱ/ace-1842、pCold Ⅱ/ace-1782原核表达载体经双酶切鉴定后,送测鉴定。
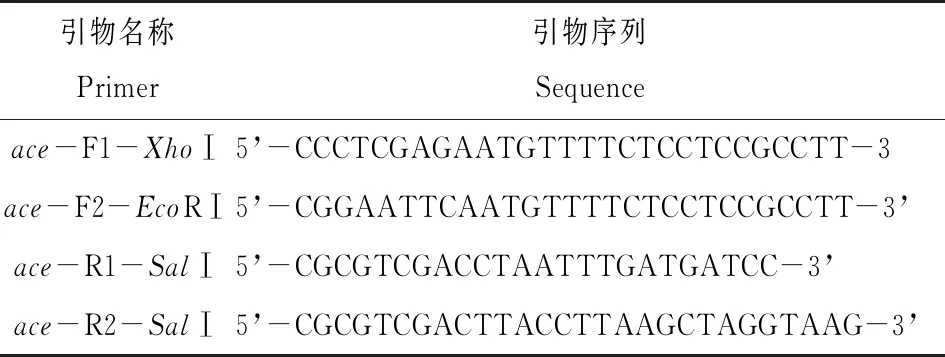
表1 不同形式ace基因扩增引物
1.2.2 重组质粒在大肠杆菌中的诱导表达 将鉴定正确的阳性质粒转入感受态细胞E.coliBL21(DE3)。挑取阳性菌株单菌落活化并逐步扩大培养。pET-30a表达载体于37 ℃、180 r/min震荡培养至OD600 nm值为0.6~0.8,加入终浓度1 mmol/L IPTG,28 ℃诱导7 h。pCold Ⅱ表达载体于37 ℃、180 r/min震荡培养至OD600 nm值为0.4~0.6,加入终浓度0.4 mmol/L IPTG,15 ℃诱导24 h。诱导后离心清洗并收集菌体,保存于-80 ℃待用。
1.2.3 目的蛋白的纯化 诱导表达后的菌体,每升菌液用20 mL结合缓冲液A(2.7 mmol/L KCl、140 mmol/L NaCl、1.8 mmol/L KH2PO4、10 mmol/L Na2HPO4,pH 8.0)重悬,加入1 mmol/L PMSF、200 μL Cocktail蛋白酶抑制剂,冰上搅拌30 min。200 W功率破碎菌体140个循环。
将离心后的上清液与已平衡的Ni-NTA在4 ℃条件下结合2 h。用结合缓冲液和50 mM的咪唑缓冲液洗去未吸附和非特异性结合蛋白,用200 mmol/L的咪唑缓冲液洗脱目的蛋白。收集流出峰进行SDS-PAGE电泳进一步分析。用Amicon©Ultra-15浓缩并置换缓冲液,目的蛋白溶液于-80 ℃保存。
1.2.3 Western Blot分析 目的蛋白SDS-PAGE电泳后,100 V恒压电转2 h到PVDF膜上后,按照康为One Step Western Kit HRP(rabbit)试剂盒说明书进行操作,室温封闭PVDF膜5 min,本实验室制备的抗AChE特异性抗体孵育后,用ECL化学发光试剂盒进行检测。
1.2.4 BCA蛋白定量和酶活力测定 按照Thermo Scientific公司BCA蛋白定量试剂盒说明书,建立蛋白浓度-吸光值标准曲线,测定各种AChE蛋白与螨粗提液的蛋白浓度。按文献[1]制备螨粗提液。
按照改进的Ellman法测定AChE重组蛋白活性[15],以50 mmol/L Tris-HCl(pH 8.0)作为空白对照组;在试验组中加入100 μL 50 mmol/L Tris-HCl(pH 8.0),80 μL相同浓度的各种AChE重组蛋白或螨粗提液。随后每孔加入显色剂DNTB(0.4 mmol/L DTNB,1.5 mmol/LNaHCO3) 20 μL和底物ATChI (1 mmol/L) 40 μL。室温孵育后测定412 nm处吸光值。重复3次。
计算AChE重组蛋白与螨粗提液活性[19],SPSS 19.0进行活性差异显著性分析。
分析AChE去掉疏水区对其表达效果的影响,比较AChE在pET-30a和pCold Ⅱ两种表达载体中的表达效果。
1.2.5 毒扁豆碱对各种形式的AChE活性的抑制 96孔板中加入各种形式的 AChE分别和5个不同浓度梯度(终浓度为0~2 mM)的毒扁豆碱的预混液,每个处理重复3个孔。50 mM Tris-HCl(pH 8.0)作为空白对照, AChE作为阳性对照,如上所述测定酶的剩余活性。利用SPSS 19.0卡方检验计算毒扁豆碱对各种形式AChE的半数抑制浓度,进行差异显著性分析。
2 结果与分析
2.1 不同形式ace原核表达载体的构建
将构建好的pET-30a/ace-1782、pET-30a/ace-1842、pCold Ⅱ/ace-1782与pCold Ⅱ/ace-1842进行双酶切鉴定,结果如图1所示,ace去疏水区以及野生型ace全长分别构建的pCold Ⅱ与pET-30a重组质粒,双酶切鉴定结果正确,测序验证正确说明原核表达载体构建成功,可以用于后续表达。
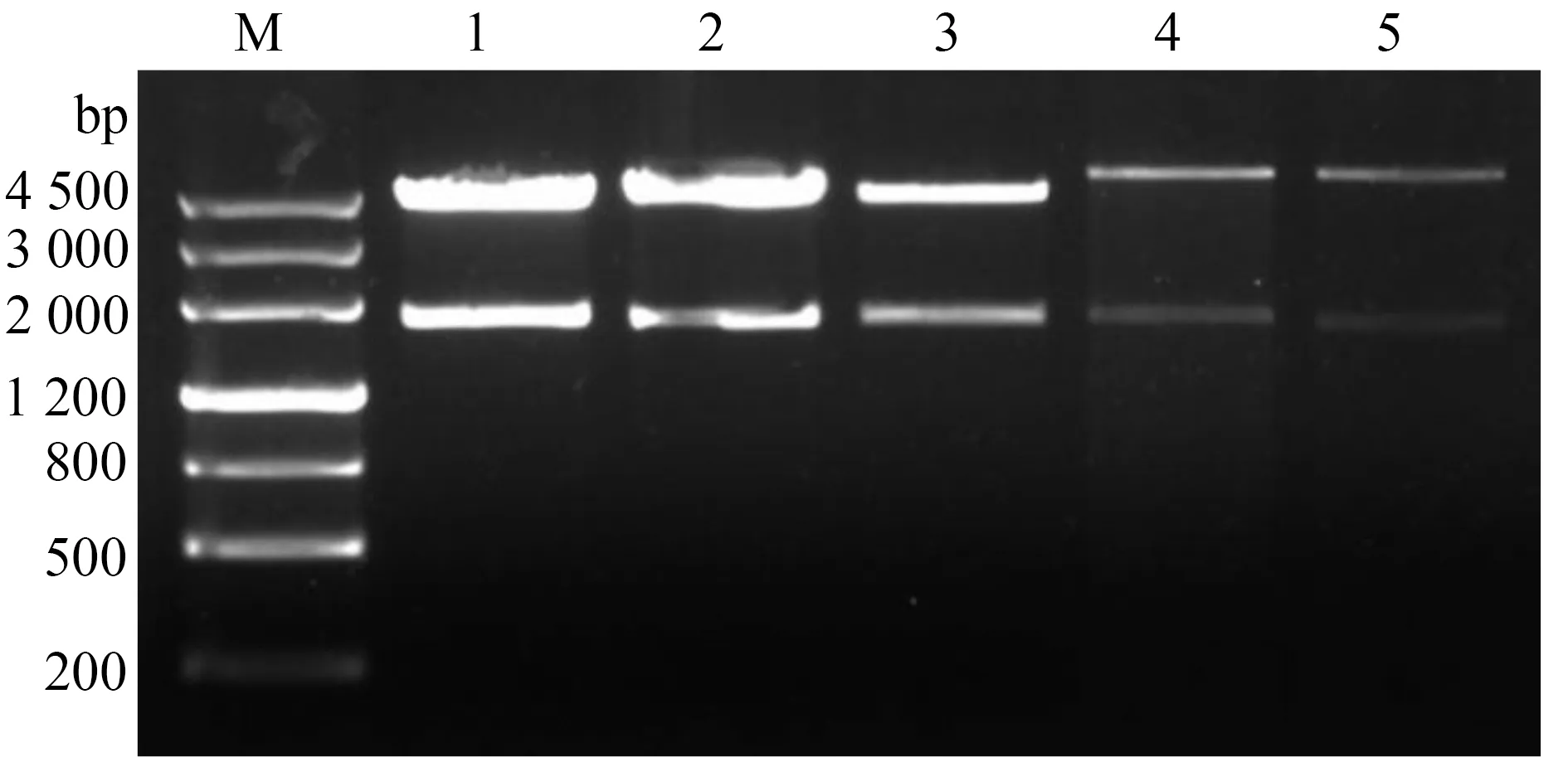
注:M.DNA MarkerⅢ;1, 3.pCold Ⅱ/ace-1842;2.pCold Ⅱ/ace-1782;4.pET-30a/ace-1842;5.pET-30a/ace-1782
2.2 不同形式ace的诱导表达
将含 pET-30a/ace-1782、pET-30a/ace-1842、pCold Ⅱ/ace-1782和pCold Ⅱ/ace-1842阳性质粒的E.coliBL21(DE3)菌株分别划线培养,挑取单菌落扩大培养至对数期,分别IPTG诱导表达,SDS-PAGE检测表达情况,如图2所示,与未诱导的相比,AChE重组蛋白去疏水区以及野生型全长AChE重组蛋白在pCold Ⅱ与pET-30a载体中均得到成功表达,并且条带大小均与预期一致。总体来说,ace基因在 pCold Ⅱ载体中表达量要远高于pET-30a载体,相对表达量约为后者的7倍。
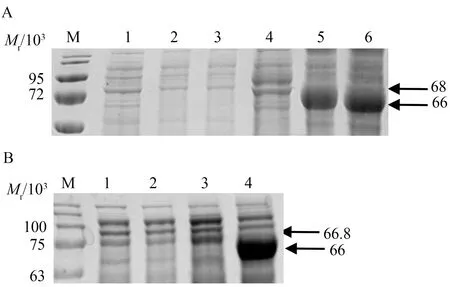
注:A.M.蛋白marker;1.未诱导的AChE-1842(pET-30a);2.未诱导的AChE-1842(pCold Ⅱ);3.未诱导的AChE-1782(pCold Ⅱ);4.诱导后的AChE-1842(pET-30a);5.诱导后的AChE-1842(pCold Ⅱ);6:诱导后的AChE-1782(pCold Ⅱ)。B.M.蛋白marker;1.未诱导的AChE-1782(pET-30a);2.未诱导的AChE-1782 (pCold Ⅱ);3.诱导后的AChE-1782(pET-30a);4.诱导后的AChE-1782 (pCold Ⅱ)
2.3 不同形式AChE重组蛋白的纯化
Ni-NTA纯化浓缩后,用SDS-PAGE分析和Western Blot检测。如图3所示, AChE重组蛋白去疏水区后的条带以及野生型全长AChE重组蛋白的条带大小与预期一致,说明AChE在pCold Ⅱ与pET-30a中表达成功,获得的AChE蛋白符合后续试验要求。
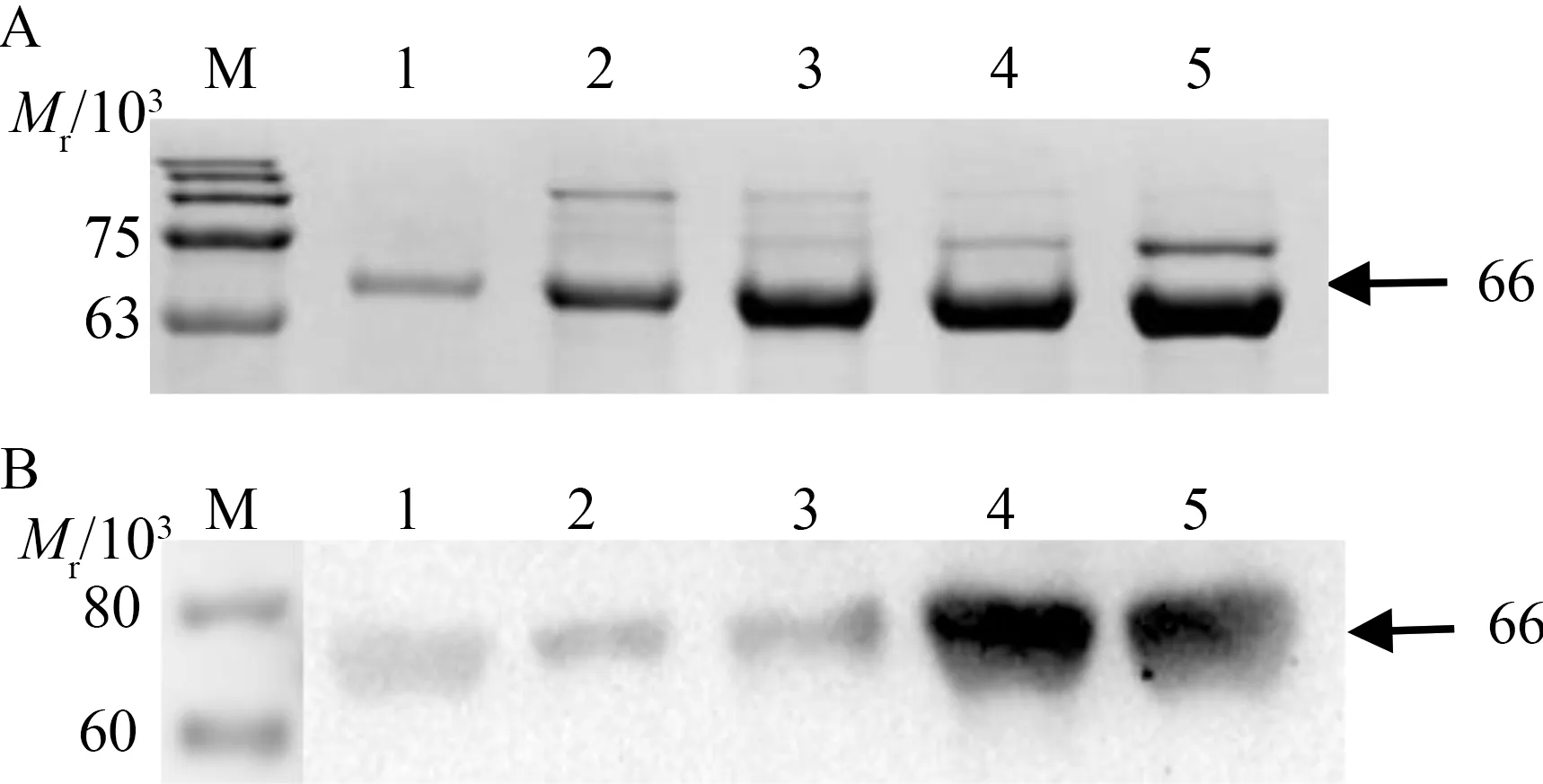
注:A.SDS-PAGE鉴定 M.蛋白marker;1.纯化的AChE-1842(pCold Ⅱ);2.纯化的AChE-1782(pCold Ⅱ); 3-4.纯化的AChE-1842(pET-30a);5.纯化的AChE-1782(pET-30a)。B.Western-blot检测 M.蛋白marker;1.纯化的AChE-1782(pCold Ⅱ);2.纯化的AChE-1842(pCold Ⅱ); 3.纯化的AChE-1842(pET-30a);4-5.纯化的AChE-1782(pET-30a)
2.4 不同形式AChE酶活力比较
采用ATCh-DNTB法测定AChE活性。如图4所示,相同浓度水平下,AChE重组蛋白活性均显著高于朱砂叶螨粗提液(P<0.05)。pCold Ⅱ和pET-30a两种表达载体表达AChE时,pCold Ⅱ载体表达的AChE蛋白活性显著高于pET-30a载体(P<0.05),AChE重组蛋白在去掉疏水区后活性显著提高(P<0.05)。
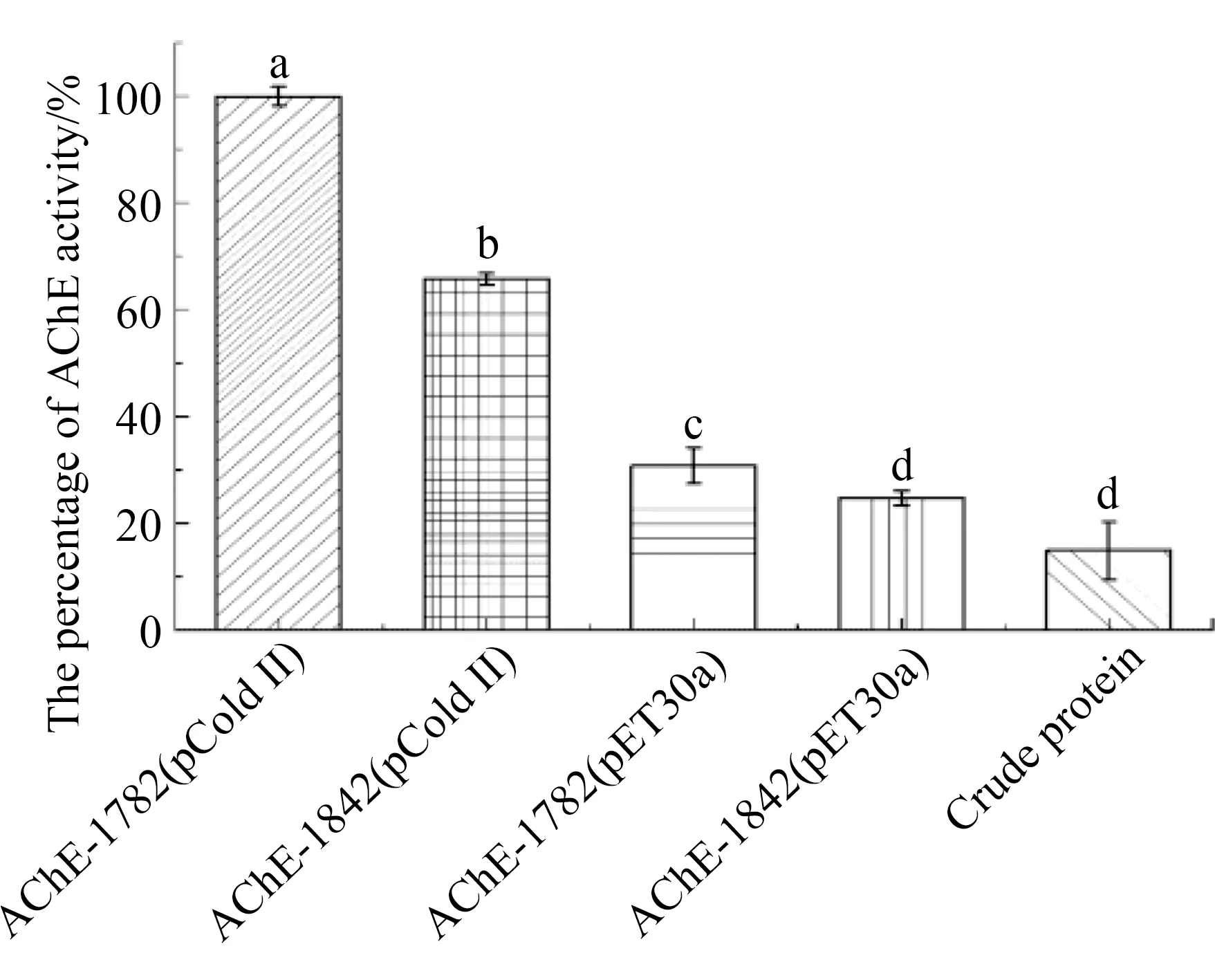
注:数据为3次重复试验的平均值±标准误,柱上标的不同小写字母表示不同差异显著水平(P<0.05)
2.5 各种AChE对毒扁豆碱的敏感性分析
随着毒扁豆碱浓度的增加,AChE活性的逐渐下降,见图5。SPSS计算得出,毒扁豆碱对重组朱砂叶螨AChE(pCold Ⅱ和pET-30a)的IC50分别为1.38 mM和1.79 mM。在pCold Ⅱ中表达的AChE比在pET-30a中表达的AChE对毒扁豆碱更加敏感(P<0.05),进一步说明了在pCold Ⅱ中表达的AChE比在pET-30a中表达的AChE活性要高,为进一步利用基因工程原理制备纯化的螨AChE,为筛选新型农药和农药残留检测提供了依据。
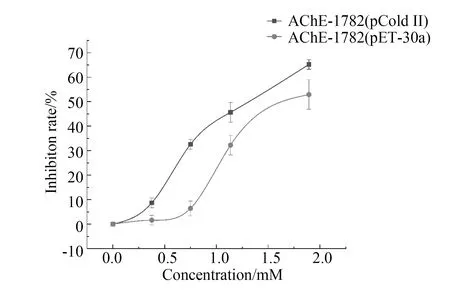
注:图表中数据为3次重复试验的平均值±标准误
3 讨 论
乙酰胆碱酯酶在昆虫神经信号调节中起关键作用,有机磷和氨基甲酸酯类杀虫剂通过阻断AChE去极化而毒杀害虫,随着其对环境以及非靶标有益生物毒性的日益显现,研发以朱砂叶螨乙酰胆碱为靶标的新型选择性杀螨剂具有十分重要的实践意义。目前,乙酰胆碱酯酶抑制剂的筛选通常使用螨粗提液,该方法存在不能排除螨自身其他蛋白对试验的影响等问题。采用体外重组AChE蛋白,有助于解决这些问题,可以大大提高筛选的效率。彭博[18]等采用螨AChE重组蛋白成功筛选到了有活性的杀螨化合物(毒扁豆碱的IC50为5.4 mM),但AChE重组蛋白的活性还有待提高。与其相比本研究获得的AChE对毒扁豆碱灵敏度提高3倍。
目前,已有多种物种的ace基因相继表达成功。Fischer[20]等于1993年在大肠杆菌中表达了人乙酰胆碱酯酶。陈艳霞[21]于2007年克隆了家蝇乙酰胆碱酯酶并在昆虫细胞成功表达。2009年Jiang[22]等采用杆状病毒系统表达了冈比亚蚊AChE1,并得到纯化蛋白。昆明鼠AChE在原核表达载体pET28a中成功表达并进行活性测定[23]。周小霞等[24]将东亚飞蝗的AChE在毕赤酵母中成功表达。彭博等[1]构建原核表达载体pET-30a/ace,获得了有一定活性的螨AChE。大肠杆菌具有世代周期短、繁殖速度快、成本低以及遗传背景清晰的特点,可以高效诱导表达外源蛋白,在基因工程中应用广泛[25]。但是原核表达体系表达真核生物蛋白时,由于缺少转录后加工,容易因蛋白折叠不正确而形成无活性的包涵体。pCold II表达载体具有使用方便和成本低等特点。蛋白的低温诱导表达,有助于蛋白正确折叠,解决上述一些问题。本实验室曾将ace基因在真核表达载体pcDNA3.1/V5-His-TOPO中进行真核表达,但是表达量和纯化量均不理想。鉴于真核细胞表达载体表达AChE蛋白表达量较低,以及pET系列原核表达载体表达AChE蛋白活性不是很理想等问题。此研究对不同形式的AChE基因在两种原核表达载体分别表达,通过比较表达量与活性水平的差异,筛选更为高效的AChE重组蛋白表达和纯化体系,为抗AChE杀虫剂的筛选奠定基础。
结果表明AChE去掉疏水序列可以显著提高酶的活性高于全长序列,可见去掉疏水区的AChE蛋白增加了其水溶性,进而增加了重组AChE蛋白的活性。和pET-30a载体表达的AChE相比,使用pCold II载体表达的AChE蛋白酶活性显著增加,对毒扁豆碱的敏感性也大大提高。可见pCold II的低温冷表达系统有助于提高蛋白可溶性,进而表现出更高的活性,是表达重组酶蛋白的较好选择。AChE去掉疏水区后在pCold II表达载体中表达,获得的重组蛋白可用于更高效、便捷地筛选朱砂叶螨乙酰胆碱酯酶抑制化合物的研究,为研制新型选择性杀螨剂提供坚实前期理论和试验技术支持。
