超高压液相色谱-高分辨质谱法检测单丛乌龙茶中氨基酸
2020-11-20王忠合李晓婷胡文梅王军
王忠合,李晓婷,胡文梅,王军
(韩山师范学院 食品工程与生物科技学院,广东 潮州,521041)
单丛乌龙茶是从国家级优良品种凤凰水仙选育出的优异单株(株系),属于极其宝贵的品种资源,种植历史悠久,主产于广东省潮州市凤凰山,是全国名茶之一,其成品茶品质优异,香味独具一格[1-2]。成茶中的氨基酸与茶叶种类、加工程度等有密切关系,是影响茶营养保健功能及风味品质的关键化学成分之一,茶叶中含有多达26种氨基酸,含量约为2%~5%,其中茶氨酸占氨基酸总量的50%左右,约占茶叶干重的1%~3%。茶氨酸作为茶叶特有的化学成分,不仅构成茶汤鲜爽味,还能降低茶的苦涩味,在提神、镇静、降血压、抗癌和减肥等方面都具有较好的功效作用[3-5]。游离氨基酸的含量和组成对茶汤的滋味、色泽有较明显的影响,对茶汤的香气和鲜爽度起着决定性作用[6]。由于茶原料、加工、制作方法的不同,茶氨酸及其他游离氨基酸在各类茶叶中的含量存在非常大的差异,轻度发酵的白茶和未发酵的绿茶中游离氨基酸的含量较高,白茶比深度发酵的黑茶中的含量高约90倍[7-8],这与不同种类的茶特有的口感和风味密切相关。因而准确测定茶叶中各游离氨基酸的含量,对于评定其营养价值和风味特性具有重要意义。
高效液相色谱法用于测定食品中氨基酸的含量已进行了大量的研究,由于大多数氨基酸无紫外吸收及荧光发射特性,需要用质谱直接检测,也可采用衍生化后用紫外吸收或荧光检测器检测,常用的衍生剂有:6-氨基喹啉-N-羟基琥珀酰亚胺碳酸盐(6-aminoquinolyl-N-hydroxysuccinimidyl carbamate,AQC)[7]、邻苯二甲醛(o-phthalaldehyde,OPA)[9]、异硫氰酸苯酯(phenyl isothiocyanate,PITC)[10]、2,4-二硝基氟苯[11]、丹磺酰氯(dansyl chloride,dabsyl-Cl)[5]和9-芴甲氧羰酰氯(9-fluorenylmethyl chloroformate,FMOC-Cl)[12]等,其中OPA衍生化方法简单、反应迅速、易实现自动化,但衍生物稳定性低,且不能与仲氨酸反应;FMOC-Cl和PITC可与一级和二级氨基酸反应,但其副产物较多进而干扰测定,且PITC衍生体系中的三乙胺试剂在质谱中的响应特别灵敏,会抑制其他物质的离子化,残留性高、很难清洗干净,在质谱的后续使用会出现三乙胺峰的干扰;dabsyl-Cl具有衍生迅速、样品制备简单、灵敏度高;AQC属于专用衍生剂,具有衍生反应步骤简单、所需时间短、副反应少、产物稳定等优点,且采用串联质谱法替代紫外吸收或荧光检测器分析衍生产物,不仅能够利用质核比的差异区分共洗脱物,而且还能增加其检测灵敏度[7]。而随着高分辨质谱技术的发展,可以有效排除复杂食品基质中杂质引起的背景干扰,提高了检测的准确性和精确度,并且与二级质谱图库比对,可以实现对化合物的验证,从而实现快速筛查和定量测定食品中氨基酸的含量[13-14],加之高分辨质谱技术在快速筛查过程中不需要标准品,因此,高分辨质谱技术在食品分析检测领域中的应用必将进入一个飞速发展的阶段。本实验选取5种凤凰单丛乌龙茶为研究对象,利用超高压液相色谱-四级杆飞行时间质谱法(ultra-high pressure liquid chromatography-quadrupole time-of-flight mass spectrometry,UHPLC-QTOF MS)测定游离氨基酸的含量,为单丛乌龙茶中游离氨基酸的准确鉴别和定量测定提供参考。
1 材料与方法
1.1 材料与试剂
单丛乌龙成茶,于2018年4月采购于广东省潮州市凤凰山茶园;谷氨酸(Glu)、异亮氨酸(Ile)、精氨酸(Arg)、天冬氨酸(Asp)、天冬酰胺(Asn)、谷氨酰胺(Gln)、蛋氨酸(Met)、酪氨酸(Tyr)、亮氨酸(Leu)、苯丙氨酸(Phe)、赖氨酸(Lys)、色氨酸(Trp)、丙氨酸(Ala)、甘氨酸(Gly)、苏氨酸(Thr)、脯氨酸(Pro)、组氨酸(His)、丝氨酸(Ser)、半胱氨酸(Cys)、缬氨酸( al)、反式-4-羟基-脯氨酸(Hpro)等,Sigma-Aldrich公司;茶氨酸(The)、茚三酮,生工生物工程(上海)有限公司;质谱级乙腈和甲醇,Fisher公司;KCl、KH2PO4、K2HPO4、浓盐酸、三乙胺、无水乙酸钠、正己烷、冰乙酸、考马斯亮蓝G-250、体积分数95%乙醇等均为分析纯;超纯水(电阻率≥18.0 MΩ·cm),实验室自制。
氨基酸混合标准溶液的配制:分别称取22种氨基酸标准品各1.0 mg,用体积分数0.1%甲酸水溶液溶解,配成100 mg/L的储备液。吸取一定量的氨基酸混合标准储备液,用等体积比的乙腈-水(含0.1%甲酸)溶液稀释配成一系列质量浓度的标准工作液,过0.22 μm滤膜,备用。
1.2 仪器与设备
Agilent 1260 Infinity超高压液相色谱仪,由二元泵、柱温箱、自动进样器、脱气机、紫外检测器组成,安捷伦有限公司;Xe o G2-XS QTOF高分辨质谱仪,配电喷雾离子源(ESI),沃特世有限公司;JY3002电子天平,梅特勒-托利多仪器有限公司;DZF-6050型真空干燥箱,巩义市予华仪器有限责任公司;ZX4漩涡振荡器,意大利 ELP公司;JSP-200型高速多功能粉碎机,浙江省永康市金穗机械制造厂;WFJ 7200可见光分光光度计,尤尼柯(上海)仪器有限公司;GWA-UN1-10超纯水器,北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 茶叶样品处理及氨基酸的提取
分别将茶叶样品置于干燥粉碎机中,粉碎过40目筛,-20 ℃冷藏,备用。称取3.0 g磨碎样品于500 mL蓝盖瓶中,加入沸蒸馏水100 mL,立即移入沸水浴中浸提20 min,浸提后立即趁热减压过滤,将滤液冷却后转入100 mL容量瓶中,用水定容至刻度,摇匀,待用。
1.3.2 比色法测定氨基酸的总量
采用GB/T 8314—2013《茶 游离氨基酸总量的测定》[15]测定提取液中氨基酸的总量,准确吸取1.0 mL样品提取液或标准工作液,注入25 mL比色管中,加入0.5 mL pH 8.0磷酸盐缓冲液和0.5 mL 20 mg/mL茚三酮溶液,在沸水浴中加热15 min。待冷却后加水定容至25 mL。放置10 min后,在570 nm处,以试剂空白溶液作参比,测定吸光度。分别根据标准曲线方程Y=0.0612X-0.0234(R2=0.9967)求得氨基酸的质量浓度,代入公式(1)计算出样品中总氨基酸的含量:
式中:ω,氨基酸的含量,mg/kg;ρ,由标曲求得的质量浓度,mg/L;,样液定容体积,mL;m,取样质量,g。
1.3.3 超高压液相色谱-高分辨质谱法测定各氨基酸含量
取氨基酸标准液或样品上清液分别过0.22 μm滤膜后采用UHPLC-QTOF MS进行检测,根据氨基酸标准曲线,计算出茶叶中各游离氨基酸的含量。色谱条件[16-17]:HILIC-Z色谱柱(2.1 mm×100 mm,2.7 μm);流速 0.4 mL/min;柱温 30.0 ℃;进样量 2 μL;洗针进样,流动相A:20 mmol/L甲酸铵水溶液(含体积分数0.1%甲酸)、流动相B:乙腈(含体积分数0.1%甲酸),梯度洗脱(优化后的程序如表1)。质谱条件:正离子灵敏度模式检测,扫描范围m/z50~600,毛细管电压2.63 k ,锥孔电压40 ,提取锥孔电压6 ,离子源温度130 ℃;脱溶剂气温度400 ℃;锥孔气流速60 L/h,脱溶剂气流速800 L/h,扫描时间0.2 s。全扫描质谱数据(MS)采集方法:第1通道碰撞能量6 e 、第2通道碰撞能量15、25和35 e 。全信息质谱数据(MSE)采集方法:低能通道碰撞能量6 e 、高能通道碰撞能量从10增至35 e 。2种采集模式下的数据类型均为棒状图、采用质量锁定技术校正以获取准确有效的质量数测量值,以200 pg/μL的亮氨酸脑啡肽溶液为锁定质量溶液,流速为10 μL/min,电压为2.0 k ,每隔30 s采集1次,在正离子模式下产生m/z556.277 1的离子。

表1 梯度洗脱程序表Table 1 Gradient elution program employed for the separation of amino acids
1.3.4 精密度实验
精密量取2.0 mL氨基酸标准工作溶液置于10 mL容量瓶中,加体积比为1∶1的乙腈-水溶液(含体积分数0.1%单酸)稀释至刻度,摇匀,制成标准混合溶液,连续进样6次,计算氨基酸的峰面积和相对标准偏差。
1.3.5 加标回收实验
称取单丛乌龙茶叶样品9份,分别提取后置10 mL容量瓶中,精密加入2.0 mL氨基酸的混合标准工作溶液低、中、高3个质量浓度水平(1、10、50倍定量限),加适量体积比为1∶1的乙腈-水溶液(含体积分数0.1%单酸),超声处理15 min,取出,冷却至室温,再稀释至刻度,摇匀,分别作为低、中、高3个质量浓度回收率组,每个质量浓度水平配制3 份,配制的溶液过0.22 μm微孔滤膜,注入超高压液相色谱串联高分辨质谱仪测定。
1.4 数据处理
采用Waters公司的MassLynx 4.1软件,通过提取离子峰获得化合物的色谱图并选用ApexTrack的积分方法,适当调整积分参数的方式完成色谱积分,根据质谱图中碎片离子峰的识别与峰匹配情况确认化合物。实验结果以平均值±标准偏差表示,采用SPSS 17.0进行单因素方差分析,并采用邓肯检验进行差异显著性分析,以P<0.05为检验标准。
2 结果与讨论
2.1 质谱参数的优化
毛细管电压、锥孔电压和碰撞能量是影响质谱测定结果的重要因素,锥孔电压直接影响各组分的灵敏度[11],过高的锥孔电压会导致分子离子在离子源内发生碰撞解离,影响母离子的丰度,进而影响检测限和灵敏度。本文采用的MSE和MS两种质谱采集模式均可采集母离子和碎片离子,但不同采集模式对准分子离子峰和碎片离子峰的丰度及数量的影响较大,将氨基酸标样混合溶液注入质谱仪,优化质谱参数,以获得最优的灵敏度和较多的碎片离子,且丰度值较高,如茶氨酸在不同质谱采集模式下的结果如图1所示。

a-MS采集模式;b-MSE采集模式;c-茶氨酸碎片离子和母离子图1 不同采集模式MS和MSE下的茶氨酸碎片离子和母离子质谱图Fig.1 Mass spectrograms of theanine fragment and parent ions in MS and MSE acquisition modes
MSE采集模式是利用低能通道和高能通道2种扫描快速切换交替构成,分别记录母离子及碎片离子信息,可以进行鉴别和定量分析,但此模式的高能通道中碰撞能量只能设定范围值。MS采集模式也是采用低能通道扫描获得母离子信息,而高能通道的碰撞能量则有多种设置方式,如:固定值、一组值或范围值等。由图1可知,茶氨酸的一级质谱图中主要有加合H+、加合Na+的准分子离子峰和脱去氨的离子峰,且脱氨的离子峰的丰度最高,用于定量分析可提高检测限和灵敏度[17],其他氨基酸的定量离子峰如表2。而在MS(碰撞能15 )和MSE(碰撞能10~35 )2种不同采集模式下获得的茶氨酸高能通道质谱图中各碎片离子的数量和丰度差异较大,MS采集模式中共获得7个准分子离子峰和碎片离子峰,准分子离子峰的丰度较低,大多数的准分子离子在碰撞中变成碎片离子,故在m/z84.044 7处的丰度较高;而MSE采集模式中可获得9个准分子离子峰和碎片离子峰,准分子离子峰的丰度较清晰,碎片离子峰的丰度较低,但在m/z158.082 4处的离子峰丰度最高,该采集模式获得的碎片离子信息多更适合于鉴别茶叶中的各种氨基酸,因而后续研究中质谱采用MSE模式采集。
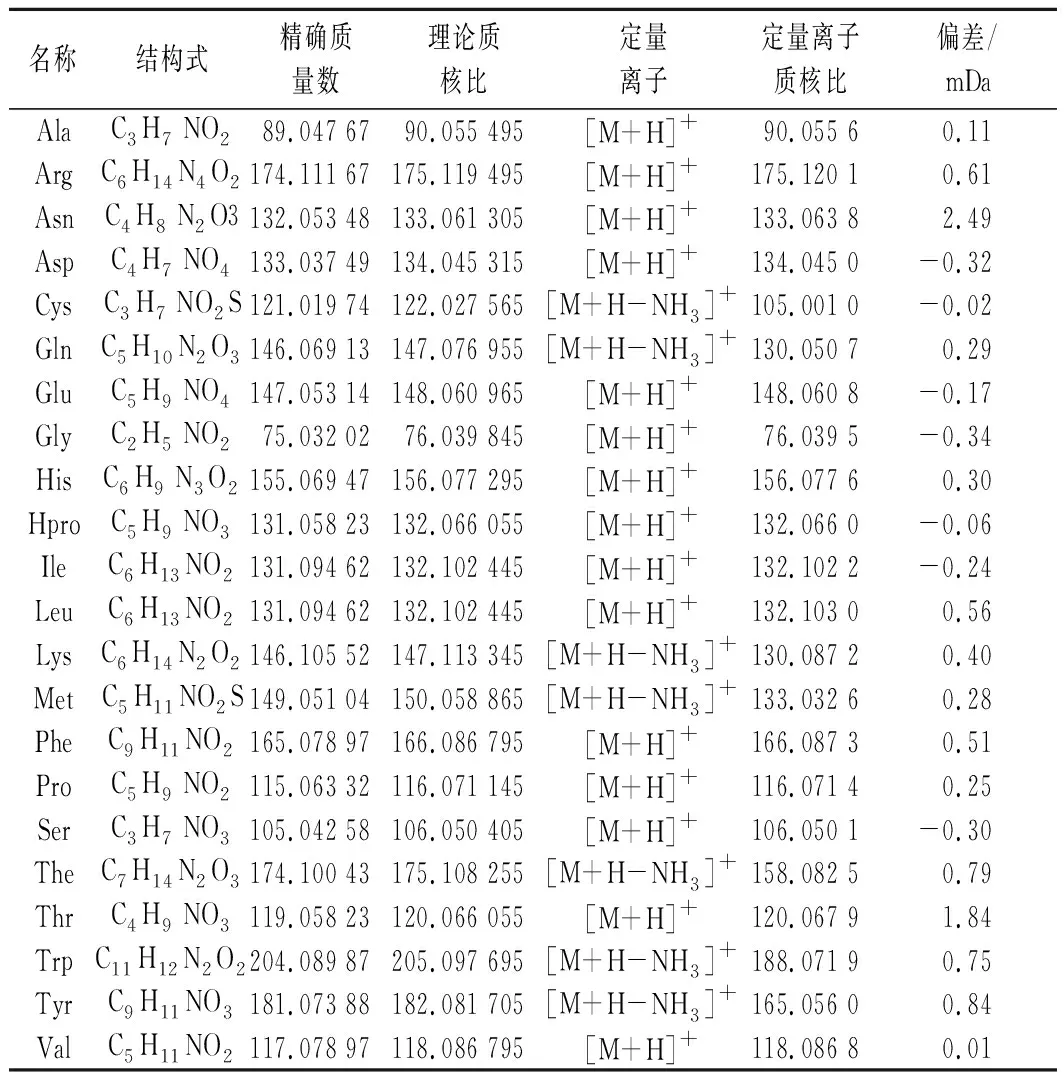
表2 氨基酸标准品的精确质量及相关数据Table 2 Monoisotopic mass and related data of standard amino acids
2.2 色谱参数的优化
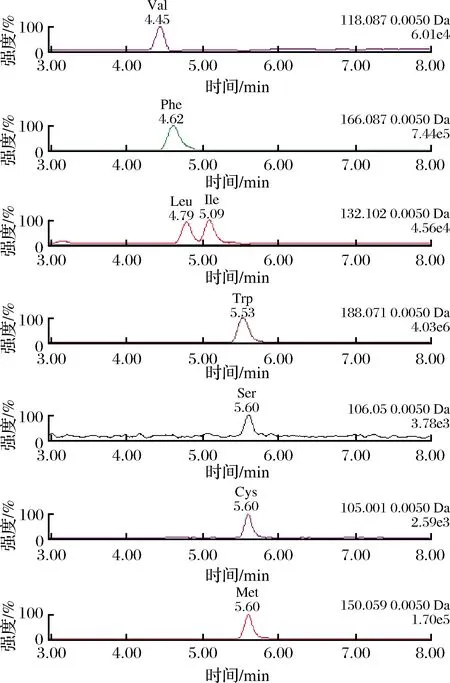
实验初期,分别采用了SB-C18柱(250 mm×4. 6 mm,5.0 μm)、EC-C18柱(100 mm×2. 1 mm,2.7 μm)和HILIC-Z柱(100 mm×2.1 mm,2.7 μm),在二元流动相为甲酸铵-甲酸水溶液-乙腈的梯度洗脱条件下,对22种氨基酸的混合标准溶液进行了分离条件的优化。C18柱的分离效果明显不如HILIC-Z柱,部分氨基酸的出峰时间重合无法分离,如赖氨酸、精氨酸和组氨酸的峰重合,这主要是由于3种氨基酸的水溶性较好,在C18柱上的保留差,分离效果较差。亮氨酸和异亮氨酸在C18柱上也比较难实现分离,由于这2种氨基酸具有相同的质核比,因而无法进行鉴别和定量分析[13]。鉴于此,优化了HILIC-Z柱分离氨基酸的色谱条件,采用同样的二元流动相进行梯度洗脱优化,如图2所示,氨基酸标准化合物的分离效果理想,亮氨酸和异亮氨酸可分开,且分离时间只需15 min,降低了分析所需时间和溶剂的消耗等,能够达到快速、高效分离的要求,且该分离条件不需添加三乙胺和难挥发性的无机盐,只用到挥发性的甲酸和甲酸铵改性剂,非常适合于质谱检测,优化后的梯度洗脱条件如表1所示。
2.3 方法学考察
移取适量的氨基酸混合标准工作溶液,加入到单丛乌龙茶样品粉末中,按照1.3.1小节的方法处理,配制系列质量浓度的氨基酸混合标准溶液测定,各氨基酸的检测结果如表3所示。依据各氨基酸的定量离子峰(如表2)提取的色谱图中信噪比(S/N)大于3和10得到检测限与定量限,22种目标物的线性相关系数为0.99~0.9996,样品中各测定出的氨基酸化合物均在线性范围内,检测限为1.3~95.7 μg/L。

表3 氨基酸标准品的保留时间、标准曲线方程、检测限及定量限Table 3 Retention time, standard cur e equation, limits of detection (LOD) and limits of quantitation (LOQ) of standard amino acids

续表3
移取适量的氨基酸混合标准工作溶液,加入到单丛乌龙茶样品粉末中,配制低、中、高3个质量浓度水平(1、10、50倍定量限)的添加试验,各平行5份,按照1.3.1小节的方法处理,回收率和精密度实验测定结果如表4所示。由表4可知,各氨基酸目标物的加标回收率为83%~112%,相对标准偏差小于5%,可用于单丛茶样品中氨基酸含量的测定。
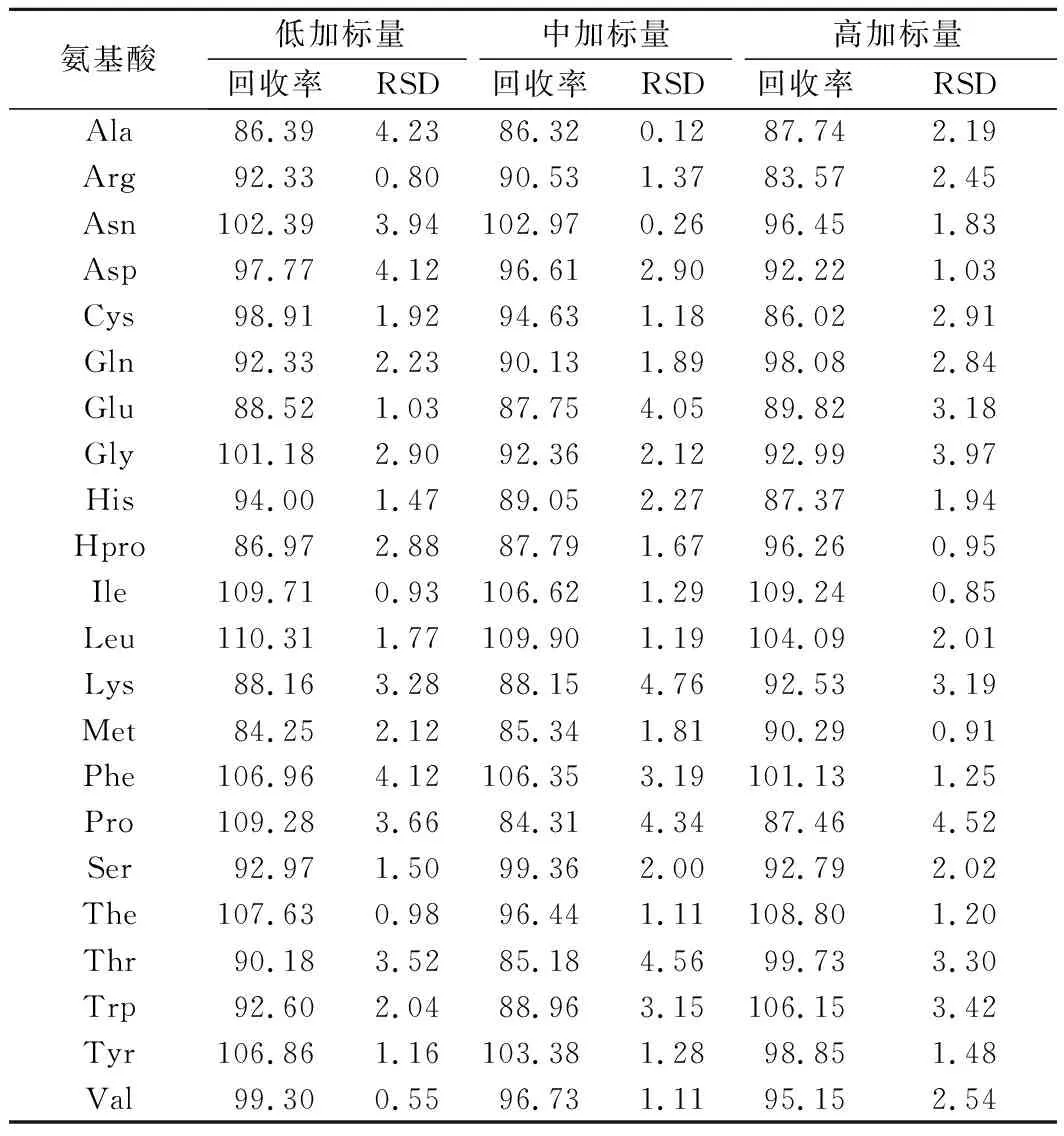
表4 单丛乌龙茶样品中氨基酸测定的添加回收率及其相对标准偏差(RSD) 单位:%
2.4 茶叶样品中氨基酸鉴别与含量测定
图3为单丛茶样品测定的总离子流图和不同质量窗口提取的茶氨酸和精氨酸的准分子离子色谱图。提高质量数测定的准确度,有利于提高筛查鉴别的可靠性,减少假阳性结果出现的可能性。串联质谱可区分质核比的精度只有0.01 Da,借助碎片离子可定量测定和区分化合物,但对于共流出的质核比相近的碎片则无能为力。而高分辨质谱则可精确到0.1 mDa,再根据碎片离子质谱信息和同位素丰度比值等信息可对化合物进行准确筛查和确证。如图3-b所示,在提取质量窗口为0.05 Da下提取茶氨酸(m/z175.108)和精氨酸(m/z175.120)的色谱图中均在6.83 min会出现同1个色谱峰,而当提取质量窗口为0.005 Da下提取精氨酸(m/z175.120)的色谱图中不会出现干扰峰,可准确提取到精氨酸的色谱峰。茶氨酸和精氨酸的平均相对分子质量为174.197 7和174.201,2种化合物失去1个氨基(m/z17)和1个羧基(m/z45)得到的碎片离子峰也相同[18],因而串联质谱的质量精度无法区分这两种氨基酸,已报道的茶氨酸测定方法中未考虑精氨酸的影响,m/z158的峰推测错误[19]。由表2可知,茶氨酸和精氨酸的单同位素精确质量数为174.111 67和174.100 43,两者相差约11 mDa,只有用高分辨质谱才能准确区分。由此可见,采用高质量的色谱图可减少假阳性的筛查结果,获得清晰信噪比高的色谱图,有利于提高检出限。

a-总离子流图;b-色谱图图3 单丛乌龙茶样品测定的总离子流图及不同质量窗口下的茶氨酸及精氨酸提取色谱图Fig.3 Total ion chromatogram of Oolong tea extract and extracted ion chromatogram of arginine and theanine in different mass chromatogram window
高分辨质谱法可以提供化合物的保留时间,质谱碎片离子、精确质量数、同位素丰度比值等信息,这些信息可为化合物的准确定性和筛查鉴别提供充分的依据。在实验中根据氨基酸标准化合物的碎片离子信息确定其在茶叶样品中的存在情况,并根据提取色谱图的峰面积进行定量,结果如表5所示。

表5 单丛乌龙成茶中氨基酸种类与含量 单位:mg/100 g
由表5可知,采用UHPLC-QTOF法测定的5种单丛乌龙成茶中游离氨基酸的种类相同,主要有茶氨酸、谷氨酸、精氨酸、丝氨酸、天冬氨酸等,但各氨基酸在不同单丛乌龙成茶中的含量差异较大(P<0.05),不同茶叶中各游离氨基酸的加和值相差较大,这可能与茶树品种、生长环境、加工条件等因素密切相关,如玉兰香茶叶中茶氨酸和天冬氨酸的含量较高,而谷氨酸的含量较低。采用茚三酮比色法测定的5种单丛乌龙成茶中氨基酸总量差异显著(P<0.05),且与各游离氨基酸的加和值差异较大,这可能是由于茶叶提取液中含有其他氨基化合物,因而茚三酮比色法测定的氨基酸总量值偏大,这进一步表明不同成茶中游离氨基酸种类和含量有较大差异,与其种类和加工过程密切相关。晾青过程中在酶的作用下蛋白质水解的游离氨基酸含量增加,这与加工过程中内源性蛋白酶被激活,蛋白质在各种蛋白酶的催化作用下水解成多种游离氨基酸,使游离氨基酸的总量增加[7],从分子和蛋白水平看,茶叶晾青过程中茶氨酸的生物代谢与CsFd-GOGAT和CsNADH-GOGAT基因的表达密切相关[20]。发酵过程中游离氨基酸可发生氧化脱氨或脱羧反应形成芳香物质,也可通过羰氨反应产生香气成分,从而使得游离氨基酸的含量降低,其中茶氨酸作为一种茶树特征性非蛋白主体氨基酸可与儿茶素结合形成黄酮碱类物质,这与乌龙茶独特香味形成有密切联系,因而在不同的成茶中其含量差异较大。
3 结论
HILIC柱分离单丛乌龙成茶中氨基酸的效果理想,亮氨酸和异亮氨酸在15 min内即可分开,该分离条件不需添加三乙胺和难挥发的盐,非常适合用于质谱检测。质谱采集模式对准分子离子峰和碎片离子峰的丰度及数量的影响较大,在电喷雾正离子化(ESI+)检测,22种氨基酸目标物的线性相关系数为0.99~0.9996,检出限为1.3~66.8 μg/L,加标回收率为83%~112%,相对标准偏差均小于5%,可用于单丛乌龙茶样品中氨基酸含量的测定。
茚三酮比色法测定5种单丛茶样品中总游离氨基酸的总量为485.12~575.95 mg/100 g,差异显著(P<0.05)。超高压液相色谱-高分辨质谱法测定结果表明,5种单丛乌龙成茶样品中游离氨基酸的种类相同,主要有茶氨酸、谷氨酸、精氨酸、丝氨酸、天冬氨酸等,但各氨基酸在不同单丛乌龙成茶中的含量差异较大(P<0.05),这与不同品种的单丛乌龙茶独特的香味形成及口感有密切联系。
