黄芪多糖对食管癌组织中炎症因子表达的影响及与p-AKT-AKT-VEGF信号通路的关系*
2020-11-19孙小虎王璐刘春娜张文陆
孙小虎, 王璐, 刘春娜, 张文陆△
1锦州医科大学附属第一医院肿瘤科(辽宁锦州 121001); 2辽宁省肿瘤医院病理科(辽宁沈阳 110042)
近年来,消化系统肿瘤越来越常见,其中食管癌(EPC)作为常见的消化道肿瘤之一,呈现上升趋势并且患病人群趋于年轻化[1]。EPC的早期诊断、早期治疗对EPC患者的预后至关重要。目前,手术切除疗法、放射治疗和化学药物治疗方法是EPC的主要治疗手段,但仍有部分患者出现手术后的复发或并发症,而且很多化疗药物治疗过程中,有多种不良反应,甚至患者不能耐受其严重的不良反应,而放弃治疗[2]。由于以上治疗EPC中的诸多不足之处,因此,寻找安全有效的EPC的治疗手段,已经成为急需解决的主要问题。为补充EPC治疗中的不足,综合治疗手段已是治疗EPC常用而有效的治疗方法。新近的研究发现,传统中药黄芪(Astragalus,AGs)的有效成分黄芪多糖(APS)在EPC的综合治疗中发挥重要的作用,特别是减少术后并发症作用尤为显著。研究表明,一些炎症因子及炎症细胞因子,如血管内皮生长因子(VEGF)、髓系细胞触发受体(TREM-1)和表皮生长因子受体(EGFR)可能激活下游信号通路,触发后续的病理生理学效应,参与多种肿瘤发生和发展,如EPC、结肠癌等,并可能影响肿瘤的转移及预后[3-4]。但APS对EPC治疗作用,特别是对炎症因子是如何影响,以及在治疗EPC中的可能信号机制,目前仍少见报道。为了更好地研究EPC的早期诊断及综合治疗,本研究采用ELISA方法测定多种炎症因子的含量变化,另采用Western blot方法定量检测TREM-1及EGFR在EPC及癌旁组织中的表达,并检测AKT、p-AKT,以探讨APS糖对EPC保护作用新的信号通路机制。为EPC的早期诊断提供依据,如检测TREM-1和EGFR,可为EPC的早期检出率提供实验室指标,为EPC的治疗提供新的有效辅助治疗方法。
1 资料与方法
1.1 一般资料 选取2017年1月至2018年12月来院就诊的EPC患者20例为单纯手术治疗组(EPC组);另选取EPC患者20例,手术前7 d,征得患者同意给予APS治疗,为药物治疗组(APS组)。同时选取其相应癌旁组织(EPC边缘外≥5 cm)共20例作为空白对照组(TAEC组)。上述入组的EPC患者,均签署知情同意书。上述所有的受试病例均无重复,且各受试临床病理资料均完整。各组患者的一般资料差异无统计学意义(P>0.05),有可比性。见表1。

表1 各组EPC患者临床资料比较 例
1.2 试验药品 黄芪多糖注射液(250 mg/支,天津赛诺制药有限公司生产);白细胞介素(IL)-12、IL-6及VEGF测定试剂盒(碧云天生物公司),TREM-1抗人单克隆抗体(ab214202,英国Abcam公司);兔抗人AKT、p-AKT单克隆抗体(Cell Signal Technology 公司)。
1.3 给药及标本处理 APS治疗组患者术前征得患者同意后,每天给予APS(1 mg/ kg)药物治疗,给药时程为7 d。7 d后进行手术切除治疗。EPC组未给以APS辅助治疗,采用单纯手术治疗。手术后收集上述各受试组中EPC组织进行病理观察,离体30 min内进行处理。具体操作方法:在上述患者手术肿瘤食管部位,切取面积约1.0 cm×1.0 cm的食管组织作为受试组织。取出的食管组织即用生理盐水(NS)进行漂洗,备用。
1.4 试验方法
1.4.1 观察术后一般状态 APS治疗给药期间及手术切除后,记录各组受试EPC患者行为活动,精神状态等,并观察术后是否出现并发症(如术后胃肠道反应、出血等)。
1.4.2 炎症及细胞因子的测定 各组EPC患者手术结束后,按照上述食管标本取材要求,选取肿瘤及肿瘤旁组织,取各组受试食管组织的匀浆,采用ELISA 法测定炎症因子的含量变化,包括测定IL-12、IL-6及VEGF的含量,以及TREM-1及EGFR的含量变化。
1.4.3 SP免疫组化炎症因子的测定 另取一部分EPC组织经过脱蜡、梯度酒精脱水、抗原修复后滴加一抗和二抗,经DAB显色和苏木素复染后,在400倍光镜下,随机选取10个视野,根据细胞染色部位,进行染色密度和染色强度结果评分。判定Trem-1和EGFR结果评分标准为,>2分者为染色阳性,≤2分者为染色阴性。具体的评分标准如下:染色面积评估:0分:无阳性染色细胞;1分:≤25%;2分:26%~50%;3分:51%~100%。染色强度评分:0分:阳性细胞无着色;1分:阳性细胞淡黄色;2 分:呈现染色特性为棕黄色;3分:棕褐色。细胞膜(CM)评分:0分<10% CM染色;1分:≥10% CM微弱染色;2分:≥10%侧膜、基底侧膜中度染色;3分:≥10%细胞强染色出现在侧膜、基底膜。上述评分之和用来判断TREM-1和EGFR 染色结果。
1.4.4 采用Western blot方法测定各组受试结肠组织中AKT和p-AKT的蛋白表达 实验中各受试组中分别加入AKT、p-AKT、β-actin。采用 ECL试剂法进行显色,应用Image Quant LAS 4000凝胶成像系统获得扫描图像,根据Image J软件分析条带灰度值,并与内参比较,用以计算AKT、p-AKT的蛋白相对表达量。

2 结果
2.1 各组术后一般状况 EPC组及TAEC组中患者术后有40%的患者出现手术并发症,如消化道症状、伤口出血、伤口愈合延迟等。APS组上述症状明显改善,各患者术后未见切口部位出血、感染和预后延迟,APS组中EPC患者的一般状态有缓解,较EPC组近期并发症明显降低,见表2。

表2 各组手术后2周内并发症发生率的比较 例(%)
2.2 IL-12及IL-6的炎症因子及VEGF含量测定 与TAEC组相比,EPC组受试患者食管组织中,炎症因子IL-6 及IL-12明显升高,炎症细胞因子VEGF也升高(P<0.01),而术前7 d应用APS的食管癌患者,上述炎症因子及炎症细胞因子结果显著下降,与EPC组比较,差异有统计学意义(P<0.01)。见表3。

表3 各组手术后IL-12、IL-6和VEGF的比较
2.3 TREM-1及EGFR的炎症细胞因子含量测定 EPC组的食管组织中,细胞因子TREM-1及EGFR明显升高,EPC组及APS组与TAEC组相比,差异有统计学意义(P<0.05)。另外,术后APS组与EPC组相比,上述炎症性胞因子结果显著下降(P<0.05);APS组与EPC组相比,上述炎症细胞因子也均显著下降,差异有统计学意义(P<0.01)。见表4。
表4 各组手术后TREM-1和EGFR的比较
2.4 TREM-1及EGFR在EPC及癌旁组织中表达 SP免疫组化结果显示,在TAEC组的癌旁组织中TREM-1主要表达于细胞膜,其阳性表达率降低,EPC组和APS组食管癌组织中表达均升高,与TAEC组相比,差异有统计学意义(P<0.05)。在EPC组的EPC组织中,TREM-1及EGFR阳性定位于细胞核及细胞浆内,阳性表达常见,每张切片取十个视野,阳性表达率明显升高。在APS组中,TREM-1阳性染色也可见,阳性表达率也升高,两者比较差异有统计学意义(P<0.05)。与TAEC组的癌旁组织中相比,EPC组和APS组EPC组织中的EGFR的表达也明显升高,差异有统计学意义(P<0.01)。在EPC组的EPC组织中,EGFR阳性率高于APS给药组,两者比较差异有统计学意义(P<0.05)。见图1~2、表5。

注:A:EPC组;B:APS组;C:TAEC组

注:A:EPC组;B:APS组;C:TAEC组
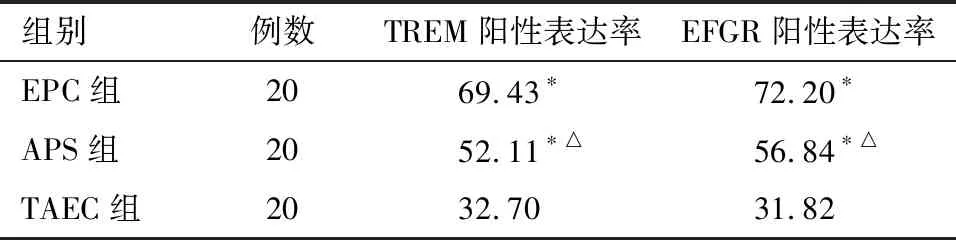
表5 各组手术后炎症因子的阳性表达率比较 %
2.5 食管肿瘤组织中AKT和p-AKT的蛋白表达 与TAEC组相比,APS组和EPC组食管肿瘤组织中的PKB蛋白表达量明显升高,而p-AKT含量下降,差异有统计学意义(P<0.05)。与EPC组相比,APS组及TAEC组AKT蛋白表达量下降,差异有统计学意义(P<0.05)。见表6及图3。

表6 各组手术后食管组织中AKT、p-AKT的影响(OD值)

图3 各组中AKT及p-AKT蛋白表达的影响
3 讨论
EPC是较为常见的消化道肿瘤,其发病率逐年升高且趋于年轻化。目前,EPC仍以手术治疗作为最有效的治疗手段,但单纯的手术治疗并非最有效手段,其术后仍有可能出现诸多并发症甚至导致EPC复发。因此,手术结合药物治疗的综合疗法突显出重要性,其中传统中药的辅助治疗同时结合手术治疗,已成为治疗EPC的新的最佳手段[1-2]。
新近的研究报道表明,传统中药黄芪的有效成分APS在EPC的综合治疗中发挥重要的辅助治疗作用,特别是在减少EPC术后并发症作用尤为显著。APS具有良好的抗氧化、抗缺血、抗肿瘤及提高机能免疫能力等多重药理作用。APS是研究较早的多糖类,新近的研究发现可用于减轻肿瘤手术后、放疗以及化疗期间引起的不良反应,可以作为肿瘤治疗的辅助用药,特别是用于消化道肿瘤,如EPC的辅助治疗[5-6]。
IL-12 及IL-6是存在于多种组织和细胞内的较为常见的炎症因子,两者参与并诱发了多种炎症反应,并可能触发了随后的免疫炎症反应。另外VEGF也证实诱导多种疾病(包括肿瘤)的发生与发展,如EPC、结肠癌等[7-8]。在本研究中,应用APS的EPC术后患者,一般状态良好,术后并发症减轻。提示APS对EPC术后有一定辅助治疗作用。IL-12 及IL-6是炎症细胞在应激反应的免疫应答中产生的生物活性的炎症因子,药物能降低IL-12 及IL-6则能抑制炎症反应。本研究结果表明,APS能明显降低炎症因子IL-12、IL-6及VEGF的含量,提示APS能通过降低IL-12、IL-6及VEGF的含量,降低EPC术后的炎症反应,并进一步说明了APS是通过减少局部炎症因子减轻手术切口局部的炎症反应,促进伤口愈合,降低并发症。
TREM-1是2000年才发现并证实的一种新型炎症效应及细胞调控因子[9-10]。TREM-1选择性表达于中性粒细胞(neutrophils)和CD14炎症单核细胞,参与急性炎症反应,在正常的消化道组织中存在弱的阳性表达。表皮生长因子受体,EGFR是一种跨膜酪氨酸激酶受体(transmembrane tyrosine kinase receptor),是原癌基因c-erbB1的表达产物之一,研究已经证实其参与了多种肿瘤细胞的增殖及生长过程[11-12]。在本研究中,率先证明了APS能明显降低炎症细胞因子TREM-1和EGFR含量及阳性表达,该结果提示APS在EPC的辅助治疗中可能通过降低TREM-1和EGFR含量,发挥其对EPC的治疗及预防作用。新近的研究表明,多种炎症反应可能上调TREM-1在炎症细胞表面促进可溶性亚型——sTREM-1的胞外分泌及表达[9,13]。本研究中APS不仅能降低炎症细胞因子TREM-1和EGFR的含量,而且能降低TREM-1和EGFR在食管组织中的阳性表达,该实验结果提示了APS对EPC的治疗及预防作用是通过降低炎症细胞因子实现的,也提示APS可能作为一种酪氨酸激酶抑制剂发挥其对EPC及相关消化道肿瘤的辅助治疗作用。本研究率先阐明了TREM-1和EGFR的表达及含量测定可以用于EPC的早期诊断,将提高EPC的早期检出率,并能提高患者的治愈率,降低患者的复发率。
pAKT-AKT信号通路在多种肿瘤的发生发展中出现异常活化, AKT信号通路对于肿瘤细胞增殖、生长及凋亡中至关重要,该信号通路对蛋白质和葡萄糖代谢也发挥重要作用[14]。在本研究Western blot的结果中发现,APS能减低食管肿瘤组织中的AKT蛋白表达水平,升高p-AKT水平。AKT是一种丝氨酸-苏氨酸激酶,多项研究已证实了AKT参与多种生理以及病理活动[15],本研究的这部分结果提示,APS可能是通过下调p-AKT-AKT信号途径,进而下调多种炎症介质及炎症细胞因子的表达,在EPC,乃至多种消化道疾病中发挥治疗及预防的作用。
综上所述,APS对EPC的防治作用可能是影响p-PKA-PKA信号途径,调节下游的多种炎症因子(如TREM-1、EGFR、IL-12、IL-6及VEGF),TREM-1和EGFR的表达及含量测定可以用于EPC的早期诊断,APS将成为治疗与预防EPC的新的药物作用靶点,因此对APS机制的深入研究,将有可能为以后肿瘤的研究、治疗提供新的思路和方法。
