血管生成素样蛋白6、瘦素与糖尿病肾病的关系
2020-11-19常海瑶刘晶吴文昊牛乐乐李兴
常海瑶 刘晶 吴文昊 牛乐乐 李兴
1山西医科大学,太原 030001; 2山西医科大学第二医院内分泌科,太原 030009
糖尿病肾病(DN)是糖尿病微血管并发症之一,是终末期肾脏疾病的最主要病因[1]。糖代谢紊乱、高血压、高血脂、年龄等均是DN的危险因素[2]。DN发生的分子机制可能为高糖诱导肾小球系膜细胞外基质产生、增加Ⅳ型胶原纤维和纤维连接蛋白的表达,导致肾小球硬化和间质损伤,但具体机制仍不清楚[3]。血管生成素样蛋白6(ANGPTL6)主要在肝脏、脂肪组织中表达,可抑制肝细胞中的糖异生,此外,ANGPTL6可诱导内皮细胞损伤,导致微血管缺血、缺氧的发生[4-5]。瘦素是由脂肪细胞分泌的调节机体能量平衡的多肽类激素,在促进肾脏病理生理变化中有直接作用[6-7]。有研究显示,瘦素可调节血清ANGPTL6的表达[8]。因此,ANGPTL6与瘦素可能起协同作用,并与DN相关。
1 对象与方法
1.1 研究对象与分组 选取2018年12月—2019年12月在山西医科大学第二医院内分泌科住院治疗的2型糖尿病患者97例,根据尿白蛋白排泄率(UAER)分为两组:单纯2型糖尿病组50例(UAER<30 mg/24 h),男34例,女16例,平均年龄为(54.46±13.02)岁,平均病程为(3.37±5.89)年;DN组47例(UAER≥30 mg/24 h),男27例,女20例,平均年龄为(60.47±13.87)岁,平均病程为(9.56±22.49)年;同时选取该院同期58名体检正常者作为对照组,其中男32名,女26名,平均年龄为(46.26±12.87)岁。2型糖尿病根据1999年世界卫生组织(WHO)的诊断标准。DN组:收集的患者数据中并无活动性尿沉渣异常,无短期内估算的肾小球滤过率(eGFR)迅速下降、短期内UAER迅速升高或肾病综合征,故未行肾脏穿刺,故根据UAER升高而做出临床诊断。糖尿病组治疗情况:住院期间平均空腹血糖水平(6.78~10.54 mmol/L),合并高血压者服用降压药(氯沙坦钾片)后监测血压波动于129/76~154/94 mmHg(1 mmHg=0.133 kPa),合并高脂血症者给予降脂药(阿托伐他汀钙片),期间未复查血脂,未随访;DN组治疗情况:住院期间平均空腹血糖水平8.56~15.46 mmol/L,合并高血压者服用降压药(氯沙坦钾片联合苯磺酸左旋氨氯地平片)后监测血压波动于148/98~167/108 mmHg,合并高脂血症者给予降脂药(阿托伐他汀钙片),期间未复查血脂,未随访。排除标准:(1)糖尿病急性并发症。(2)1型糖尿病及其他类型糖尿病患者。(3)尿路感染及其他严重感染者。(4)痛风。(5)合并其他系统疾病等。(6)除外影响尿蛋白的各种生理病理疾病。(7)合并原发性、继发性肾脏疾病及药物导致的UAER升高。本研究获得山西医科大学第二医院伦理委员会的批准,所有受试者均签署知情同意书。
1.2 研究方法
1.2.1 标本留取及生化指标测定 所有研究对象空腹8 h,次日晨7:00抽取静脉血,离心、分离血清后80℃冰箱储存,用于测定血清ANGPTL6、瘦素水平;同时抽取静脉血用于测定空腹血糖、HbA1c、空腹胰岛素(FINS)、总胆固醇、甘油三酯、低密度脂蛋白-胆固醇(LDL-C)、高密度脂蛋白-胆固醇(HDL-C)等指标;留取尿标本,测定尿微量白蛋白及尿肌酐值;稳态模型评估-胰岛素抵抗指数(HOMA-IR)=空腹血糖×FINS/22.5;同时进行身高、体重的测量,并计算体重指数=体重/身高2(m2)。
1.2.2 ANGPTL6、瘦素水平的测定 采用酶联免疫吸附(ELISA)法测定血清ANGPTL6、瘦素水平。过程如下:实验前标准品、试剂及样本准备;加样(标准品或样本)100 μl,37℃孵育60 min,不洗;甩干,加检测溶液A 100 μl,37℃孵育60 min;重复洗板3次;加检测溶液B 100 μl,37℃孵育30 min;洗板5次;加TMB底物90 μl,37℃反应10~20 min;加终止液50 μl,用酶标仪在450 nm测定OD值,做出标准曲线,将OD值带入方程,求出样品浓度(ANGPTL6的检测范围:3.12~200 μg/L,瘦素检测范围:0.156~10 μg/L),试剂盒购自武汉云克隆科技股份有限公司。

表1 3组间一般资料及生化指标的比较

2 结果
2.1 各组间一般资料及生化指标的比较 各组间性别、体重指数、舒张压、LDL-C、HDL-C、总胆固醇、甘油三酯比较,差异均无统计学意义(P均>0.05)。单纯2型糖尿病组年龄、空腹血糖、FINS、HOMA-IR、HbA1c均高于对照组,差异均有统计学意义(P均<0.05)。DN组收缩压、ANGPTL6、瘦素均高于对照组(P均<0.05)。DN组年龄、空腹血糖、FINS、HOMA-IR、HbA1c均高于单纯2型糖尿病组(P均<0.05),见表1。
2.2 ANGPTL6、瘦素水平与各指标的相关性分析 分别以ANGPTL6、瘦素为因变量,与其他临床指标进行Pearson相关性分析。AFNGPTL6与年龄、收缩压、HOMA-IR、HbA1c、UAER、瘦素呈正相关(P均<0.05)。瘦素与年龄、体重指数、收缩压、HOMA-IR、HbA1c、UAER、ANGPTL6呈正相关(P均<0.05),见表2。
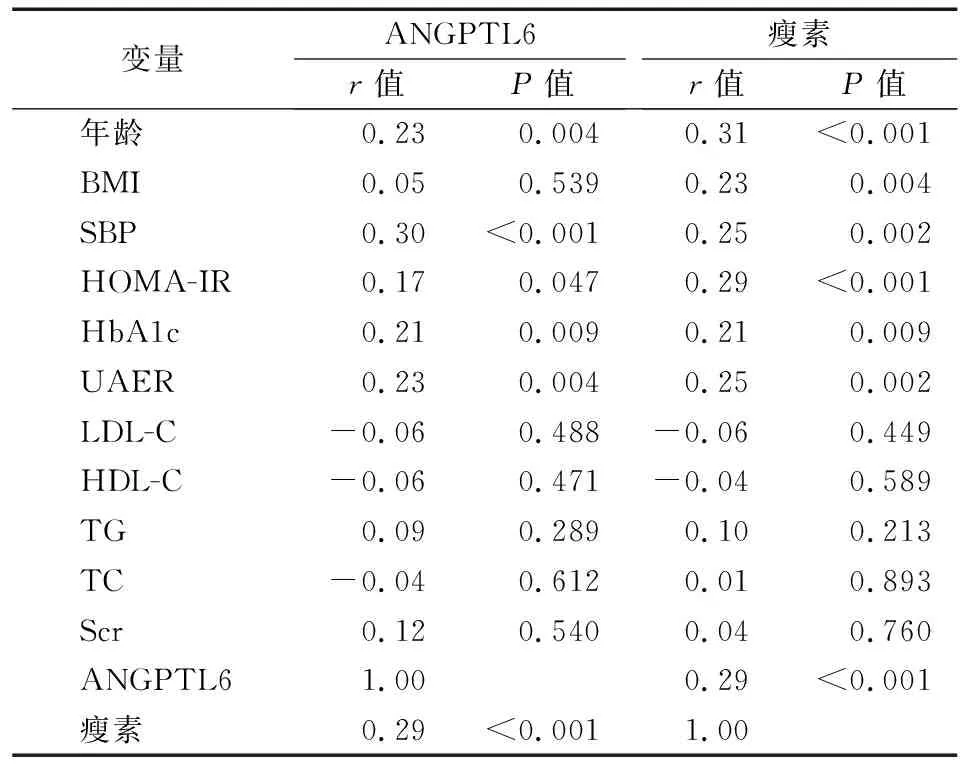
表2 ANGPTL6、瘦素水平与各临床指标的相关性分析
2.3 UAER影响因素的多元线性回归分析 以UAER为自变量,空腹血糖、FINS、收缩压、HbA1c、HOMA-IR、ANGPTL6、瘦素为因变量进行多元线性回归分析,经过变量筛选后结果示空腹血糖、ANGPTL6、瘦素为DN的危险因素,见表3。
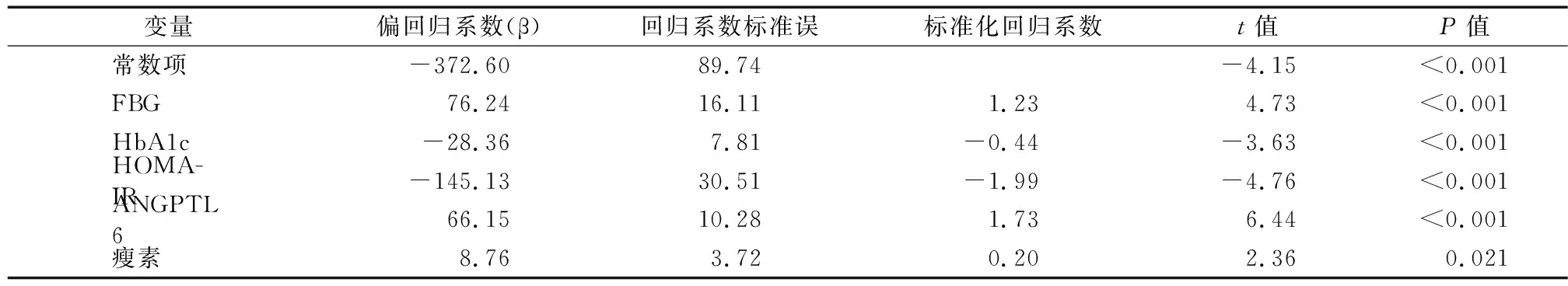
表3 UAER影响因素的多元线性回归分析
3 讨论
据2017年国际糖尿病联盟公布的数据显示,中国2型糖尿病患者2045年将达1.2亿,位居世界第一[9]。其中,DN为最常见的微血管并发症。研究认为糖脂代谢紊乱、氧化应激、炎性反应、纤维化及细胞因子等多因素参与了DN的发病环节[10]。然而,在疾病早期DN患者的临床表现常不明显,直至发展为大量白蛋白尿才引起重视,此时肾功能严重受损,最终需靠透析来维持生命,造成沉重的财政和保健负担。因此,寻找新的生物学标志物辅助提高DN患者的发现率、诊断率刻不容缓。
瘦素是由脂肪细胞分泌的一种多肽类激素,参与机体能量代谢[6]。瘦素主要经肾脏代谢,研究发现,肾小球内皮细胞、系膜细胞可表达高亲和力的瘦素受体,瘦素与其受体结合可诱导炎性反应发生,被认为在肾脏病理生理变化中有直接作用[7]。本研究结果显示,DN组瘦素水平显著升高,且与UAER呈正相关,可能的机制为瘦素与其受体结合,使肾小球内皮功能紊乱,增加肾小球内皮细胞转化生长因子-β1的表达,刺激系膜细胞Ⅰ型胶原纤维和肾小球内皮细胞Ⅳ型胶原纤维的合成,使内皮细胞受损;同时瘦素可激活肾小球内肾素-血管紧张素系统,促使肾小球肥大,肾小球滤过率下降,加速尿白蛋白排泄,共同参与了DN的发生、发展[11-12]。
ANGPTL6主要在调节糖脂代谢、胰岛素抵抗、诱导内皮细胞损伤等方面发挥作用[5,13]。体外实验表明,ANGPTL6通过激活细胞外信号调节激酶1/2-内皮型一氧化氮合酶信号通路,增加一氧化氮的产生,诱导小鼠肾小球内皮细胞损伤,内皮细胞损伤后通过分泌炎性介质和单核细胞趋化蛋白诱发炎性反应,参与DN的发生、发展[5]。ANGPTL2、ANGPTL4、ANGPTL6均属血管生成素样蛋白家族,在糖脂代谢方面起协同作用。最新研究表明,ANGPTL2、ANGPTL4通过不同途径参与DN的发展。有证据支持转录因子核因子-κB在系膜细胞中的基本作用参与了DN进展[14-15]。ANGPTL4基因敲除小鼠通过抑制高糖诱导的小鼠肾小球系膜细胞中核因子-κB的产生,降低了肿瘤坏死因子-α、白细胞介素-1、白细胞介素-6的产生,延缓DN的进程[16]。据报道ANGPTL-4在DN大鼠肾组织中表达上调,其水平与尿白蛋白、肌酐呈正相关[17]。近年来研究发现,Toll样受体4(TLR4)通过炎性反应、纤维化途径与DN的发展密切相关[18]。Yang等[19]研究表明,DN大鼠中ANGPTL2和TLR4的表达上调,而ANGPTL2基因敲除大鼠TLR4受到抑制,大鼠肾损伤、炎性反应、肾纤维化和系膜外基质积累得到缓解。Morinaga等[20]也证明了小鼠体内缺乏ANGPTL2可以通过抑制转化生长因子-β1信号通路来减轻肾间质组织损伤。本研究表明,DN组ANGPTL6水平较对照组升高,多元线性回归分析显示ANGPTL6是DN的危险因素。鉴于ANGPTL6与DN的研究较少,ANGPTL6可能通过上述促炎途径、内皮细胞损伤、纤维化等机制促进DN的发生,但尚需大量研究证实。
研究发现,ANGPTL6基因敲除小鼠在正常饮食下也会出现明显的胰岛素抵抗,表现为血清胆固醇和游离脂肪酸水平显著升高,骨骼肌和肝脏出现脂质积累[4]。研究表明,脂蛋白在肾间质中积累可通过多元醇途径促进巨噬细胞聚集及促炎细胞因子的表达,增加血液黏度,引起肾血管缺氧,加速DN的发展[21]。本研究发现,ANGPTL6与HOMA-IR呈正相关,多元线性回归分析显示HOMA-IR为UAER的影响因素,推测ANGPTL6通过影响胰岛素敏感性,促进DN的进展。另外,ANGPTL6与LDL-C、HDL-C、甘油三酯、总胆固醇无关,可能与样本量小、口服降脂药物等因素有关,尚需大样本研究明确ANGPTL是否通过调节血脂影响DN的发展。
本实验发现ANGPTL6与瘦素水平呈正相关。研究显示高剂量瘦素处理小鼠原代肝细胞,导致ANGPTL6基因、蛋白质水平上调[8]。因此,ANGPTL6的表达可能直接依赖于肝脏瘦素信号转导,但具体机制仍不清楚。ANGPTL6、瘦素可能均与炎性反应、纤维化有关,通过诱导内皮细胞损伤、系膜细胞基质沉积等,在DN的发展中起协同作用。综上所述,DN患者血清ANGPTL6、瘦素水平升高,且二者为DN的危险因素。同时,瘦素可能影响DN患者的ANGPTL6水平,ANGPTL6、瘦素可能成为DN诊断和治疗新的靶点,但相关机制仍需大量研究证实。
