皱盖疣柄牛肝菌多糖LRP-Ⅰ和LRP-Ⅱ结构表征及抗氧化活性分析
2020-11-19李小双朱家豪申利群
伍 燕,徐 峰,李小双,朱家豪,申利群,3,*
(1.兴义民族师范学院,贵州兴义 562400; 2.广西民族大学化学化工学院,广西南宁 530006; 3.广西林产化学与工程重点实验室,广西南宁 530006)
皱盖疣柄牛肝菌(Leccinumrugosiceps),隶属担子菌门(Basidiomycota)伞菌目(Agaricales)牛肝菌科(Boletaceae)疣柄牛肝菌属(Leccinum),子实体通体呈土黄色、赭黄色或黄色,成熟后菌盖表面常有皲裂,民间又叫“黄癞头”或“虎皮牛肝菌”,在我国主要分布在云南、贵州、四川和西藏等地[1]。皱盖疣柄牛肝菌是一种食药两用的野生真菌,富含多种氨基酸、糖类、脂肪、多酚、黄酮、甾类和萜类[2],口感脆嫩,味道鲜美,菌香味浓,经常食用可增强机体免疫力、改善机体微循环,是中药制剂“舒筋丸”的主要原料之一,皱盖疣柄牛肝菌属外生菌根菌,人工栽培难以获得,市场需求量大,经济价值较高。
真菌多糖是多羟基醛或多羟基酮聚合成的大分子活性物质,研究表明具有抗肿瘤、抗氧化、抗疲劳和增强免疫力等多种活性[3-4],如香菇多糖、灵芝多糖制成的中成药在临床抗肿瘤方面应用已较为广泛[5-6]。目前对牛肝菌多糖活性报道较多,如唐贤等研究表明[7],纯化后的铜色牛肝菌(Boletusaereus)多糖对MFC、CT26.WT和S180细胞增殖抑制效果明显,岳万松对铜色牛肝菌(Boletusaereus)、美味牛肝菌(Boletusedulis)、红柄牛肝菌(Boletuserythropus)、小美牛肝菌(Boletusspeciosus)和黄皮疣柄牛肝菌(Leccinumcrocipodium)多糖提取物进行抗氧化实验,表明牛肝菌多糖对羟基自由基、超氧阴离子自由基和DPPH自由基均有不同程度的清除活性[8]。目前对于皱盖疣柄牛肝菌的研究主要集中在矿质元素、阴离子等成分检测[9-13],对于其活性物质多糖的研究较少,对提取的多糖结构和活性的比较也不多见[14]。
贵州黔西南位于黔、滇、桂三省交界处,温润多雨的气候和适宜的生境使得野生皱盖疣柄牛肝菌产量丰富,每年从7~9月,有大量品相好、菇型正、味道鲜美的野生皱盖疣柄牛肝菌上市。本文以当地新鲜野生皱盖疣柄牛肝菌为原料,热水浸提粗多糖,纯化得到精制多糖用红外光谱(IR)、高效液相色谱(HCLP)、高效凝胶渗透色谱(HPGPC)、气质联用(GC-MS)和电镜扫描(SEM)等手段表征其一级结构,并进一步探讨了皱盖疣柄牛肝菌多糖的抗氧化活性,为牛肝菌的综合利用提供理论依据。
1 材料与仪器
1.1 材料与试剂
皱盖疣柄牛肝菌(Leccinumrugosiceps)新鲜子实体 2019年8月份购于兴义市丰源市场;DEAE-52纤维素、Sephadex G-100 上海瑞永生物科技公司;717阴离子柱、Dextran、葡萄糖、鼠李糖、岩藻糖、半乳糖、阿拉伯糖、甘露糖(均为分析纯) 索莱宝试剂公司;1-苯基-3-甲基-5-吡唑啉酮(PMP)、乙酸酐、三氟乙酸、盐酸羟胺、甲基咪唑、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH) 麦克林试剂公司;蒽酮、硫酸、氯仿、正丁醇、无水乙醇及其他试剂均为分析纯 国药集团化学试剂有限公司。
SHZ-D(Ⅲ)循环水真空泵 瑞德仪器设备有限公司;Bio-RadPTC200 PCR扩增仪、Gel Doc XR凝胶成像仪 美国伯乐公司;安捷伦1200高效液相色谱仪、自动进样器、G1352A RID检测器、7890A-5975C 气相色谱-质谱联用仪、DB-5色谱柱和质谱检测器 安捷伦科技有限公司;真空冷冻干燥机LGJ-10 北京松源华兴科技有限公司;VERTEX 70傅里叶变换显微红外/拉曼光谱仪 德国Bruker公司;Thermo Scientific Multiskan FC酶标仪 美国赛默飞公司。
1.2 实验方法
1.2.1 皱盖疣柄牛肝菌DNA提取和ITS序列鉴定 在新鲜子实体菌盖和菌柄连接处取20 mg菌肉,液氮研磨,试剂盒提总DNA,通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增其ITS序列,电泳检测纯度后送上海生工生物工程有限公司测序。
1.2.2 皱盖疣柄牛肝菌多糖的提取和纯化 新鲜子实体250 g切碎后加入500 mL超纯水,沸水煮40 min,过滤后保留滤液并重复提取一次,合并两次滤液[15]。在250 mL滤液里加入50 g处理好的氯化717阴离子柱,50 ℃脱色4 h,过滤后保留滤液;sevag法(氯仿∶正丁醇=4∶1 v/v)脱蛋白质;将脱色、脱蛋白后的粗糖提取液过DEAE-52纤维柱,分别用ddH2O和不同浓度NaCl溶液(0.05、0.1、0.2和0.3 mol/L)洗脱柱子(室温,流速2 mL/min),用0.1%蒽酮-硫酸溶液在紫外OD620 nm检测并绘制洗脱曲线;收集主要洗脱峰用3500 Mw透析袋脱盐(4 ℃透析72 h);透析后经减压浓缩、冷冻干燥得到粗糖粉末1 g。粗糖复溶,用Sephadex G-100柱子进一步纯化(ddH2O洗脱),收集后再次冷冻干燥得到精制多糖约100 mg。
1.2.3 皱盖疣柄牛肝菌多糖红外光谱检测 取适量精制多糖[16],按1%与色谱级KBr混匀,常规压片后进行红外扫描,扫描范围为4000~400 cm-1。
1.2.4 皱盖疣柄牛肝菌多糖单糖组成检测
1.2.4.1 多糖水解及PMP柱前衍化 取10 mg多糖样品于梨形瓶中,加入2 mol/L H2SO4溶液2 mL,抽成真空后加塞保护,在油浴锅里100 ℃水解8 h,反应完后用0.3 mol/L NaOH中和至中性,离心(4000 r/min)取上清。取上清液200 μL,依次加入100 μL 0.5 mol/L PMP甲醇溶液和100 μL 0.3 mol/L NaOH,70 ℃水浴1 h,冷却后加入100 μL 0.3 mol/L的HCl,混匀后加入1 mL CCl3萃取,离心(4000 r/min)取上清,过0.22 μm水相滤膜备用[17]。单糖标准品按同样步骤操作。
1.2.4.2 色谱条件 配制0.05 mol/L、pH6.8磷酸盐缓冲液,流动相为0.05 mol/L磷酸盐-乙腈(82∶12,v/v),流速为1.0 mL/min,检测波长为250 nm,柱温为30 ℃。
1.2.5 皱盖疣柄牛肝菌多糖纯度及分子量检测
1.2.5.1 色谱条件 TSKgel® G5000PWXL凝胶色谱柱,称取10 mg样品,用ddH2O配制成浓度为1 mg/mL的溶液,Millipore 0.45 μm水系滤膜过滤,进样检测。柱温20 ℃,0.002 mol/L磷酸二氢钠为流动相,流速0.6 mL/min。
1.2.5.2 标准曲线的绘制及样品检测 分别称取适量的Dextran标准品,将其配置成浓度约3 mg/mL的对照品溶液,逐一进行HPLC检测,根据标准糖分子量的保留时间(RT)绘制标准曲线,得出回归方程。称取一定量的样品,加入流动相,将其配制成浓度约为1 mg/mL的溶液,Millipore 0.45 μm水系滤膜过滤,进样检测[18]。
1.2.6 皱盖疣柄牛肝菌多糖甲基化及检测
1.2.6.1 甲基化及解聚 取2 mg多糖样品于梨型瓶中[19],通入氮气保护,加入1 mL DMSO溶解后再加入0.6 mL NaOH-DMSO悬液,密闭混合超声30 min,冰浴、缓慢滴加碘甲烷1 mL,避光超声20 min,加入3 mL水振荡终止反应。加入3 mL氯仿萃取,离心留下层有机相,加入无水硫酸钠除去残留水分,过0.45 μm有机滤膜,滤液置干净的梨型瓶中用氮气吹干。将已完全甲基化的多糖溶于3 mL 90%的甲酸溶液中,100 ℃解聚3 h,向反应瓶中加入3 mL甲醇,40 ℃下减压浓缩蒸干备用。
1.2.6.2 水解及乙酰化 上述多糖样品中加入2 mol/L的三氟乙酸3 mL,120 ℃下水解4 h,冷却至室温,加入0.5 mL甲醇于40 ℃下减压旋干,彻底去除三氟乙酸。干燥后的样品加入60 mg/mL的盐酸羟胺溶液(盐酸羟胺溶于吡啶中)1 mL,密闭且充分振荡,置于90 ℃真空干燥箱中氧化30 min。冷却至室温,加入0.2 mL 1-甲基咪唑和1 mL的乙酸酐充分振荡混合均匀,密闭置于90 ℃真空干燥箱中反应30 min,冷却至室温形成乙酰化的衍生物。加入1 mL的三氯甲烷和1 mL的水,混匀后静置数分钟待分层,去除上层水相,再加入1 mL的水,充分振荡,离心分层,去除水相,过0.45 μm的有机系滤膜,置于进样瓶中进行气相色谱分析。
1.2.7 皱盖疣柄牛肝菌多糖扫描电镜检测 取少量真空干燥多糖样品固定在样品架上,真空镀金使样品处于导电状态,电压10 kV下进行电镜扫描。
1.2.8 皱盖疣柄牛肝菌多糖对ABTS+·和DPPH·清除率测定
1.2.8.1 ABTS+·清除率的测定 用ddH2O分别配制1、2、4、6、8和10 mg/mL浓度的多糖溶液。取96孔板,依次加入各浓度样品溶液50 μL,再加入ABTS工作液150 μL,混匀、避光静置6 min,734 nm波长测定OD值,记作Ai(样品吸光度值);各样品溶液50 μL加入ddH2O 150 μL,同法测定OD值,记作Aj(样品本底吸光度值);取50 μL的ddH2O加入150 μL的ABTS溶液,同法测定OD值,记作A0(阴性对照),重复3次[20]。以VC为阳性对照。ABTS自由基清除率(%)=[1-(Ai-Aj)/A0]×100。
1.2.8.2 DPPH·清除率的测定 用ddH2O分别配制1、2、4、6、8和10 mg/mL浓度的多糖溶液。取96孔板,依次加入各浓度样品溶液100 μL,再加入DPPH(0.1 mmol/L)工作液100 μL,混匀、避光静置30 min,517 nm波长处测定OD值,记作Ai(样品吸光度值);各样品溶液100 μL加入无水乙醇100 μL,同法测定OD值,记为Aj(样品本底吸光度值);无水乙醇100 μL加入DPPH工作液100 μL,同法测定OD值记为A0(阴性对照),重复3次[21]。DPPH自由基清除率(%)=[1-(Ai-Aj)/A0]×100。
1.3 数据处理
实验数据的统计和处理使用Excel 2010和Origin 9.0软件。
2 结果与分析
2.1 子实体鉴定
新鲜子实体为图1所示,菌体呈明黄色,成熟后菌盖常有皲裂,菌肉白色或浅黄色,无伤变。图2为基于ITS序列比对结果,在NCBI上Blast N比对,兴义产牛肝菌XYZG与皱盖疣柄牛肝菌(Leccinumrugosiceps)KY440111序列100%同源,经过形态学和分子生物学鉴定,该野生牛肝菌为皱盖疣柄牛肝菌。

图1 皱盖疣柄牛肝菌野生子实体Fig.1 A wild fruiting body of Leccinum rugosiceps
2.2 皱盖疣柄牛肝菌多糖分离纯化
提取的粗多糖溶液过DEAE-52纤维素柱,用不同浓度NaCl溶液洗脱后得到如图3的洗脱曲线,在0.05 mol/L洗脱浓度下得到多糖LRP-Ⅰ,在0.2 mol/L洗脱浓度下得到LRP-Ⅱ,透析后再分别用凝胶柱葡聚糖G-100进一步纯化,得到精制多糖LRP-Ⅰ40 mg和LRP-Ⅱ 60 mg。

图2 基于ITS序列构建的NJ系统发育树Fig.2 NJ phylogenetic tree based on ITS sequence

图3 皱盖疣柄牛肝菌粗多糖的DEAE-52纤维素离子交换柱层析洗脱曲线Fig.3 Elution curve of crude polysaccharidefrom Leccinum rugosiceps with DEAE-celluloseion exchange column chromatography
2.3 红外光谱(IR)分析

图4 多糖LRP-Ⅰ(A)和LRP-Ⅱ(B)红外图谱Fig.4 Infrared spectroscopy of LRP-Ⅰ(A)and LRP-Ⅱ(B)
图4A所示,多糖LRP-Ⅰ吸收峰有:3450.99 cm-1较宽峰是糖-OH伸缩振动峰,2920.16 cm-1是糖C-H伸缩振动峰,1628.29 cm-1是羧基C=O 非对称伸缩振动峰,1460.01 cm-1是C-H变角振动峰,在(1150.47~1023.25) cm-1三处吸收峰是糖环上的C-O-C和C-O-H伸缩振动峰,表明存在吡喃糖环,928.60 cm-1和848.33 cm-1是(1→4)-α-葡聚糖特征吸收峰,760.49 cm-1是吡喃环对称环伸缩振动峰[22-23]。
图4B所示,多糖LRP-Ⅱ吸收峰有:3438.12 cm-1多糖-OH伸缩振动峰,2997.43和2930.85 cm-1的尖峰是C-H的伸缩振动,1621.48 cm-1是羧基C=O非对称伸缩振动,在1473.82~1332.21 cm-1范围内为C-H变角振动及O-H弯曲振动引起的吸收峰;1130.78~1029.31 cm-1范围内为C-O-C和C-O-H伸缩振动引起的吸收峰,存在吡喃糖环[24-26];另外,814.25 cm-1处的吸收为甘露糖存在的特征吸收[27],784.75 cm-1是吡喃环对称环伸缩振动峰。

图5 单糖标准品(A)、LRP-Ⅰ(B)和LRP-Ⅱ(C)的单糖水解色谱图Fig.5 HPLC analysis of standard sample(A),LRP-Ⅰ(B)and LRP-Ⅱ(C)polysaccharide hydrolysate 注:Man-甘露糖;Rha-鼠李糖;GalA-半乳糖醛酸;Glu-葡萄糖;Gal-半乳糖;Xyl-木糖;Ara-阿拉伯糖;Fuc-岩藻糖。
2.4 组成多糖的单糖测定
将多糖LRP-Ⅰ和LRP-Ⅱ分别酸水解并衍生化后,在相同的HPLC条件下进行单糖与混合单糖标准品(A)比较。结果如图5所示,皱盖疣柄牛肝菌多糖LRP-Ⅰ(B)由甘露糖、鼠李糖、葡萄糖、木糖和岩藻糖组成,单糖摩尔比为0.68∶0.10∶2.87∶0.28∶0.12,葡萄糖相对含量较多;LRP-Ⅱ(C)由甘露糖、葡萄糖、木糖、阿拉伯糖和岩藻糖组成,单糖摩尔比组成为1.69∶2.30∶2.06∶0.10∶1.04,葡萄糖和木糖相对含量较多。
2.5 多糖纯度及分子质量测定

表1 多糖LRP-Ⅰ的甲基化分析Table 1 Methylation analysis data of LRP-Ⅰ

表2 多糖LRP-Ⅱ的甲基化分析Table 2 Methylation analysis data of LRP-Ⅱ
图6所示为纯度和分子量检测,多糖LRP-Ⅰ(A)和LRP-Ⅱ(B)呈单一对称峰,依据Dextran工作标准曲线得到回归方程:Log(Mw)=-0.4405x+10.809,R2=0.9975,在保留时间为8.493和14.883 min时,LRP-Ⅰ分子量大小为:1.98×104Da;LRP-Ⅱ分子量大小为:8.38×106Da,两种多糖的分子量相差较大。

图6 多糖LRP-Ⅰ(A)和LRP-Ⅱ(B)纯度及分子质量分布图Fig.6 Distribution of purity and HP-GPC ofLRP-Ⅰ(A)and LRP-Ⅱ(B)
2.6 甲基化分析
图7A是多糖LRP-Ⅰ甲基化后的 GC-MS图谱,经NIT14质谱库检索和人工校对,对甲基化的LRP糖苷键进行分析,结果见表1,主要糖苷键类型有:葡萄糖以→1,4)-Glcp连接为主,有→1,6)-Glcp分支和→1-Glcp非还原末端连接,占比38.11%;甘露糖以→1,3)-Manp连接为主,有→2,6)-Manp分枝,占比29.13%;木糖→1,3)-Xylp连接为主,占比19.29%;鼠李糖→1,3)-Rhap连接为主,占比9.22%;岩藻糖以→1,3)-Fucp为主,占比4.25%。
图7B是LRP-Ⅱ甲基化后的 GC-MS图谱,如表2所示,主要糖苷键类型有:葡萄糖以→1,4)-Glcp连接为主,有→1,6)-Glcp分支和→1-Glcp非还原末端连接,占比50.80%;甘露糖以→1,3)-Manp连接为主,有分枝→2,3,6)-Manp和→2,6)-Manp,此外还有非还原末端→1-Manp连接,占比24.45%;木糖主要以→1,3)-Xylp连接,占比12.93%;岩藻糖以→1,3)-Fucp为主,占比11.82%。

图8 多糖LRP-Ⅰ(a,b,c)和LRP-Ⅱ(d,e,f)的SEM图像Fig.8 SEM images of LRP-Ⅰ(a,b,c)and LRP-Ⅱ(d,e,f)
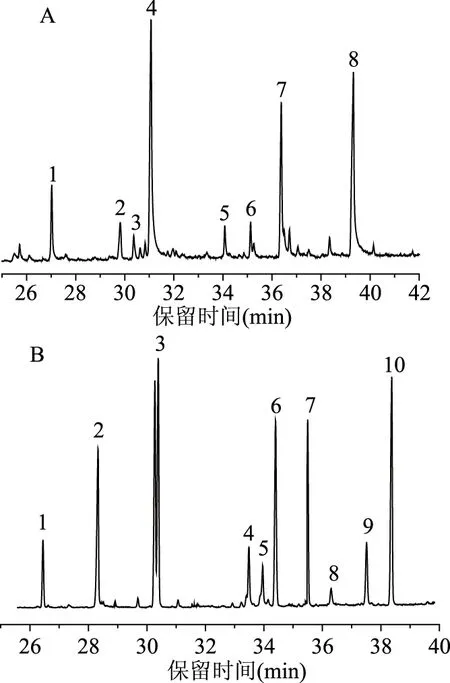
图7 多糖LRP-Ⅰ(A)和LRP-Ⅱ(B)甲基化后CG-MS色谱图Fig.7 CG-MS chromatogram of methylation ofLRP-Ⅰ(A)and LRP-Ⅱ(B)
2.7 扫描电镜分析
如图8所示,在扫描电镜下观察到暗褐网柄牛肝菌多糖LRP-Ⅰ呈分散的片状、带状和丝状,彼此无紧密连接,整体结构较疏松;LRP-Ⅱ在电镜下呈现网孔状,彼此连接呈整体的多层分枝结构,分子间交叉,网状结构边缘光滑、平整,整体结构较致密。
2.8 抗氧化分析
由图9可知,皱盖疣柄牛肝菌多糖LRP-Ⅰ和LRP-Ⅱ对ABTS和DPPH自由基的清除率随浓度的升高而增强。将各浓度清除率代入Excel中得到各自回归方程,通过计算可知,LRP-Ⅰ对ABTS自由基的半清除浓度值EC50为3.36 mg/mL,LRP-Ⅱ对ABTS自由基的EC50值为4.01 mg/mL;LRP-Ⅰ对DPPH自由基的半清除浓度值EC50为5.72 mg/mL,LRP-Ⅱ对DPPH自由基的EC50值为6.84 mg/mL。可见,两种多糖对ABTS和DPPH自由基均有良好清除作用,但从清除效果来看,LRP-Ⅰ对ABTS和DPPH自由基清除所需的EC50值均比LRP-Ⅱ低,说明LRP-Ⅰ比LRP-Ⅱ表现良好。

图9 LRP-Ⅰ(A)和LRP-Ⅱ(B)对ABTS、DPPH自由基的清除率Fig.9 Scavenging effects of the essential oil fromLRP-Ⅰ(A)and LRP-Ⅱ(B)on ABTS,DPPH free radicals
3 结论
本研究从皱盖疣柄牛肝菌子实体中分离到两种均一组分多糖LRP-Ⅰ和LRP-Ⅱ。LRP-Ⅰ呈白色、絮状,水溶性好,分子量为1.98×104Da,水解后葡萄糖、甘露糖和木糖含量分别为70.91%、16.73%和6.87%,葡萄糖含量较多,甲基化后显示糖苷键类型主要有→1,4)-葡聚糖、→1,3)-甘露聚糖和→1,3)-木聚糖,电镜下呈分散的片状、带状和丝状,对ABTS和DPPH自由基的清除效果较LRP-Ⅱ好;LRP-Ⅱ呈浅黄色、纤维状,水溶性稍差,分子量为8.38×106Da,分子量相对较大,水解后葡萄糖、木糖和甘露糖含量分别为31.99%、28.65%和23.48%,甲基化分析糖苷键类型主要有→1,4)-葡聚糖、→1,3)-甘露聚糖和→1,3)-木聚糖,电镜扫描呈连续的多层网孔状,且边缘光滑、连接紧密,总体上水溶性和抗氧化活性不如LRP-Ⅰ。
总之,皱盖疣柄牛肝菌多糖分子量相对较大,如LRP-Ⅱ可达到8.38×106Da,单糖组成显示甘露糖和木糖含量较多,在菌体上能形成稳定、复杂的支撑结构,因而相比其它牛肝菌如美味牛肝菌、小美牛肝菌、白牛肝菌等小型牛肝菌,皱盖疣柄牛肝菌能形成较大子实体。从皱盖疣柄牛肝菌中提取的两种多糖LRP-Ⅰ和LRP-Ⅱ,化学结构明显不同,故水溶性和抗氧化活性也表现出差异,分子量较小的LRP-Ⅰ(1.98×104Da)表现出较好活性,这为进一步了解牛肝菌多糖的活性机制提供了重要参考。
