基于在体单向肠灌流模型的红车轴草异黄酮类成分渗透性研究
2020-11-19罗立宇吴宏伟赵海誉高文远
罗立宇,吴宏伟,赵海誉,高文远
基于在体单向肠灌流模型的红车轴草异黄酮类成分渗透性研究
罗立宇1,吴宏伟2,赵海誉2,高文远1
1.天津大学药物科学与技术学院,天津 300072;2.中国中医科学院中药研究所,北京 100700
研究红车轴草水提物的异黄酮类肠吸收成分及其肠渗透性,探讨其相应机制。采用超高效液相色谱串联质谱法(UPLC-MS/MS),建立红车轴草水提物肠灌流液中异黄酮类成分大豆苷元、大豆苷、染料木苷、毛蕊异黄酮葡萄糖苷、芒柄花素、芒柄花苷的定量分析方法。基于大鼠在体单向肠灌流模型,研究红车轴草水提物中6种异黄酮类成分在不同小肠段(十二指肠、空肠、回肠)的肠渗透性,并对不同浓度的芒柄花素、芒柄花苷单体成分肠渗透特征进行研究。建立了红车轴草水提物肠灌流液中6种异黄酮类成分的UPLC-MS/MS定量分析方法,符合方法学要求。红车轴草水提物灌流液各成分的有效渗透系数(P)均大于5×10-5cm/s,最大者为芒柄花素(P=3.20,十二指肠),其次为染料木苷(P=2.19,空肠);对于不同肠段,各成分P和吸收速率常数(Ka)均存在一定差异,大豆苷元、芒柄花素的十二指肠P最大,其余4种成分的空肠P最大,表明红车轴草水提物中异黄酮的最佳吸收窗口为十二指肠和空肠;不同浓度芒柄花素、芒柄花苷单体灌流的P、Ka差异均无统计学意义(>0.05),吸收曲线近似线性,其吸收机制符合被动扩散的特征。本研究初步明确了红车轴草水提物中异黄酮类成分的肠渗透性及吸收机制,可为质控成分筛选、制剂开发及临床合理用药提供参考。
在体单向肠灌流;渗透性;红车轴草;异黄酮;芒柄花素;芒柄花苷
红车轴草为豆科车轴草属植物红车轴草L.的花序及带花枝叶,广泛分布于世界各地,我国各地均有栽培或野生。该植物主要含黄酮、异黄酮、香豆素、有机酸等化学成分[1],其中异黄酮类成分为红车轴草的主要药效成分,如芒柄花素、毛蕊异黄酮葡萄糖苷、染料木苷等,该类成分具有雌激素样作用[2-3],可预防癌症[4]、抗骨质疏松[5]、改善女性围绝经期综合征[6-7]等。
口服给药是中药临床常用途径,胃肠道吸收是影响口服药生物利用度和变异性的重要因素,了解药物的胃肠道吸收机制、吸收部位及肠渗透性,对于确定药物的剂型、揭示中药功效物质基础及其相互作用、指导临床用药具有重要意义[8]。目前,预测药物小肠吸收的方法主要分为体外法、离体法、在体法3种[9],其中在体单向肠灌流模型能够维持血液供应,较好地模拟体内环境,不损伤研究部位的循环系统和生理环境,并可精确获取不同肠段的吸收特征,与人体试验结果更具有一致性[10-11]。
目前关于红车轴草中异黄酮类成分的研究主要集中在成分定性、定量及药理活性,其肠吸收成分及吸收规律研究迄今尚未见报道。因此,本研究基于大鼠在体单灌流模型,首先采用超高效液相色谱串联质谱法(UPLC-MS/MS)分析红车轴草肠灌流液中主要有效成分,建立其中主要异黄酮类成分芒柄花素、大豆苷元、大豆苷、芒柄花苷、染料木苷、毛蕊异黄酮葡萄糖苷的定量分析方法,在此基础上对红车轴草水提物的肠吸收特征进行研究,揭示其在不同小肠段(十二指肠、空肠、回肠)的渗透和吸收动力学特征,并以芒柄花素、芒柄花苷为代表,对其吸收机制进行探索,为辨识红车轴草质控成分、揭示红车轴草异黄酮类有效成分在体内的吸收机制奠定基础。
1 仪器、试药与动物
Acquity UPLC I-Class型超高效液相色谱仪,美国沃特世公司;Xevo TQ-S micro三重四级杆质谱串联(配备MassLynx数据采集软件),美国沃特世公司;BSA2202S、BSA124S分析天平,德国赛多利斯公司;KQ5200E超声波清洗器,昆山市超声仪器有限公司;Sigma 1-15PK高速离心机,德国希格玛公司;LSP02-1B注射泵,保定兰格恒流泵有限公司;Milli-Q超纯水制备系统,美国密理博公司。
红车轴草采自陕西省宁强汉源镇,经北京中医药大学王晶娟副教授鉴定为豆科车轴草属植物红车轴草L.的花序及带花枝叶;对照品芒柄花素(上海诗丹德标准技术服务有限公司,纯度>98%,批号1559/15005)、大豆苷元(四川省维克奇生物科技有限公司,纯度>98%,批号110794)、大豆苷(成都曼斯特生物科技有限公司,纯度>98%,批号MUST-11121201)、芒柄花苷(成都普菲德生物技术有限公司,纯度>98%,批号130507)、染料木苷(上海源叶生物科技有限公司,纯度>98%,批号P09M8F31018)、毛蕊异黄酮葡萄糖苷(成都普菲德生物技术有限公司,纯度>98%,批号140326)、金丝桃苷(上海源叶生物科技有限公司,纯度>98%,批号Y04A9X62302),芒柄花素、芒柄花苷原料药(南京普怡生物科技有限公司,纯度>98%,批号140189、141112);质谱级乙腈、甲酸,美国飞世尔科学世界公司;分析级磷酸、氯化镁、氯化钠、磷酸二氢钠、氯化钾、氯化钙、碳酸氢钠、葡萄糖,北京化工厂。
SD大鼠,雄性,体质量250~280 g,斯贝福(北京)实验动物科技有限公司提供,动物许可证号SCXK(京)2019-0010。饲养于SPF级动物实验室,环境温度(23±2)℃,湿度(55±10)%,12 h/12 h光照黑暗循环,自由摄食饮水。
2 方法与结果
2.1 溶液制备
2.1.1 对照品溶液
精密称取各对照品适量,置于50 mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,得单一成分对照品贮备液。精密量取各单一成分对照品贮备液适量于同一50 mL容量瓶中,加甲醇稀释至刻度,摇匀,得浓度约为15 μg/mL的混合对照品贮备液,取混合对照品贮备液继续稀释,得系列不同浓度的混合对照品溶液,用于分析方法的建立。
2.1.2 Krebs-Ringer’s溶液
分别称取葡萄糖1.4 g、氯化钙0.37 g,分别单独溶解。称取氯化镁0.02 g、磷酸二氢钠0.32 g、氯化钾0.35 g、碳酸氢钠1.37 g、氯化钠7.8 g,加水溶解,缓慢加入葡萄糖溶液和氯化钙溶液,加水稀释并定容至1000 mL,即得Krebs-Ringer’s溶液(K-R溶液)。
2.1.3 酚红溶液
取酚红20 mg,精密称定,溶于1 L K-R溶液中,混匀,即得浓度20 μg/mL的酚红贮备液。精密移取酚红贮备液适量至量瓶中,以K-R溶液稀释成酚红浓度分别为5~20 μg/mL的系列溶液,以吸光度对酚红浓度进行线性回归,绘制标准曲线。精密移取灌流液0.5 mL,置10 mL试管中定容,摇匀,0.45 μm微孔滤膜过滤,取续滤液,用紫外-可见分光光度计在波长555 nm处测定吸光度,以标准曲线法计算酚红含量,用于药物浓度校正。
2.1.4 红车轴草水提物及单体成分灌流液
称取100 g红车轴草,剪断,加适量水浸泡30 min,加热煎煮45 min,纱布过滤,得滤液,药渣继续加水煎煮45 min,过滤,合并2次滤液,加热浓缩为含原药材1 g/mL的红车轴草水提液。精密移取红车轴草水提液2 mL于50 mL容量瓶中,用酚红贮备液定容,即得肠灌流实验所用红车轴草水提物灌流液。
分别称取适量芒柄花素、芒柄花苷对照品,加甲醇溶解,配制成所需浓度贮备液,4 ℃贮存。取单体成分贮备液1 mL,用酚红贮备液稀释至不同浓度,即得单体成分肠灌流液。
取SD大鼠,禁食不禁水12~18 h,腹腔注射10%水合氯醛麻醉。沿腹中线打开腹腔,选取所需3个肠段:自幽门下2 cm处向下10 cm为十二指肠段,自幽门下15 cm处向下10 cm 为空肠段,自盲肠上端2 cm处向上10 cm为回肠段。于肠段两端切口,用37 ℃生理盐水冲洗至无内容物流出,再用空气将生理盐水排空,插管并结扎,接恒流泵。注射泵与肠段入口端相连,设置灌流速度为0.2 mL/min,用肠灌流液(预热至37 ℃)持续灌流约30 min吸收达到稳定后重新计时,每隔15 min用已知质量的EP管在肠段出口端收集流出灌流液[12-13]。实验结束后剪下被灌流的肠段并处死大鼠,测量肠段长度及内径,计算EP管内灌流液的质量。所得灌流液经处理后,分别测定各时间点样品中指标成分含量及相应的酚红浓度。
2.2 分析方法的建立
2.2.1 色谱条件
采用ACQUITY UPLC BEH Shield RP18色谱柱(2.1 mm×100 mm,1.7 μm),流速0.3 mL/min,柱温40 ℃,流动相A为0.1%甲酸水、B为乙腈,进样量2 μL。梯度洗脱程序:0~1.0 min,90%~80%A;1~5.5 min,80%~60%A;5.5~6 min,60%~20%A;6~8 min,20%~5%A;8~8.5 min,5%A;8.5~9 min,5%~90%A;9~10 min,90%~90%A。
2.2.2 质谱条件
采用电喷雾离子源(ESI),正、负离子扫描,多反应监测(MRM)方式。毛细管电压0.5 kV,脱溶剂气流N2,流速1000 L/h,脱溶剂温度500 ℃,离子源温度150 ℃。定性、定量离子对及碰撞能量等质谱参数见表1。
表1 6种化合物质谱参数
化合物 名称ESI 模式保留时间/min母离子(m/z)定量离子(m/z)锥孔电压/V碰撞能量/eV 大豆苷+2.42417.08255.034812 染料木苷+3.30433.07271.092416 芒柄花苷+3.78431.09269.125014 大豆苷元+5.18255.06 91.018234 芒柄花素-6.72267.04251.995816 毛蕊异黄酮 葡萄糖苷+2.55447.09285.115216
2.2.3 供试品溶液制备
取大鼠肠灌流液,加甲醇稀释10倍,用0.22 μm微孔滤膜过滤,进行UPLC-MS/MS分析。
2.2.4 测定法
分别取空白灌流液、混合对照品溶液(50 ng/mL)及供试品溶液,按上述方法进行UPLC-MS/MS分析,结果见图1。在上述色谱及质谱条件下,红车轴草灌流液中6种目标成分能实现良好分离,并具有较好的响应值,且无其他成分干扰目标成分的检测。
2.2.5 方法学考察
2.2.5.1 线性关系与定量限
取“2.1.1”项下混合对照品溶液,用甲醇稀释为浓度1~300 ng/mL的系列对照品溶液(=6),进行UPLC-MS/MS分析,以各自定量离子的峰面积为纵坐标、对照品浓度为横坐标绘制标准曲线,得各成分线性方程和相关系数。结果表明,各成分在测定范围内线性关系良好。
取“2.1.1”项下对照品混合溶液,逐级稀释并测定,至信噪比(S/N)=10,得定量限。结果表明各成分的定量限符合测定要求,方法灵敏度良好。
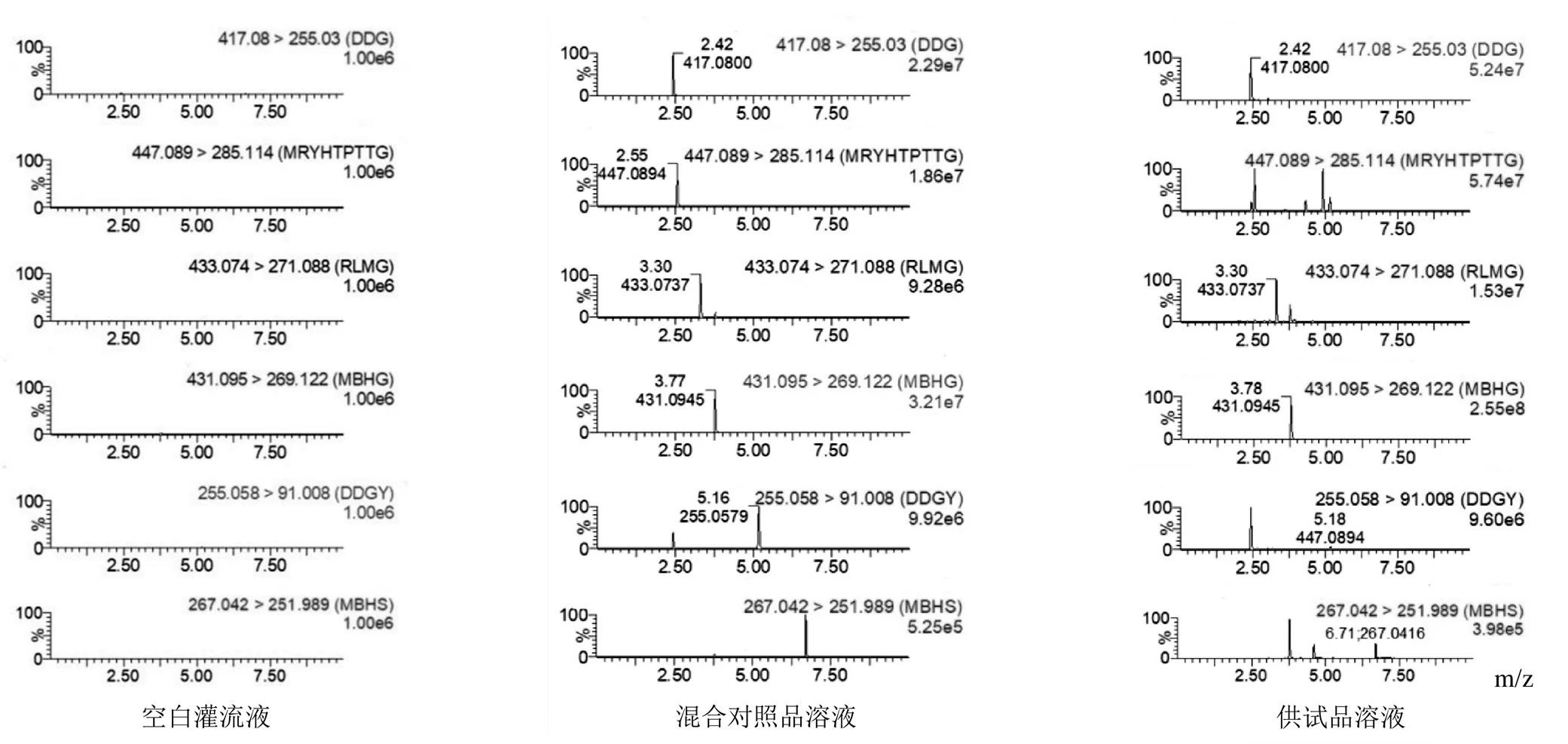
注:DDG.大豆苷;MRYHTPTTG.毛蕊异黄酮葡萄糖苷;RLMG.染料木苷;MBHG.芒柄花苷;DDGY.大豆苷元;MBHS.芒柄花素
2.2.5.2 精密度试验
取“2.1.1”项下混合对照品贮备液适量,加甲醇稀释至浓度50 ng/mL的混合对照品溶液,连续进样6次,记录峰面积并计算RSD。结果各成分RSD均小于3%,表明仪器精密度良好。
2.2.5.3 重复性试验
取“2.1.4”项下同一灌流液,按“2.2.3”项下方法平行制备6份供试品溶液,进行UPLC-MS/MS分析,记录峰面积并计算RSD。结果各成分RSD均小于3%,表明方法重复性良好。
2.2.5.4 稳定性试验
取“2.1.4”项下同一灌流液,按“2.2.3”项下方法制备,分别于0、2、4、10、20、24 h进行UPLC-MS/MS分析,记录峰面积并计算RSD。结果各成分峰面积RSD为1.2%~3.9%,表明供试品溶液在24 h内稳定。
2.2.5.5 加样回收率试验
取目标成分浓度已知的红车轴草灌流液,按低(50%)、中(100%)、高(200%)浓度分别加入对照品,各浓度平行制备3份,进行UPLC-MS/MS分析,记录峰面积并计算加样回收率。结果表明各成分的回收率良好,RSD均小于5%,方法的准确度符合要求。
2.2.5.6 方法学考察结果
红车轴草灌流液中6种方法学考察结果见表2。
表2 红车轴草灌流液中6种成分方法学考察结果
化合物线性范围/ (ng/mL)相关系数 (R2)定量限/ (ng/mL)精密度 RSD/%重复性 RSD/%稳定性 RSD/%平均回收率/% 低浓度中浓度高浓度 大豆苷1.45~2890.999 50.0142.22.53.7 96.5105.2 97.8 毛蕊异黄酮葡萄糖苷1.28~2550.999 90.0131.32.81.5 96.6103.5103.5 染料木苷1.20~2390.999 70.2402.02.83.9 97.8101.4 97.3 芒柄花苷1.66~1660.999 80.0171.21.52.3100.4104.1 97.6 大豆苷元1.51~1510.999 20.3002.10.53.7103.7104.1100.9 芒柄花素1.17~2330.999 70.5002.61.21.2102.5 95.4 97.5
2.3 肠渗透性分析
按“2.1.4”项下方法,收集不同肠段、不同时间点的肠灌流液,按上述方法进行检测,计算主要成分浓度;并测量相应肠段长度、内径及灌流液质量,按以下公式计算有效渗透系数(P)和吸收速率常数(Ka)[13]。
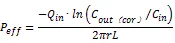
式中,Q为灌流液流速(mL/min);C为灌流液未经肠吸收时各成分的浓度(μg/mL);C为灌流收集液中各成分浓度(μg/mL);C(cor)为校正后的灌流收集液中各成分浓度(μg/mL);L为灌流肠段长度(cm);为灌流肠段半径(cm);=2πrL,为灌流肠段体积(mL);M、M分别为肠腔进、出口端灌流液中酚红浓度。
大鼠肠灌流实验获得的P值与人体肠吸收实验获得的P值有较好的一致性,并与口服生物利用度具有较好的相关性,根据Zakeri-Milani[14]规则判定, P<5×10-5cm/s为低渗透性,P>5×10-5cm/s为高渗透性。Ka用于评价药物吸收快慢。
红车轴草水提物的肠渗透性分析结果见表3。可以看出,各成分P均大于5×10-5cm/s,表明红车轴草水提物中6种异黄酮类成分渗透性良好,其中P最大者为芒柄花素(P=3.20±0.94,十二指肠),其次为染料木苷(P=2.19±0.7,空肠)。对于不同肠段,各成分P和Ka均存在一定差异:P差异最大的成分为染料木苷(<0.05),空肠(P=2.19)为回肠(P=0.34)的6.4倍;其次为大豆苷(<0.05),空肠(P=0.93)为回肠(P=0.18)的5.2倍。各成分的最大P及Ka均出现在十二指肠或空肠段,表明各成分在小肠的主要吸收部位为十二指肠和空肠。另外,对于各肠段(十二指肠、空肠、回肠),苷元(大豆苷元、芒柄花素)的P和Ka均显著大于其相应的苷(大豆苷、芒柄花苷),差异有统计学意义(<0.05),表明在溶液状态下,苷元较苷更易于透过肠壁而被吸收。
表3 红车轴草6种异黄酮类成分不同肠段Peff、Ka(±s,n=3)
2.4 芒柄花素、芒柄花苷肠吸收机制
为进一步探索红车轴草异黄酮类成分的肠吸收机制,基于主要吸收部位(空肠),选取芒柄花素、芒柄花苷为代表,考察多浓度的吸收特征,探讨其吸收机制。累积吸收曲线见图2、图3。可见,累积吸收量随灌流液中成分浓度升高而增大,吸收曲线近似于线性,提示肠道对芒柄花素、芒柄花苷的吸收无浓度抑制,其吸收机制以被动扩散为主。由表4、表5可见,芒柄花素P、Ka分别为(1.00~1.20)×10-4cm/s、(9.62~10.98)×10-4/s,芒柄花苷P、Ka分别为(0.54~0.66)×10-4cm/s、(6.05~7.69)×10-4/s,提示浓度对芒柄花素、芒柄花苷的P和Ka没有影响(>0.05),进一步表明芒柄花素、芒柄花苷的吸收机制以被动扩散为主。
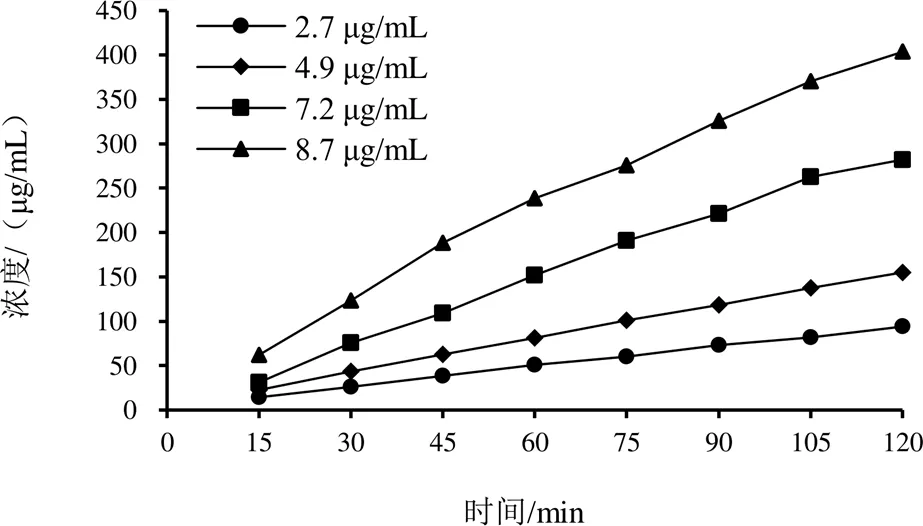
图2 芒柄花素空肠累积吸收曲线
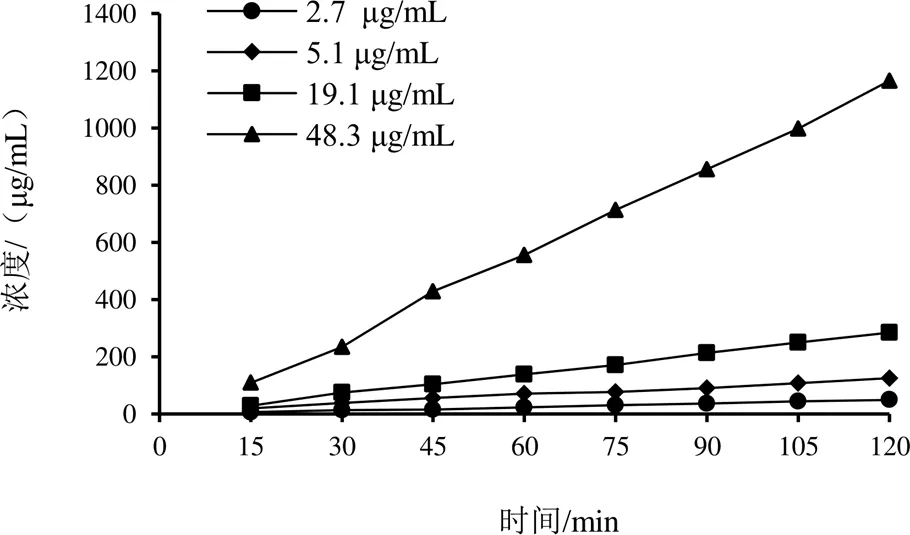
图3 芒柄花苷空肠累积吸收曲线
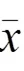
表4 不同浓度芒柄花素的空肠Peff、Ka(±s,n=3)

表5 不同浓度芒柄花苷的空肠Peff、Ka(±s,n=3)
3 讨论
本试验对色谱条件、质谱条件及样品前处理方法进行了系统考察。色谱方面,比较了甲醇-水和乙腈-水洗脱系统,以及不同品牌色谱柱,结果发现采用ACQUITY UPLC BEH Shield RP18色谱柱,流动相为乙腈-0.1%甲酸水时,可得到良好的MRM色谱峰形;质谱方面,主要对各成分的碰撞诱导解离电压进行了优化,以便获得最大响应值;在样品前处理上,除采用甲醇直接稀释外,还考察了固相萃取的前处理法,虽然固相萃取能够更好地去除样品的中无机盐、浓缩样品,但综合分析效果及分析通量,最终决定采用灌流液直接加甲醇稀释的方法,该方法快速、准确,目前尚未见相关报道。
红车轴草主要异黄酮类成分除以上6种外,含量较高的还有染料木素、鹰嘴豆芽素A[1]等,因此前期拟对其进行定量研究。但预实验结果表明,红车轴草水提液未能检出染料木素与鹰嘴豆芽素A,在50%甲醇水超声提取液中才能检测到染料木素与鹰嘴豆芽素A,这是由于染料木素与鹰嘴豆芽素A的极性较小,难溶于水。考虑到红车轴草在临床使用中主要以水作为提取溶剂,为保持与临床用法的一致性,本研究采用水作为提取溶剂,研究红车轴草水提液中多种异黄酮类成分的渗透性。同时,本研究确定的6种异黄酮类成分也可为基于水煎液的红车轴草中药复方的质量控制标志物的筛选提供参考。
红车轴草水提液6种异黄酮类成分的P均大于5×10-5cm/s,表明红车轴草水提液异黄酮类成分渗透性良好。由于特定的溶解性、渗透性或物理化学性质,一些药物只在特定的肠段吸收,称为吸收窗口[15-16]。不同肠段存在酶活性、黏膜层厚度、膜成分等生理差异,导致对不同化学成分的吸收存在显著差异[17-19]。本研究中红车轴草水提液6种异黄酮类成分在不同肠段的吸收均存在一定差异,大豆苷元、芒柄花素在十二指肠的P最大,其余4种成分在空肠的P最大,提示红车轴草水提物异黄酮类成分的最佳吸收窗口为十二指肠和空肠。
不同浓度芒柄花素和芒柄花苷的空肠段吸收实验结果显示,在试验浓度范围内,药物浓度不影响其吸收特征,表明芒柄花素、芒柄花苷肠吸的吸收机制以被动扩散为主。其他成分的吸收机制尚待进一步确认。
与芒柄花素、芒柄花苷单体形式给药相比,红车轴草水提取物中芒柄花素、芒柄花苷在相应肠段(空肠)的P显著提高(<0.05),表明红车轴草水提物多成分的综合效应促进了芒柄花素、芒柄花苷的渗透吸收。
另外,在葛根芩连片有效成分渗透性研究中,基于与本研究相同的实验方法,得到葛根芩连片中大豆苷元与大豆苷在大鼠空肠段的P分别为0.41×10-4、0.64×10-4cm/s[20],本研究结果得到红车轴草水提液中大豆苷元与大豆苷在大鼠空肠段的P分别为1.08×10-4、0.93×10-4cm/s,较其在葛根芩连片中的P值显著提高,表明中药不同复方配伍导致的化学环境变化对有效成分的渗透吸收会产生影响。
综上,本研究通过对红车轴草水提物异黄酮类成分的肠渗透性研究,揭示了其主要吸收成分、各成分的吸收特征,以及芒柄花素、芒柄花苷的吸收机制,可为红车轴草质控成分的筛选、制剂的开发及临床合理用药提供参考和支持。
[1] WU Q, WANG M, SIMON J E. Determination of isoflavones in red clover and related species by high-performance liquid chromatography combined with ultraviolet and mass spectrometric detection[J]. J Chromatogr A,2003,1016(2):195-209.
[2] BUDRYN G, GALAZKA-CZARNECKA I, BRZOZOWSKA E, et al. Evaluation of estrogenic activity of red clover (L.) sprouts cultivated under different conditions by content of isoflavones, calorimetric study and molecular modelling[J]. Food Chem,2018,245:324-336.
[3] KOLODZIEJCZYK-CZEPAS J. Trifolium species-derived substances and extracts - biological activity and prospects for medicinal applications[J]. J Ethnopharmacol,2012,143(1):14-23.
[4] BLAKESMITH S J, LYONS-WALL P M, GEORGE C, et al. Effects of supplementation with purified red clover () isoflavones on plasma lipids and insulin resistance in healthy premenopausal women[J]. Br J Nutr,2003,89(4):467-474.
[5] ATKINSON C, COMPSTON J E, DAY N E, et al. The effects of phytoestrogen isoflavones on bone density in women:a double- blind, randomized, placebo-controlled trial[J]. Am J Clin Nutr, 2004,79(2):326-333.
[6] KANADYS W, BARANSKA A, JEDRYCH M, et al. Effects of red clover () isoflavones on the lipid profile of perimenopausal and postmenopausal women - a systematic review and meta-analysis[J]. Maturitas,2020,132:7-16.
[7] 李松滨,杨丽珍,李宝龙.红车轴草异黄酮对围绝经期大鼠卵巢功能的影响[J].中医药学报,2009,37(2):18-20.
[8] RUIZ-GARCIA A, BERMEJO M, MOSS A, et al. Pharmacokinetics in drug discovery[J]. J Pharm Sci,2008,97(2):654-690.
[9] HE X, SONG Z J, JIANG C P, et al. Absorption properties of luteolin and apigenin in Genkwa Flos using in situ single-pass intestinal perfusion system in the rat[J]. Am J Chin Med,2017, 45(8):1745-1759.
[10] ZAKERI-MILANI P, VALIZADEH H, TAJERZADEH H, et al. Predicting human intestinal permeability using single-pass intestinal perfusion in rat[J]. J Pharm Pharm Sci,2007,10(3):368-379.
[11] 许敏,姜壮壮,陶丽,等.中药渗透性规律及其评价研究进展[J].中草药,2019,50(14):3477-3483.
[12] 许永崧,韩晓凤,龚慕辛,等.单向在体肠灌流在中药研究中的应用[J].中国实验方剂学杂志,2016,22(1):211-218.
[13] 朱亮,尹丽娜,梁泽华,等.在体低速单向灌流模型考察Hup-A的肠吸收部位[J].中华中医药学刊,2015,33(11):2721-2724.
[14] LI H, DONG L, LIU Y, et al. Comparison of two approaches of intestinal absorption by puerarin[J]. J Pharmacol Toxicol Methods,2014,70(1):6-11.
[15] ZAKERI-MILANI P, BARZEGAR-JALALI M, AZIMI M, et al. Biopharmaceutical classification of drugs using intrinsic dissolution rate (IDR) and rat intestinal permeability[J]. Eur J Pharm Biopharm,2009,73(1):102-106.
[16] ROUGE N, BURI P, DOELKER E. Drug absorption sites in the gastrointestinal tract and dosage forms for site-specific delivery[J]. Int J Pharm,1996,136(1/2):117-139.
[17] LIPINSKI C, LOMBARDO F, DOMINY B, et al. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings[J]. Adv Drug Deliv Rev, 2012,64:4-17.
[18] GAO Y, HE L, KATSUMI H, et al. Improvement of intestinal absorption of water-soluble macromolecules by various polyamines:Intestinal mucosal toxicity and absorption-enhancing mechanism of spermine[J]. Int J Pharm,2008,354(1/2):126-134.
[19] DAHAN A, WEST B T, AMIDON G L. Segmental-dependent membrane permeability along the intestine following oral drug administration:Evaluation of a triple single-pass intestinal perfusion (TSPIP) approach in the rat[J]. Eur J Pharm Sci,2009, 36(2/3):320-329.
[20] 王子禹,刘洋,张鑫,等.基于抗炎活性的葛根芩连片整体的中药生物药剂学分类系统研究[J].中国中药杂志,2019,44(17):3662-3671.
Study on Intestinal Permeability of Isoflavones inL. Based onSingle Pass Intestinal Perfusion Model
LUO Liyu1, WU Hongwei2, ZHAO Haiyu2, GAO Wenyuan1
To study the isoflavone intestinal absorption components and intestinal permeability of water extracts ofL.; To explore the corresponding mechanism.An ultra-performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) method was adopted. A quantitative analysis method for the isoflavone components of isoflavoues daidzein, daidzin, genistein, mullein isoflavone glucoside, formononetin, ononin in the intestinal perfusate of water extracts ofL. was established. In situ single-pass intestinal perfusion model was used to study the intestinal permeability of the six isoflavones in the water extracts ofL. in different small intestine segments (duodenum, jejunum, and ileum). The intestinal penetration characteristics of formononetin and ononin at different concentrations were studied.The UPLC-MS/MS quantitative analysis method of 6 isoflavones in intestinal perfusate ofL. was established, which met the methodological requirements.The effective permeability coefficient (P) of the components from the water extracts were all greater than 5×10-5cm/s. Of the six isoflavones, the maximum value ofPwas formononetin (P=3.20, duodenum), followed with genistein (P=2.19, jejunum). For the different intestinal segments, thePand absorption rate constant (Ka) of the components were different. Daidzein and formononetin had the maximumPat the duodenum. The other four components had the maximumPat the jejunum. The results indicated that the best effective absorption locations for the isoflavones in the water extracts were the duodenum and jejunum. There was no statistical significance inPand Ka (>0.05) for formononetin and ononin in different concentrations, and the absorption curve was approximately linear. Therefore, the absorption mechanisms of formononetin and ononin were both passive diffusion.This study has preliminarily clarified the intestinal permeability and absorption mechanism of isoflavones in the water extracts ofL. The results could provide a contribution for quality control component screening, formulation development and clinical rational medication.
single-pass intestinal perfusion model; permeability;L.; isoflavones; formononetin; ononin

R284.1;R285.5
A
1005-5304(2020)11-0089-07
10.19879/j.cnki.1005-5304.202003739
高文远,E-mail:pharmgao@tju.edu.cn
(2020-03-28)
(2020-05-19;编辑:陈静)
