不同加工方法乌梅UPLC特征图谱及模式识别研究
2020-11-19李昕王瑞李肖莉张伟欧金梅吴德玲
李昕,王瑞,李肖莉,张伟,欧金梅,吴德玲
不同加工方法乌梅UPLC特征图谱及模式识别研究
李昕1,2,王瑞1,李肖莉1,张伟1,2,欧金梅1,2,吴德玲1,2
1.安徽中医药大学药学院,安徽 合肥 230012;2.中药饮片制造新技术安徽省重点实验室,安徽 合肥 230012
研究不同加工方法(烘干、熏制)乌梅的超高效液相色谱特征图谱,为乌梅质量控制提供参考依据。采用ZORBA×SB-Aq C18色谱柱(3.0 mm×100 mm,1.8 μm),流动相为0.1%甲酸水-甲醇,梯度洗脱,流速0.2 mL/min,检测波长225 nm,柱温30 ℃。采用超高效液相色谱-四极杆飞行时间质谱对共有色谱峰进行归属;结合聚类分析、主成分分析(PCA)和正交偏最小二乘-判别分析(OPLS-DA)进行分类鉴别,寻找差异化合物。建立了不同加工方法乌梅的特征图谱,烘干、熏制乌梅分别得到23、40个共有峰。聚类分析和PCA均能对不同加工方法乌梅进行分类,OPLS-DA筛选出枸橼酸、阿魏酸、咖啡酸、苦杏仁苷4个质量差异控制成分。本研究建立的方法可用于乌梅质量控制及其加工炮制规范研究,并为综合评价乌梅质量提供可靠依据。
乌梅;加工方法;特征图谱;模式识别
乌梅为蔷薇科植物梅Sieb. et Zucc.的干燥近成熟果实加工而成,具有敛肺止咳、涩肠止泻、安蛔止痛、生津止渴功效[1]。乌梅主产于我国四川、福建等地,果实采收后,多通过熏制加工成乌梅。由于熏制时间较长且耗费人力,部分产区采用烘箱低温烘干方式加工,市场称为“生乌梅”。已有研究发现,青梅经熏制加工成乌梅后,其色泽和活性成分与青梅均存在一定差异[2-3]。因此,乌梅的质量评价需考虑不同加工方法的影响。
乌梅富含有机酸及黄酮类、氨基酸、生物碱等多种化合物,具有抗肿瘤、抗炎、抗氧化、抗病毒、降血脂等药理作用[4-6]。2015年版《中华人民共和国药典》以枸橼酸作为乌梅质量控制成分[1],而单一指标成分分析不能从整体上反映其内在品质。中药特征图谱作为一种综合性、可量化的色谱鉴定方法,能较全面地体现中药成分的复杂性和相关性,已用于乌梅的成分分析[7-10]。本试验针对烘干和熏制2种乌梅加工方法,采用超高效液相色谱法(UPLC)建立特征图谱,并结合聚类分析、主成分分析(PCA)和正交偏最小二乘-判别分析(OPLS-DA),寻找其主要差异性成分,旨在更全面评价乌梅药材的品质,为乌梅的质量控制及加工品的质量评价提供依据。
1 仪器与试药
Agilent Technologies1290 InfinityⅡ(含G7120A二元泵系统、G7167B自动进样器、G7114B VWD检测器),美国安捷伦科技有限公司;BSA224S十万分之一电子分析天平,德国赛多利斯;F80型高速多功能粉碎机,浙江省永康市红太阳机电有限公司;SHB-ⅢA循环水式多用真空泵,郑州长城科工贸有限公司;KQ-500DB型数控超声波清洗器,昆山市超声仪器有限公司;SYZ-C型石英自动亚沸高纯水蒸馏器,南京桑力电子设备厂;CT-C-型热风循环烘箱,南京飞翔干燥制冷设备厂。
对照品枸橼酸(批号CFS201702)、奎尼酸(批号CFS201702)、苹果酸(批号CFS201702)、芦丁(批号CFS201702),武汉天植生物技术有限公司;对照品绿原酸(批号MUST-19030620)、龙胆酸(批号MUST-18083005),成都曼斯特生物科技有限公司,纯度≥98.0%;乙腈、甲醇为色谱纯(德国默克公司),甲酸为分析纯(上海苏懿化学试剂有限公司),双蒸水。
样品于2018年4-8月采集,经安徽中医药大学彭华胜教授鉴定为蔷薇科植物梅Sieb.et Zucc.的近成熟果实。S1~S20为烘箱低温烘干,温度60 ℃,时间30 h;X1~X10为松木烟熏,温度80~100 ℃,时间48 h。样品信息见表1。
表1 30批乌梅样品信息
编号加工 方法产地 编号加工 方法产地 编号加工 方法产地 S1烘干贵州荔波 S11烘干湖南郴州 X1熏制贵州荔波 S2烘干四川达州 S12烘干广西百色 X2熏制四川达州 S3烘干四川大邑 S13烘干浙江临安 X3熏制四川大邑 S4烘干四川绵阳 S14烘干广东汕尾 X4熏制四川绵阳 S5烘干福建上杭 S15烘干广东汕尾 X5熏制福建上杭 S6烘干福建上杭 S16烘干安徽宁国 X6熏制福建上杭 S7烘干福建上杭 S17烘干安徽黄山 X7熏制福建上杭 S8烘干四川宝兴 S18烘干广西南宁 X8熏制四川宝兴 S9烘干四川宝兴 S19烘干江苏苏州 X9熏制四川宝兴 S10烘干云南丽江 S20烘干江苏溧水 X10熏制云南丽江
2 方法与结果
2.1 色谱条件
采用ZORBA×SB-Aq C18色谱柱(3.0 mm×100 mm,1.8 μm),流动相为0.1%甲酸水(A)-甲醇(B),梯度洗脱(0~6 min,3%~15%B;6~30 min,15%~40%B;30~42 min,40%~55%B;42~47 min,55%~95%B),流速0.2 mL/min,进样量3 μL,检测波长225 nm,柱温30 ℃。
2.2 质谱条件
Waters Vevo G2-XS Q-TOF MS质谱系统采用电喷雾离子源,负离子扫描模式,毛细管电压2.5 kV,锥孔电压40 V,离子源温度120 ℃,扫描范围m/z 50~1200,扫描时间0.5 s。低能量扫描时碰撞能量为6 eV,高能量扫描时碰撞能量为10~30 eV。
2.3 溶液制备
2.3.1 供试品溶液
取净制后的样品适量,去核,干燥粉碎,过2号筛,取约2.0 g,置于具塞锥形瓶中,加入80%甲醇20 mL,称定质量,超声(功率300 W,频率40 kHz)处理30 min,取出,放冷,再称定质量,用80%甲醇补足减失的质量,摇匀并过滤,滤液用0.22 μm微孔滤膜过滤,即得。
2.3.2 混合对照品溶液
分别精密称取枸橼酸、苹果酸、奎尼酸、龙胆酸、绿原酸、芦丁对照品适量,置于10 mL容量瓶中,加入80%甲醇溶解并定容至刻度,配制成浓度分别为1.003、0.202、0.113、0.116、0.118、0.123 mL/min的混合对照品溶液,摇匀,即得。
2.4 方法学考察
2.4.1 精密度试验
取S2样品,按“2.3.1”项下方法制备,按“2.1”项下色谱条件连续进样6次,以绿原酸作为参照峰,计算各主要共有色谱峰相对保留时间和相对峰面积,结果相对保留时间RSD为0.031%~0.052%,相对峰面积RSD为0.83%~0.91%,表明仪器精密度良好。
2.4.2 稳定性试验
取S2样品,按“2.3.1”项下方法制备,按“2.1”项下色谱条件,分别于0、2、4、8、10、24 h进样测定,以绿原酸作为参照峰,计算各主要共有色谱峰的相对保留时间和相对峰面积,结果相对保留时间RSD为0.077%~0.390%,相对峰面积RSD为1.97%~2.64%,表明供试品溶液在24 h内稳定。
2.4.3 重复性试验
取S2样品,按“2.3.1”项下方法平行制备6份,按“2.1”项下色谱条件进样,以绿原酸为参照峰计算各主要共有色谱峰的相对保留时间和相对峰面积,结果相对保留时间RSD为0.022%~0.058%,相对峰面积RSD为3.33%~3.60%,表明该方法重复性良好。
2.5 特征图谱建立及相似度评价
将30批乌梅样品按“2.3.1”项下方法制备,按“2.1”项下色谱条件测定,将色谱图导入国家药典委员会《中药色谱指纹图谱相似度评价系统》(2012版),得到共有模式。标定烘干乌梅23个共有峰,熏制乌梅40个共有峰,确定1、3、4、6、8~12、14、17~19、21~25、35、38共20个特征峰作为乌梅质量评价指标(见图1)。经与对照品比对,指认出峰1(奎尼酸)、峰4(枸橼酸)、峰6(苹果酸)、峰21(龙胆酸)、峰25(绿原酸)、峰35(芦丁)。

注:A.烘干供试品;B.熏制供试品;C.混合对照品;1.奎尼酸;4.枸橼酸;6.苹果酸;21.龙胆酸;25.绿原酸;35.芦丁
以共有模式为对照特征图谱,对30批乌梅样品的特征图谱进行相似度评价,结果见表2。除S16外,烘干、熏制乌梅样品各自相似度≥0.904,表明其所含化学成分基本一致。烘干与熏制乌梅的相似度为0.469~0.896,表明2种方法加工的乌梅差异较大。
2.6 质谱成分指认
通过对照品比对及质谱离子碎片信息,初步鉴定出26种成分(见表3),14个共有峰包括峰3(延胡索酸)、峰8(5-羟甲基糠醛)、峰9(2-乙酰基呋喃)、峰10(甲基环戊烯醇酮)、峰11(香草酸)、峰12(苯甲酸甲酯)、峰22(苦杏仁苷)、峰24(愈创木酚)等。
表2 30批乌梅样品指纹图谱相似度评价结果
编号相似度 编号相似度 编号相似度 S10.956 S110.950 X10.972 S20.995 S120.968 X20.995 S30.929 S130.957 X30.963 S40.970 S140.981 X40.974 S50.982 S150.986 X50.984 S60.979 S160.884 X60.988 S70.978 S170.904 X70.978 S80.912 S180.978 X80.977 S90.958 S190.921 X90.979 S100.951 S200.924 X100.991
表3 乌梅化学成分质谱鉴定结果
峰号鉴定成分分子式[M-H]-二级质谱(m/z)参考文献 或对照品 理论值实际值误差/ppm 1奎尼酸C7H12O6191.055 6191.055 5-5.23173.008 2,135.043 3,111.007 1对照品 2果糖或葡萄糖C6H12O6179.055 6179.054 1-8.38152.995 4,132.028 5,111.007 1,96.969 7[11] 3延胡索酸C4H4O4115.003 1115.002 8-2.6196.959 6,87.007 4[12] 4枸橼酸C6H8O7191.019 2191.018 7-2.62173.008 2,129.019 8,111.009 2对照品 5琥珀酸C4H6O4117.018 8117.019 55.9896.959 6,87.009 3,78.957 1[12] 6苹果酸C4H6O5133.013 7133.013 1-4.51115.002 8,96.959 6,78.960 8对照品 85-羟甲基糠醛C6H6O3125.023 9125.023 2-5.60111.009 2,96.959 6,78.958 9[13] 92-乙酰基呋喃C6H6O2109.029 0109.028 2-7.3478.958 9,67.015 0[13] 10甲基环戊烯醇酮C6H8O2111.044 6111.043 7-8.1095.959 6[13] 11香草酸C6H8O4167.034 4167.034 40152.009 9,123.045 1,111.009 2,96.961 7,78.958 9[14] 12苯甲酸甲酯C8H7O2134.036 8134.037 01.49103.007 1,78.958 9[15] 132,6-二甲氧基苯酚C8H10O3153.055 2153.056 26.53137.021 8,111.007 1,96.959 6[13] 21龙胆酸C7H6O4153.018 8153.018 2-3.92111.007 1,96.959 6,78.967 1对照品 22苦杏仁苷C20H27NO11456.150 6456.148 6-4.38353.086 7,323.099 3[15] 24愈创木酚C7H8O2123.044 6123.042 9-1.3896.959 6,87.009 3[13] 25绿原酸C16H18O9353.087 3353.086 7-1.70317.051 6,299.045 1,191.055 5,179.034 9,135.045 7,111.007 1对照品 26苯甲酸C7H6O2121.029 0121.028 8-1.6577.018 7[15] 30咖啡酸C9H8O4179.034 4179.034 92.79135.045 7,111.009 2,96.959 6[16] 35芦丁C27H30O16609.145 6609.145 1-8.21301.034 4对照品 36金丝桃苷C21H20O12463.087 7463.088 72.16419.170 4,353.086 7,335.070 2,301.034 4[17] 37异槲皮苷C21H20O12463.108 4463.109 21.73421.187 9,357.120 1,335.077 7,301.034 4,191.018 7,173.008 2[14] 39阿魏酸C10H10O4193.050 1193.049 0-5.70147.030 3,111.009 2[14] 40槲皮苷C21H20O11447.092 7447.095 05.14353.086 7,341.071 2,301.034 4,229.048 4,191.018 7,173.008 2,145.072 9[17] 41牡荆素C21H20O10431.097 8431.097 6-4.64353.086 7,315.087 1,301.069 9,279.233 2,191.018 7,173.008 2[18] 42槲皮素C15H10O7301.034 8301.034 4-1.33279.233 2,273.037 9,229.048 4,191.018 7,173.008 2,151.002 4[17] 43山柰酚C15H10O6285.039 9285.038 3-5.61257.045 5,241.012 2[17]
2.7 聚类分析
将30批乌梅样品特征图谱数据导入SPSS24.0统计软件,运用组间均联法,平方欧氏距离作为样本测度,对不同加工方法乌梅进行聚类分析。结果表明,30批乌梅样品可分成两大类(见图2)。其中,S1~S20烘干乌梅为一类,X1~X10熏制乌梅为一类,与样品信息一致。
2.8 主成分分析
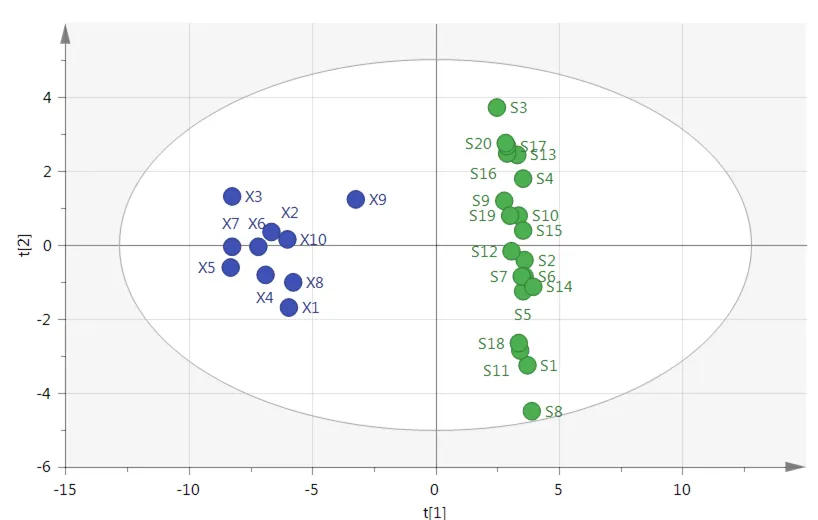
为观察不同加工方法乌梅样品的差异性,采用PCA对30批乌梅样品进行分析。将样品数据导入SIMCA14.1软件,得到4个特征主成分。该模型解释能力参数R2X为0.818,预测能力参数Q2为0.570,表明该模型的区分程度及预测程度较好。4个特征主成分的方差总贡献率为81.84%。通过PCA得分图(见图3)可知,乌梅样品可分为两大类,与聚类分析结果一致。
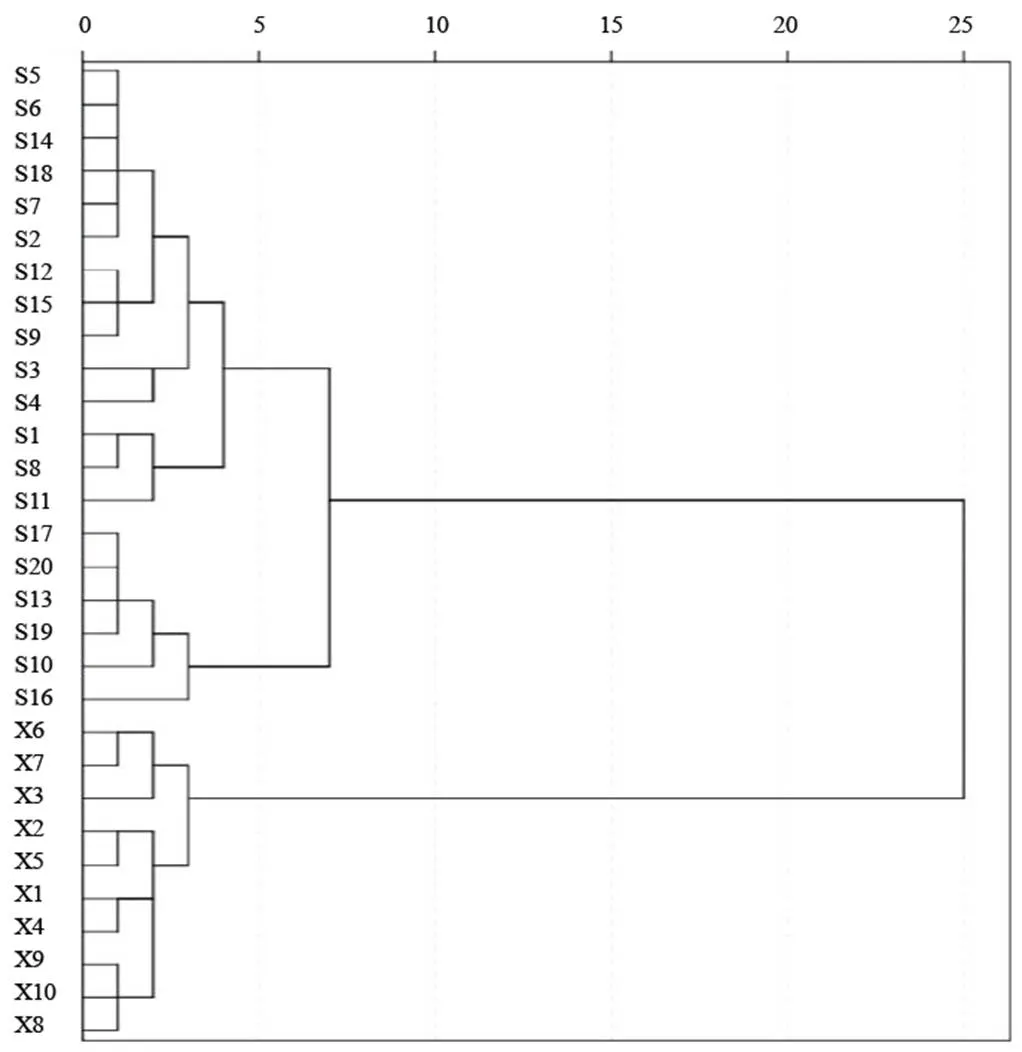
图2 30批乌梅样品聚类分析树状图
2.9 正交偏最小二乘-判别分析
为更好地研究不同加工方法乌梅UPLC特征图谱的差异,建立OPLS-DA模型。该模型解释能力参数R2Y为0.983,预测能力参数Q2为0.972,说明模型的区分程度及预测程度较好。以主成分建立坐标系,由30批样品的OPLS-DA得分图(见图4)可知,烘干乌梅与熏制乌梅可分为两大类,烘干样品较为集中,熏制样品较为分散,表明不同加工方法可导致乌梅化学成分的量发生一定程度变化。
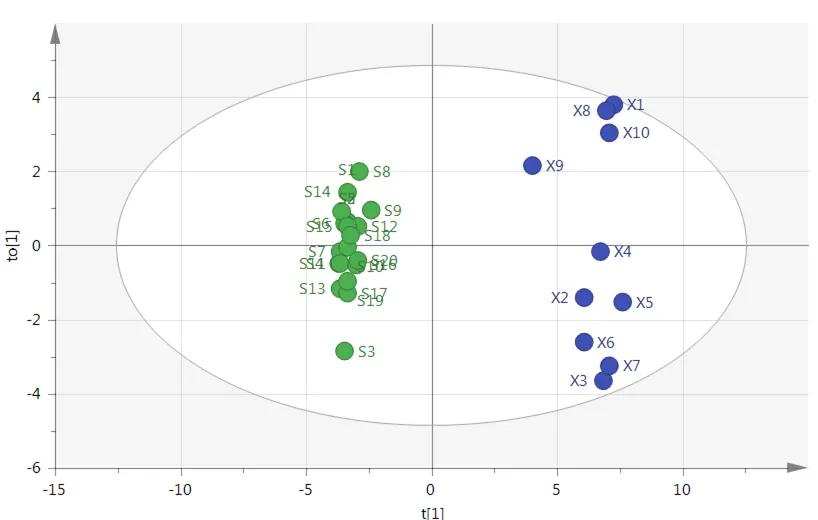
图4 30批乌梅样品OPLS-DA得分图
2.10 差异标志物筛选
根据变量重要性投影(VIP)筛选导致不同加工方法样品差异性的化学成分,VIP值越大表明其对分类的贡献最大,当VIP>1时认为其对分类起到关键性作用,但本研究筛选出的成分较多,且部分成分未鉴定出来,故将VIP值提升至1.22,便于分析。最终筛选出对组间分类贡献较大的4个变量,依次为峰4(枸橼酸)、峰39(阿魏酸)、峰30(咖啡酸)、峰22(苦杏仁苷),见图5。

图5 乌梅样品指纹图谱共有峰差异标志物VIP图
3 讨论
本试验建立了30批烘干和熏制乌梅样品的UPLC特征图谱,标定烘干乌梅23个共有峰,熏制乌梅40个共有峰,通过对照品比对和质谱分析指认了枸橼酸、苹果酸、奎尼酸、龙胆酸、绿原酸、芦丁等14个共有峰成分。20批烘干样品(除S16外)、10批熏制样品各自相似度>0.90,表明同一加工方法的乌梅样品相似度良好,质量稳定。烘干、熏制样品之间相似度存在一定差异,成分差异较大,表明不同加工方法对乌梅的成分有一定影响。
聚类分析、PCA和OPLS-DA结果表明,3种方法均能较好区分烘干乌梅和熏制乌梅。结合OPLS-DA分析筛选出导致2种加工方法乌梅差异性的化合物,其中对分类影响较大的4个成分为枸橼酸、阿魏酸、咖啡酸、苦杏仁苷。枸橼酸为2015年版《中华人民共和国药典》乌梅质量控制成分,本研究在药典基础上增加了3个质量参考成分,有利于从整体反映药材内在质量,可为乌梅加工过程中的质量控制提供有效参考依据。不同加工方法造成的乌梅外观颜色和风味差异与其内在差异性成分的关联尚有待进一步研究。
[1] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:79.
[2] 丁超.乌梅在熏制过程中色泽和风味物质的变化及其应用研究[D].广州:华南理工大学,2012.
[3] 丁超,李汴生.青梅烟熏过程中的色泽变化[J].现代食品科技,2012, 28(1):23-26.
[4] 杨莹菲,胡汉昆,刘萍.乌梅化学成分、临床应用及现代药理研究进展[J].中国药师,2012,15(3):415-417.
[5] 欧金梅,王瑞,程庆兵,等.ICP-MS法测定不同产地乌梅无机元素含量[J].中草药,2020,51(2):482-489.
[6] 张华月,李琦,付晓伶.乌梅化学成分及药理作用研究进展[J].上海中医药杂志,2017,51(1):296-299.
[7] 许腊英,石琪,余倩倩,等.中药乌梅炒炭前后DNA特征图谱的研究[J].中成药,2012,34(1):1-3.
[8] 聂诗明,许腊英,杨昌娟,等.乌梅炭特征图谱研究[J].中国医院药学杂志,2010,30(24):2051-2053.
[9] 叶静,付静,余晗,等.乌梅生品及其炭品的特征图谱比较[J].湖北中医药大学学报,2017,19(6):42-45.
[10] QIAN J, XUE Z, FANG X, et al. Comparative analysis of fingerprint spectra of fruits and leaves ofcollected at various altitudes in different months[J]. Medicinal Plant, 2017,8(4):23-26,31.
[11] 许庆轩,张玉霜,吴玉梅.绵白糖中糖类化合物的电喷雾质谱研究[J].黑龙江大学工程学报,2015,6(3):57-61.
[12] IVANOVA-PETROPULOS V, NACEVA Z, SÁNDOR V, et al. Fast determination of lactic, succinic, malic, tartaric, shikimic, and citric acids in red Vranec wines by CZE-ESI-QTOF-MS[J]. Electrophoresis,2018,39(13):1-21.
[13] 苗志伟,刘玉平,孙宝国.SDE-GC-MS分析乌梅中挥发性成分[J].食品科学,2011,32(24):270-273.
[14] 汪丹,蔡甜,吴志军,等.HPLC-ESI-Q-TOF-MS法分析金钱草颗粒的化学成分[J].中国药房,2016,27(12):1651-1654.
[15] 张伟,王雪,秦建平,等.DART-Q-TOF-MS快速鉴别桂枝茯苓胶囊中6种化学成分[J].中国中药杂志,2014,39(21):4118-4122.
[16] 王恩鹏,陈雪,孙岩,等.GC-MS分析比较人参花水蒸气与超临界CO2提取物及其脂肪酸成分的研究[J].药物分析杂志,2016,36(12):2153- 2162.
[17] 夏玮,古丽加玛丽•阿比斯,潘晨,等.腊梅花中黄酮类化合物的UHPLC/QTOF-MS分析[J].中成药,2014,36(11):2345-2349.
[18] 刘建群,舒积成,张锐,等.新西兰牡荆苷等4种碳苷黄酮的电喷雾质谱裂解规律研究[J].中国实验方剂学杂志,2013,19(8):72-76.
Study on UPLC Fingerprints and Pattern Recognition of Mume Fructus with Different Processing Methods
LI Xin1,2, WANG Rui1, LI Xiaoli1, ZHANG Wei1,2, OU Jinmei1,2, WU Deling1,2
To study the UPLC fingerprints of Mume Fructus with different processing methods(drying and smoking); To provide references for quality control of Mume Fructus.ZORBA×SB-Aq C18 column (3.0 mm × 100 mm, 1.8 μm) was used. The mobile phase was 0.1% formic acid water-methanol, gradient elution; the flow rate was 0.2 mL/min; the detection wavelength was set at 225 nm; the column temperature was set at 30 ℃. UPLC-QTOF-MS was used to identify the main common chromatographic peaks. Combining cluster analysis, PCA and OPLS-DA were used for classification and identification, looking for different compounds.The fingerprints of Mume Fructus with drying and smoking were established, and 23 and 40 common peaks were obtained respectively. Cluster analysis and PCA can better classify Mume Fructus with different processing methods, and OPLS-DA can screen out four quality difference control components: citric acid, ferulic acid, caffeic acid and amygdalin.This method can be used to study the quality control and processing standard of Mume Fructus, and provide a reliable basis for the comprehensive quality evaluation of Mume Fructus.
Mume Fructus; processing methods; fingerprints; pattern recognition

R284.1
A
1005-5304(2020)11-0076-06
10.19879/j.cnki.1005-5304.202003723
中央本级重大增减支项目(2060302-1604-01);新安医学教育部重点实验室开放项目(2018xayx09);安徽高校自然科学研究项目(KJ2019A0479)
欧金梅,E-mail:ojm@ahtcm.edu.cn
(2020-03-27)
(2020-04-15;编辑:陈静)
