耐热黑曲霉3.316产外切葡聚糖苷酶培养基优化及酶学性质研究
2020-11-18张海娟朱凤妹河北科技师范学院食品科技学院河北省果品加工工程技术研究中心河北秦皇岛066600
张海娟,李 军,朱凤妹(河北科技师范学院食品科技学院,河北省果品加工工程技术研究中心,河北秦皇岛 066600)
近年来,利用纤维素酶高效分解植物纤维原料产糖生产燃料乙醇已成为国内外研究的热点[1],但是工业生产菌株产酶活性不高仍然是目前纤维素酶生产和实际应用中存在的难题。因此,选育纤维素高产菌株是纤维素资源的生物转化和拓展纤维素酶应用范围的重要环节。纤维素酶是将纤维素降解为葡萄糖的酶,由内切酶、外切酶和β-葡萄糖苷酶组成。纤维素酶一般由多种水解酶组成,这些水解酶构成了一个复杂的纤维素酶家族[2]。纤维素酶的水解酶一般分为三类:内切葡聚糖酶,又称为 Cx 酶或 CMC 酶,这类酶作用于纤维素分子内部非结晶区,随机地水解β-1,4 糖苷键并产生大量带有非还原末端的小分子纤维;外切葡聚糖酶,也称为Ci酶,这类酶则是作用于纤维素线状分子的末端,水解β-1,4 糖苷键,每次作用都会切下一个纤维二糖分子,所以也被称为纤维二糖水解酶;纤维二糖酶,也称为β-葡萄糖苷酶,将纤维二糖水解成葡萄糖[3-4]。
对于纤维素酶生产菌株的研究,一开始绝大部分集中于纤维素酶系齐全且酶活力较高的木霉如绿色木霉和里氏木霉等菌株上[5],但木霉菌发酵产物中存在多种真菌毒素,有毒性嫌疑;另一方面木霉所产的β-葡萄糖苷酶活力很低,致使纤维二糖在反应体系中积累而影响酶解效率,因而其应用范围受到限制。而黑曲霉不产生毒素,是公认的安全微生物,并且在产纤维素酶的真菌中,黑曲霉所产纤维素酶系中以外切葡聚糖苷酶和β-葡萄糖苷酶的活力较低[6]。我们前期对黑曲霉3.316产β-葡萄糖苷酶进行了较多的研究[7]。黑曲霉3.316产外切葡聚糖苷酶却并未见报道。
对耐热黑曲霉产外切葡聚糖苷酶培养基优化和酶学性质的研究,不仅为纤维素酶的食品应用提供依据,同时为构建高效表达的外切葡聚糖苷酶的基因工程菌提供了参考,还可以为蛋白质工程提供研究的前提,用于研究不同的食品工业化生产和应用需求,此类研究正在进行中[8]。本实验通过单因素和响应面分析对黑曲霉3.316产外切葡聚糖苷酶发酵培养基条件优化及酶学性质测定,旨在提高外切葡聚糖苷酶活力,为进一步研究开发提供理论基础。
1 材料与方法
1.1 材料与仪器
Aspergillusniger3.316 中国微生物菌种保藏中心;小麦秸秆 江苏省连云港市东海县;硫酸铵 天津市风船化学试剂科技有限公司;微晶纤维素 天津市光复精细化工研究所;麦芽糖 天津市科密欧化学试剂有限公司。
FJS-4磁力搅拌水浴锅 金坛市城西富威实验仪器厂;YXQ-LS-50A立式压力蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;TDL-4台式离心机 台北市万方润华实验仪器厂;V-5100可见分光光度计 武汉高精密科学仪器有限公司;HZQ-X100恒温振荡培养箱 苏州培英实验设备有限公司。
1.2 实验方法
1.2.1 培养基的配制 种子培养基:FeSO4·4H2O 0.005 g,KCl 0.25 g,MgSO4·7H2O 0.25 g,K2HPO40.5 g,NaNO31.5 g,蔗糖15 g,pH6.5,蒸馏水500 mL,121 ℃灭菌20 min[9]。
基础发酵培养基:CaCl20.15 g,MgSO40.15 g,K2HPO41.0 g,(NH4)2SO42.0 g,麸皮 15 g,蒸馏水 500 mL,pH5.5,121 ℃灭菌20 min[10]。
1.2.2 酶活力的测定 酶活的测定方法参照李永博等[11]的方法:在具塞比色试管中加入1 mL粗酶液(通过基础发酵培养基进行发酵制得),再加入1%微晶纤维素柠檬酸缓冲液2 mL,置于50 ℃水浴锅中反应1 h后加入1.5 mL DNS终止反应,混匀后,沸水浴煮沸5 min,取出,冰浴冷却至室温,用去离子水定容至25 mL,在540 nm的波长下测定其吸光值。
酶活力的定义:以1 mL粗酶液1 min水解底物产生1 mg葡萄糖的酶量定义为1个酶活力单位。
计算公式[12]:
式中:IU:酶活力,U/mL;M:还原糖含量,mg;t:反应时间,min;D:稀释倍数;Ew:粗酶液体积,mL;0.18:1 μmol葡萄糖的质量,mg
1.2.3 单因素实验
1.2.3.1 碳源的筛选 参照马腾[10]的方法,在基础发酵培养基其他成分不变情况下,改变碳源,分别以麸皮+玉米粉(1∶1),玉米纤维,麸皮+玉米纤维(1∶1),麸皮+葡萄糖(1∶1),玉米芯,麸皮,葡萄糖,小麦秸秆,麸皮+小麦秸秆(1∶1),玉米秸秆粉,麸皮+玉米秸秆粉(1∶1)为碳源,研究浓度在15 g/500 mL下不同的碳源组成发酵培养基对黑曲霉产外切葡聚糖苷酶的影响。
1.2.3.2 小麦秸秆浓度的筛选 参照马腾[10]的方法,分别以10、12.5、15、17.5、20 g/500 mL小麦秸秆浓度为发酵培养基的碳源浓度,研究不同小麦秸秆浓度的发酵培养基对黑曲霉产外切葡聚糖苷酶的影响。
1.2.3.3 氮源的筛选 参照马腾[10]的方法,以酵母浸粉、硫酸铵、蛋白胨、氯化铵、尿素、硫酸铵+尿素(1∶1)、硫酸铵+酵母浸粉(1∶1)、硫酸铵+蛋白胨(1∶1)做为氮源,在其他成分不变的情况下,以不添加氮源为空白组,研究2 g/500 mL浓度下不同氮源的发酵培养基对黑曲霉产外切葡聚糖苷酶的影响。
1.2.3.4 氮源浓度的筛选 参照马腾[10]的方法,分别以1.5、1.75、2、2.25、2.5 g/500 mL硫酸铵浓度为发酵培养基的氮源浓度,研究不同硫酸铵浓度的发酵培养基对黑曲霉产外切葡聚糖苷酶的影响。
1.2.3.5 诱导物的筛选 参照马腾[10]的方法,分别以微晶纤维素、羧甲基纤维素钠、水杨苷、乳糖、麦芽糖、羧甲基纤维素钠+麦芽糖(1∶1)、微晶纤维素+羧甲基纤维素钠(1∶1)、羧甲基纤维素钠+乳糖(1∶1)、微晶纤维素+麦芽糖(1∶1)、微晶纤维素+乳糖(1∶1)、微晶纤维素+水杨苷(1∶1)为诱导物,研究0.5 g/500 mL浓度下不同的诱导物对发酵培养基的影响。
1.2.3.6 诱导物浓度的筛选 参照马腾[10]的方法,分别以0.5、1.0、1.5、2.0、2.5 g/500 mL微晶纤维素+麦芽糖浓度为发酵培养基的诱导物浓度,研究不同微晶纤维素+麦芽糖浓度对发酵培养基的影响。
1.2.4 发酵培养基组分的响应面优化试验设计 选取小麦秸秆浓度(A)、硫酸铵浓度(B)、微晶纤维素+麦芽糖浓度(C)为响应面的三个单因素变量,建立以外切葡聚糖苷酶活力(Y)为响应值的多元性回归模型方程。利用Design-Expert 8.0进行响应面试验设计和分析[13-14],试验因素与水平见表1。
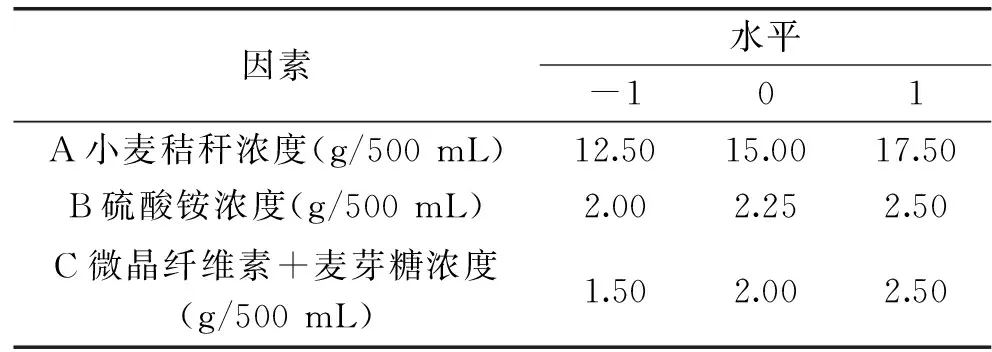
表1 Box-Behnken试验因素及其水平Table 1 Levels of variables tested in Box-Benhnken design
1.2.5 酶学性质的测定
1.2.5.1 最适温度、热稳定性的测定 将pH5.5的粗酶液1 mL分别在30、40、50、60、70 ℃的水浴锅中保温30 min[11]后,测定外切葡聚糖苷酶的酶活力。
另一组试验将粗酶液在30、40、50、60、70 ℃的水浴锅中保温1 h时间后,测定其剩余酶活力,研究温度对酶热稳定性的影响[15]。
1.2.5.2 最适pH、不同pH稳定性的测定 将1 mL粗酶液在不同pH和温度50 ℃下反应30 min后,测定其酶活。另一组试验将粗酶液在50 ℃条件下保温1 h时间后,测定其原相对酶活力,测定pH对酶稳定性的影响[16]。
1.2.5.3 不同金属离子对酶分解纤维素能力的影响 本试验选取几种常见金属离子[17],对照组和样品组在相同环境下试验,以对照组为最高酶活(100%),其余为相对酶活力。以将1 mL粗酶液,分别加入0.5 mL不同金属离子(KCl、NaCl、MnSO4、MgSO4、FeSO4、CuSO4、对照)溶液以及0.5 mL去离子水为对照组,保温1 h后测定其相对酶活。以不添加金属离子为试验组,保温1 h后测定其酶活力。
1.2.5.4 不同浓度的盐溶液对酶活力的影响 将1 mL粗酶液和0.5 mL浓度为2、4、6、8、10、12 g/L的NaCl盐溶液,在水浴锅中反应30 min后,测定其粗酶活。以NaCl浓度为0 g/L的酶活力为100%。得出不同浓度的盐溶液相对酶活力影响。
1.2.5.5 不同浓度的表面活性剂对酶活力的影响 将1 mL粗酶液和0.5 mL不同表面活性剂吐温-80的浓度,反应30 min后,测定其粗酶活[16]。
1.3 数据处理
采用Microsoft Excel 2010表格绘图、SPSS 21软件、Duncan氏多重比较、Canoco for Windows 4.5、Design-Expert 8.0进行响应面实验设计和分析。在但因素试验的基础上,采用Design-Expert 8.0响应面实验设计和分析数据结果,试验进行测定三次平行去平均值。
2 结果与分析
2.1 单因素实验结果
2.1.1 碳源的确定 选取单一物质和混合物质为碳源,图1结果表明小麦秸秆是黑曲霉产外切葡聚糖苷酶最适合的碳源,这可能是由于小麦秸秆作为天然的碳源,其含有较多的矿物成分和纤维素,当利用小麦秸秆作为碳源时,其诱导了黑曲霉分泌纤维素酶[18]。通过试验得出小麦秸秆相较于其他实验碳源表现极显著(P<0.01)。另外小麦秸秆作为一种普遍、价廉的农业副产物,也满足了工业上对廉价碳源的要求。
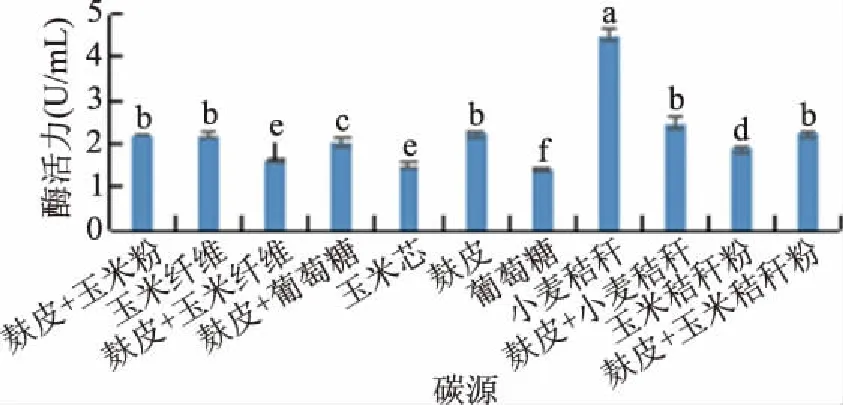
图1 不同碳源种类对酶活力的影响Fig.1 Effects of different carbon sources on enzyme activity注:不同小写字母代表不同处理间P<0.01水平下的极显著性差异;图2~图6同。
2.1.2 小麦秸秆浓度的确定 图2结果表明,外切葡聚糖苷酶在浓度10~15 g/500 mL时,酶活力先下降后上升,但是在15~20 g/500 mL时,酶活力下降。小麦秸秆中含有丰富的纤维,当纤维素达到一定量时,能够促进微生物生长加速产酶,但是纤维素含量太高,反而抑制微生物的生长,从而抑制产酶量[19],另外小麦秸秆的添加量太多,会影响微生物的通氧量,致使微生物不能呼吸而影响产酶结果。综上所述,选择15 g/500 mL为最适浓度并以此为响应面试验中心点。
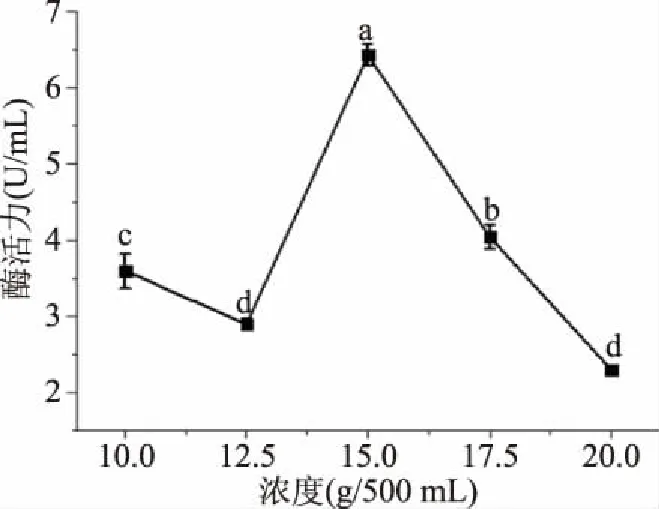
图2 不同浓度小麦秸秆对酶活力的影响Fig.2 Effect of different concentrations of wheat straw on enzyme activity
2.1.3 氮源的确定 常见的氮源种类有有机氮源和无机氮源。图3结果表明硫酸铵是使得外切葡聚糖苷酶最适合的氮源。通过试验得出硫酸铵相较于其他实验氮源表现极显著(P<0.01)。虽然硫酸铵+尿素、硫酸铵作为氮源使得酶活力增大,硫酸铵+尿素使得酶活力达到13.418 U/mL,但是氮源为硫酸铵时,酶活力达到14.195 U/mL,所以硫酸铵使得酶活力最大,最终确定选用硫酸铵为最终氮源。
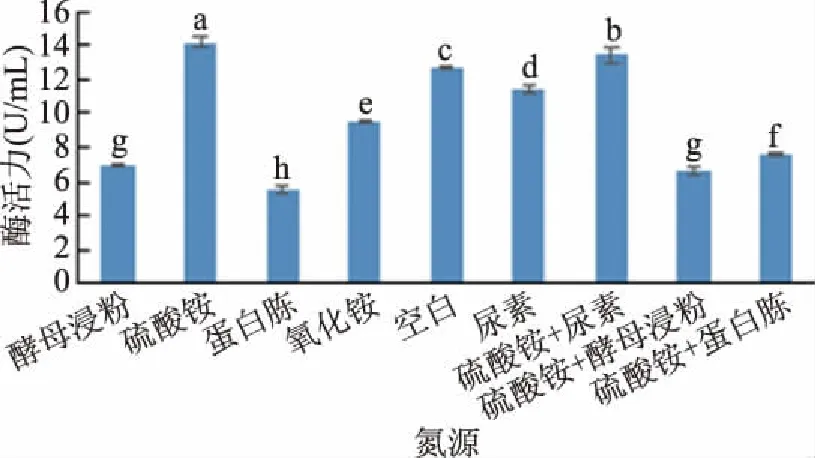
图3 不同氮源种类对酶活力的影响Fig.3 Effect of different nitrogen sources on enzyme activity
2.1.4 硫酸铵浓度的确定 图4结果表明,外切葡聚糖苷酶在1.5~2.25 g/500 mL范围内先增后减,至2.25 g/500 mL浓度达到最大,2.25~2.5 g/500 mL范围内降低;氮源微生物生长必不可少的物质之一,若硫酸铵含量过多,会不利于蛋白质和氨基酸的合成,对菌体细胞物质有伤害[20]。综上所述,2.25 g/500 mL为最适浓度并以此为响应面试验中心点。
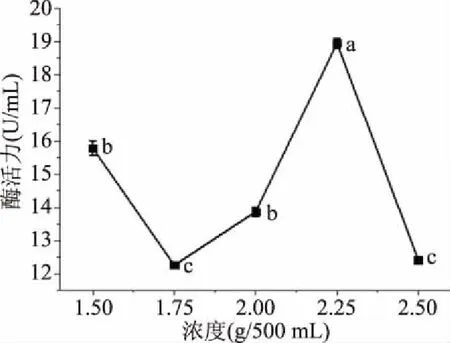
图4 不同浓度氮源对酶活力的影响Fig.4 Effect of nitrogen sources at different concentrations on enzyme activity
2.1.5 诱导物的确定 单一诱导物和混合诱导物能够影响黑曲霉分泌结合蛋白,从而影响转录基因的表达,激发特定酶的合成[21]。选用不同的诱导物加入黑曲霉培养基中,观察黑曲霉培养产纤维素能力,试验结果见图5。利用微晶纤维素做诱导物对黑曲霉分泌外切葡聚糖苷酶影响极显著(P<0.01),但是利用微晶纤维素+麦芽糖作为诱导物时,黑曲霉分泌外切葡聚糖苷酶显著升高(P<0.01),达到12.543 U/mL,确定微晶纤维素+确定麦芽糖作为诱导物。
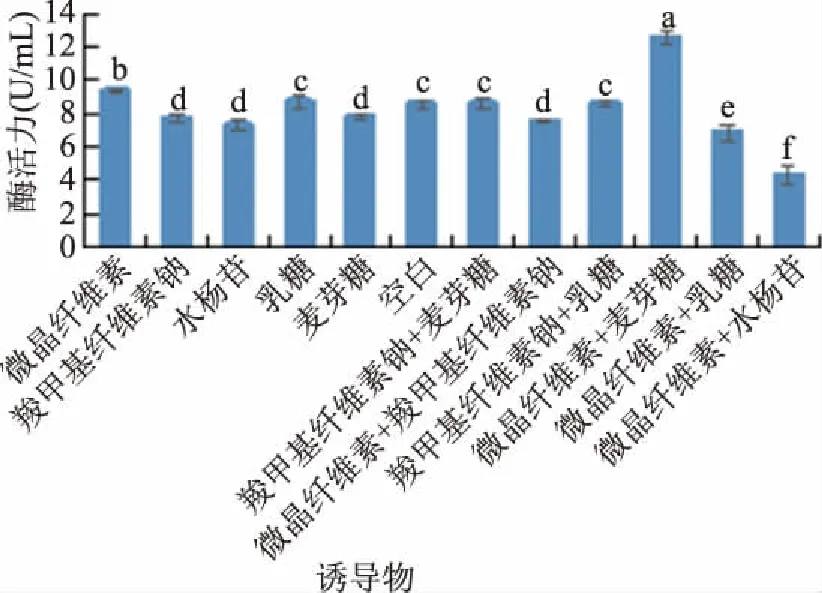
图5 不同诱导物对酶活力的影响Fig.5 Effect of different induced species on enzyme activity
2.1.6 微晶纤维素+麦芽糖浓度的确定 图6结果表明,利用微晶纤维素+麦芽糖作为诱导物,黑曲霉分泌外切葡聚糖苷酶在0.5~1 g/500 mL微上升,1~2 g/mL范围内先下降后上升,在2.0~2.5 g/500 mL范围内下降;当微晶纤维素+麦芽糖浓度在2 g/500 mL时,黑曲霉分泌外切葡聚糖苷酶活力最高。这可能是由于微晶纤维素+麦芽糖作为诱导物,在低浓度时,降低黑曲霉内的结合蛋白的形成,无法使基因正常表达。当微晶纤维素+麦芽糖浓度较高时,其诱导作用在菌体内占主导,因此菌体分泌外切葡聚糖苷酶活力较高。综上所述,2.0 g/500 mL为最适浓度并以此为响应面试验中心点。
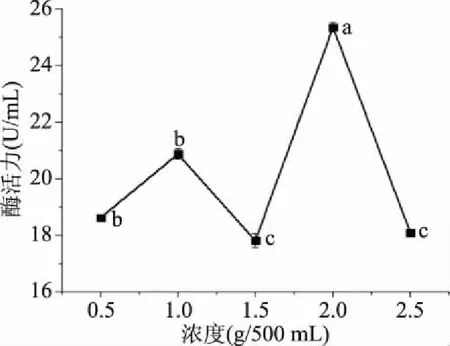
图6 不同浓度诱导物对酶活力的影响Fig.6 Effect of different concentrations of inducers on enzyme activity
2.2 中心组合试验结果及响应面分析
试验设计与结果见表2,以Y(外切葡聚糖苷酶的酶活力)为响应值的情况下,用CCD(Central Composite Design)程序进行多元回归分析,获得Y(外切葡聚糖苷酶活力)对A(小麦秸秆浓度)、B(硫酸铵浓度)、C(微晶纤维素+麦芽糖浓度)的三元二次回归方程:Y=2.11-0.031A-8.875E-003B+0.063C+0.020AB-4.250E-003AC-0.049BC-0.16A2-0.12B2-0.098C2。回归模型和方差分析见表3。
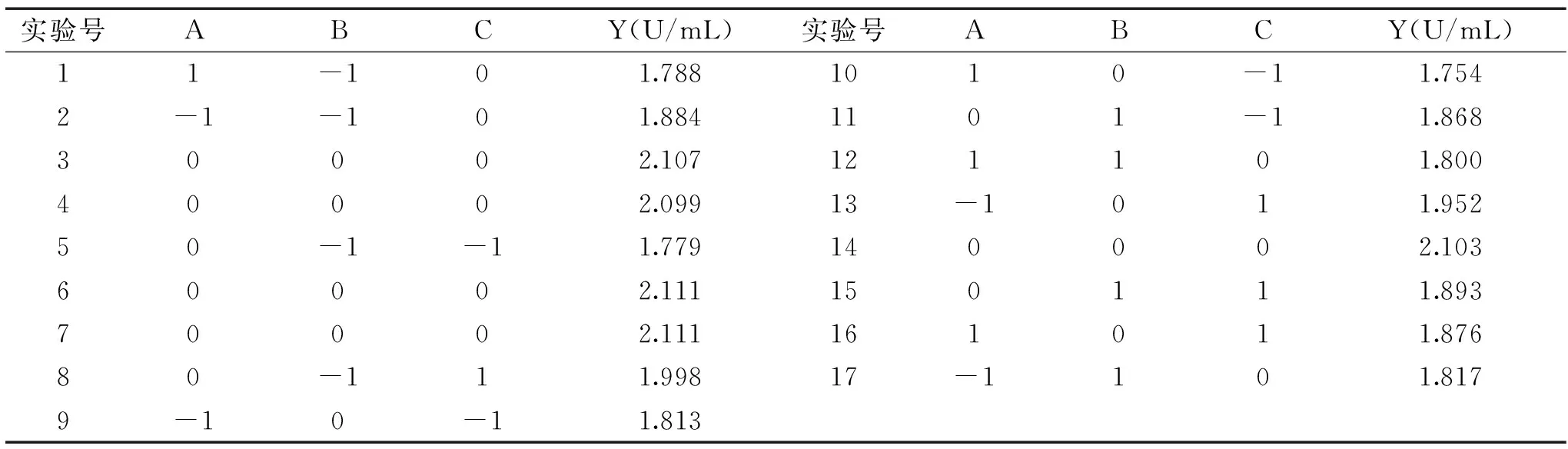
表2 中心组合设计及结果Table 2 Experimental matrix and results with CCD
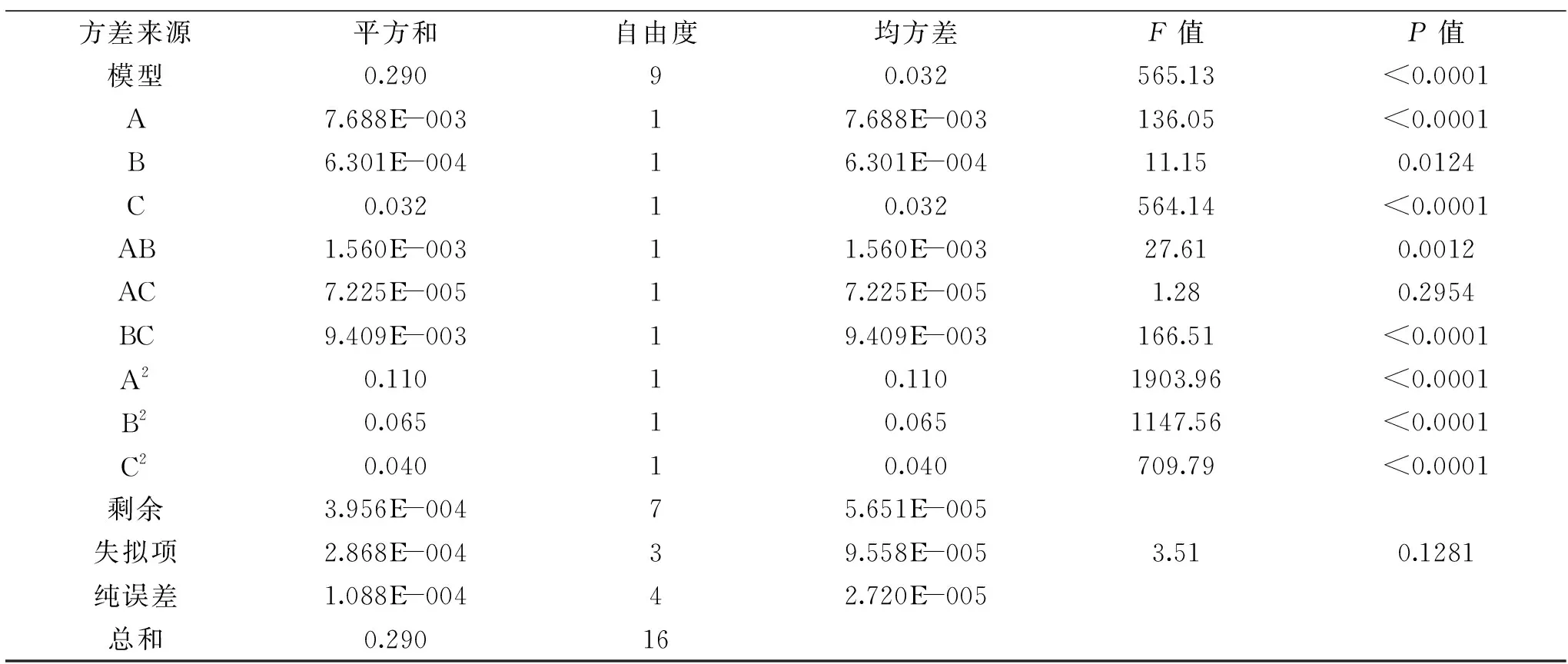
表3 中心组合设计回归模型及方差Table 3 CCD regression models and ANOVA
2.3 响应因子的水平优化
响应面图和等高线图如图7所示,通过三者的两两交互作用确定出最优点[22]。图中等高线反应交互作用的强弱,圆形表示不显著,椭圆形表示显著[23]。根据方差分析结果及各因素间响应面立体分析图,小麦秸秆浓度(A)、微晶纤维素+麦芽糖浓度(C)对发酵产酶影响极显著(P<0.01),硫酸铵浓度(B)影响显著(P<0.05);同时,小麦秸秆浓度与硫酸铵浓度交互作用(图7a)、小麦秸秆浓度与微晶纤维素+麦芽糖浓度交互作用影响不显著(图7b);硫酸铵浓度与微晶纤维素浓度+麦芽糖浓度交互作用影响极显著(图7c),硫酸铵浓度与微晶纤维素+麦芽糖浓度之间,当硫酸铵浓度一定时,外切葡聚糖苷酶的酶活力随微晶纤维素+麦芽糖浓度的增加呈先升高后降低的趋势。
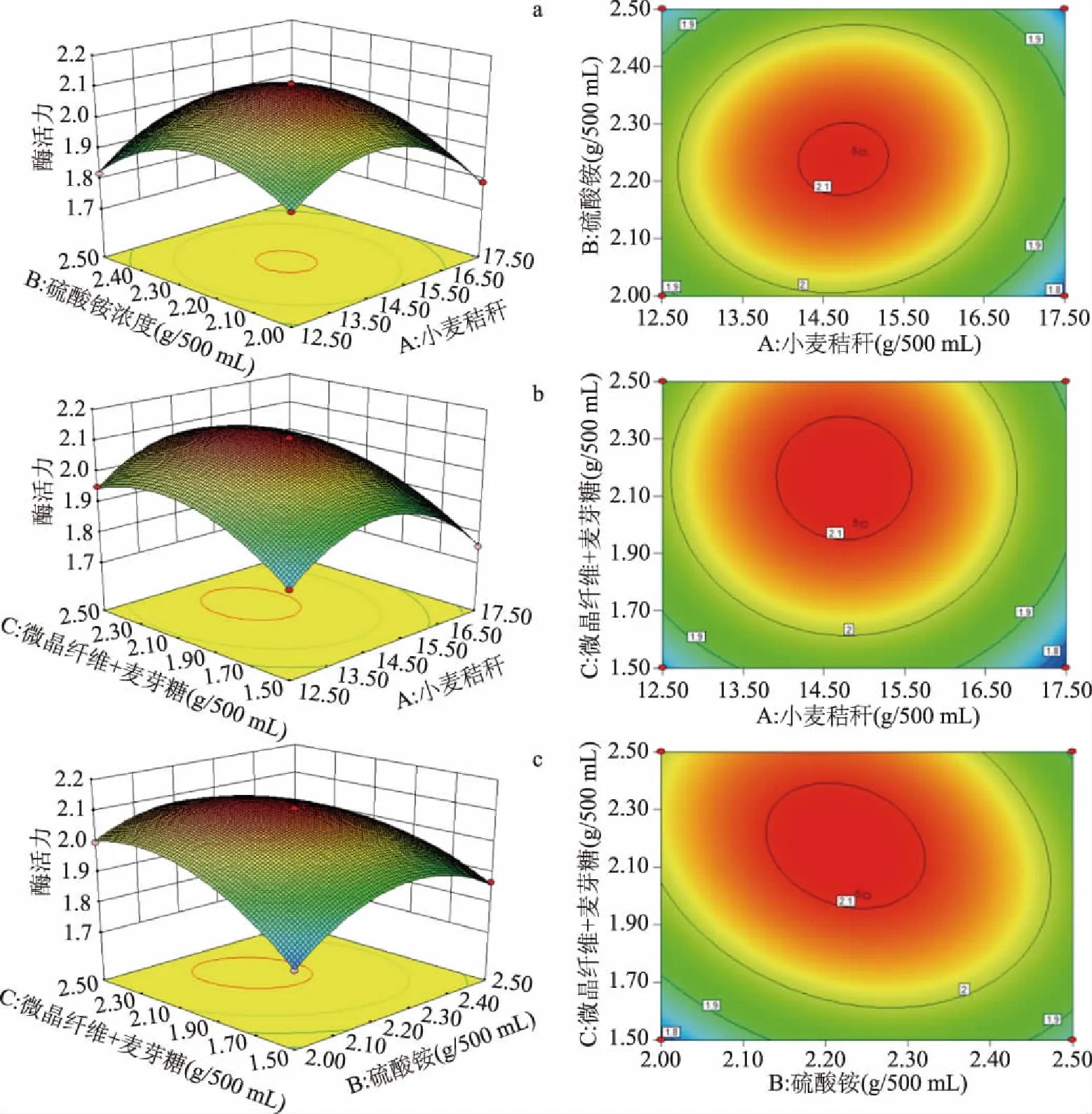
图7 外切葡聚糖苷酶响应面图和等高线图Fig.7 Exoglycosidase response surface map and contour map
根据含有小麦秸秆浓度14.73 g/500 mL,硫酸铵浓度2.22 g/500 mL,微晶纤维素+麦芽糖浓度2.18 g/500 mL,CaCl20.15 g/500 mL,MgSO40.15 g/500 mL,K2HPO41.0 g/500 mL的发酵培养基,分5组进行发酵验证。外切葡聚糖苷酶酶活力为2.120 U/mL,与模型预测的酶活力2.138U/mL的误差值<3%。表明该模型能够很好的预测外切葡聚糖苷酶的发酵情况。
最优培养基只影响外切葡聚糖苷酶活力的高低,所以接下来进一步研究外切葡聚糖苷酶的酶学性质。
2.4 酶学性质
2.4.1 外切葡聚糖苷酶最适温度的测定 当作用时间、pH不变时,在不同温度下,在恒温水浴锅中反应30 min后,得出如图8。外切葡聚糖苷酶在50 ℃时,酶活最大,50 ℃以后,酶活下降趋势明显,由此说明,温度对内切葡聚糖苷酶活力影响较大,最适温度为50 ℃。
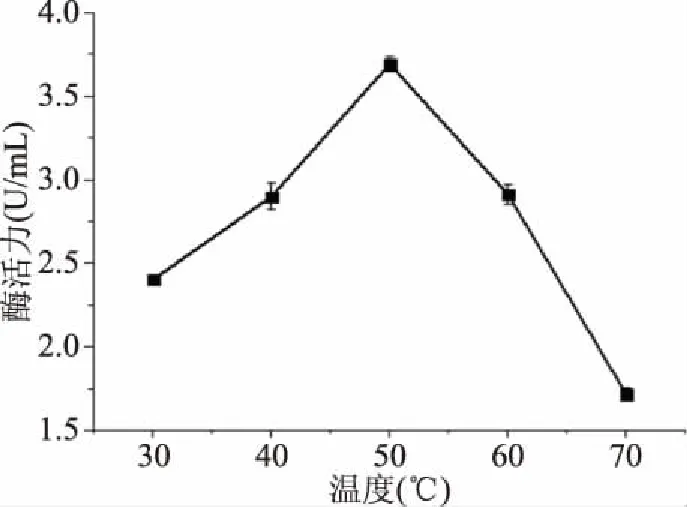
图8 外切葡聚糖苷酶最适温度Fig.8 Optimum tempera of exoglycosidase
2.4.2 外切葡聚糖苷酶的热稳定性 粗酶溶液在30、40、50、60和70 ℃的水浴中温浴60 min,并测定相对酶活力,以保温前酶活力为100%[24],得出曲线如图9所示。由图9可以看出,对于外切葡聚糖苷酶来说,当温度从30~50 ℃时,热稳定性呈上升趋势,并在50 ℃时达到最高,但并未达到100%,50~70 ℃时,稳定性急速下降,酶正在慢慢失活,表现出很差的热稳定性。研究结果说明外切葡聚糖苷酶适合在较高温环境中发挥作用,并且稳定性较强。
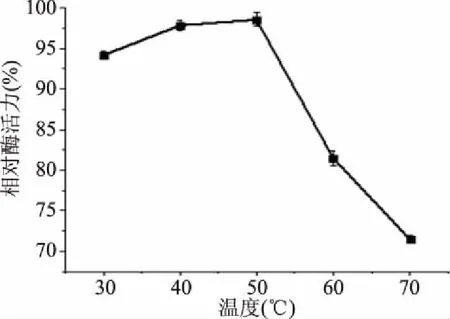
图9 外切葡聚糖苷酶热稳定性Fig.9 Thermal stability of exoglycosidase
2.4.3 外切葡聚糖苷酶最适pH的测定 通过实验分别测定了在pH为1~8下的酶活,得出图10所示曲线。由图10可知,外切葡聚糖苷酶pH在1~6时,该曲线是呈上升趋势。当pH为6时,酶的活性达到最大值。当pH>6,该曲线出现下降趋势,酶活力逐渐减小。所以,外切葡聚糖苷酶的最适pH为6。

图10 外切葡聚糖苷酶最适pHFig.10 Optimum pH of exoglycosidase
2.4.4 外切葡聚糖苷酶在不同pH下的稳定性 图11说明对于外切葡聚糖苷酶来说,当pH为1~3期间,稳定性呈上升趋势,较稳定;当pH为3~4时,稳定性逐渐下降,相对酶活力下降到原酶活的60%左右;当pH在4~6时,稳定性逐步上升,较稳定;pH在6~7期间,稳定性逐渐上升;pH在7~8时,稳定性逐渐下降。所以外切葡聚糖苷酶属于在耐酸性环境中稳定性较强的一种酶。
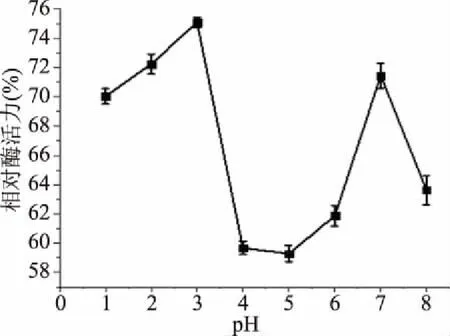
图11 不同pH下外切葡聚糖苷酶的稳定性Fig.11 Effect of different pH on stability of exoglycosidase
2.4.5 不同金属离子对外切葡聚糖苷酶活力的影响 金属离子会对外切葡聚糖苷酶有不同程度的影响[25]。通过与对照组的对比,FeSO4、MnSO4、CuSO4等均具有显著性,但是由外切葡聚糖苷酶中可看出,Mn2+、Fe2+、Cu2+对该酶的酶活力有激活作用,其中Fe2+的促进作用最为明显,FeSO4极显著(P<0.01);Mn2+、Cu2+对该酶的促进作用较小,MnSO4、CuSO4较显著(P<0.05);Mg2+、K+、Na+对该酶的酶活力表现出抑制作用。
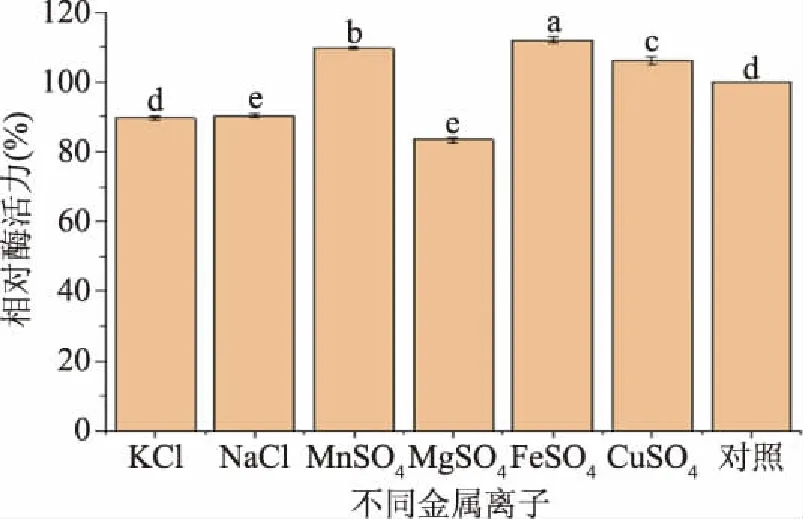
图12 不同金属离子对外切葡聚糖苷酶活力影响Fig.12 Effects of different metal ions on activity of exoglycosidase
2.4.6 不同浓度的NaCl盐溶液对外切葡聚糖苷酶活力的影响 由图13可知,对于外切葡聚糖苷酶来说,当NaCl的盐溶液中的浓度是2~6 g/L,相对酶活性正在上升,促进了酶的活性。当NaCl的盐溶液中的浓度达到6 g/L时,相对酶活力达到最大值,当NaCl的盐溶液中的浓度为6 g/L后,相对酶活性呈下降趋势。当NaCl浓度达到12 g/L,开始抑制酶活性。
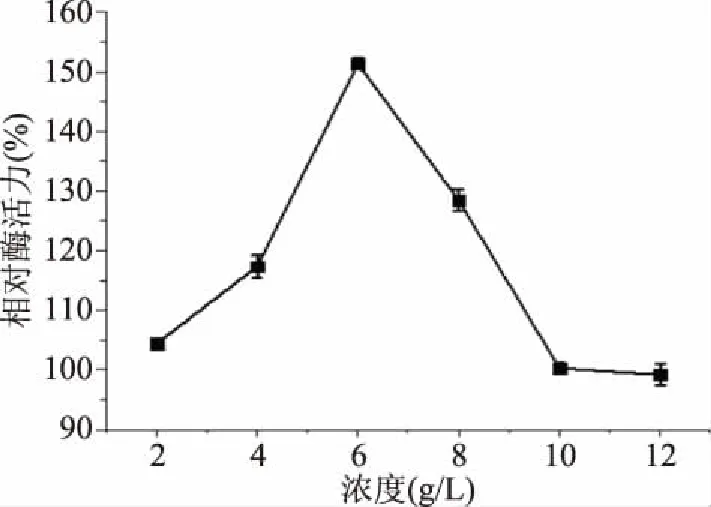
图13 不同盐浓度对外切葡聚糖苷酶活力的影响Fig.13 Effect of different salt concentration on exoglycosidase activities
2.4.7 不同浓度的表面活性剂对外切葡聚糖苷酶活力的影响 使用浓度分别为0.1%、0.2%、0.3%、0.4%、0.5%的吐温-80,在同样环境、不同质量浓度的表面活性剂条件下,以不加表面活性剂处理但其他保存条件相同的粗酶液的酶活做对照得出,该酶具有较高的表面活性剂耐受性。即设定吐温-80浓度为0%的实验组的酶活力为100%,测定其他浓度下的相对酶活[26]。由图14可知,当表面活性剂浓度为0~0.3%时,相对酶活性增加,并且当表面活性剂浓度达到0.3%,相对酶活性达到最大值为114%;当表面活性剂浓度为0.3%~0.4%时,相对酶活性降低,并且当表面活性剂浓度达到0.4%时,相对酶活性达到最小;当表面活性剂是浓度达到0.4%后,相对酶活性又开始上升。说明表面活性剂促进了外切葡聚糖苷酶的活性。外切葡聚糖苷酶可以将原料的细胞膜破坏,释放大量的蛋白质等碳水化合物,提高出汁率,纤维素酶将原料降解后产生能提供发酵作用的葡萄糖,具有应用发酵生产的潜力[27]。
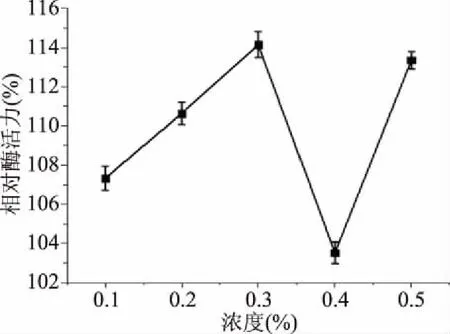
图14 表面活性剂浓度对外切葡聚糖苷酶活力的影响Fig.14 Effect of surfactant concentration on activity of exoglycosidase
3 结论
本研究通过利用单因素和响应面法对黑曲霉3.316产外切葡聚糖苷酶的发酵培养基条件进行优化[28],优化的培养基使得该菌株产的外切葡聚糖苷酶酶活力强,性能优良优化。耐热黑曲霉3.316产外切葡聚糖苷酶结果表明:优化后的培养基组成为小麦秸秆14.73 g/500 mL,硫酸铵2.22 g/500 mL,微晶纤维素+麦芽糖2.18 g/500 mL,CaCl20.15 g/500 mL,MgSO40.15 g/500 mL,K2HPO41.0 g/500 mL且对于酶学性质进行测定:外切葡聚糖苷酶在高温耐热环境中生存,同时Fe2+有促进作用,表面活性剂对外切葡聚糖苷酶也有促进作用,在高效生产燃料乙醇下,外切葡聚糖苷酶在降解过程中发挥作用。研究试验可能存在当酶活力达到一定时,分解产生的高浓度葡萄糖可能对产酶量下降。未来可在调控蛋白基因方面进行深度研究[29]。
