免疫性肝损伤过程中CYP2C19体内外活力测定的方法学建立
2020-11-18李晓霞刘凤婷薛永志
李晓霞,刘凤婷,王 涛,林 琴,薛永志
(包头医学院药物代谢与肝脏分子药理研究所,药理学教研室,内蒙古 包头 014060)
CYP2C19细胞色素P450同工酶属于家族2,亚家族C,多肽19,主要在肝脏中表达,但在小肠中可发现较低水平的酶。占肝脏CYP总含量的6.8%,是主要的6种CYP之一[1]。CYP2C19参与质子泵抑制剂的代谢,因此可影响胃酸反流治疗,溃疡预防和幽门螺杆菌的根除治疗[2-3]。CYP2C19酶在氯吡格雷的两个生物激活步骤中也起着至关重要的作用,从而导致重大心血管不良事件的风险降低或更高[1];它影响抗抑郁药治疗和美沙酮替代疗法以及伏立康唑的抗真菌作用[1,4-5];CYP2C19代谢他莫昔芬影响乳腺癌患者的预后[1,6-7]。因此,CYP2C19对治疗结果影响最大的5个医学领域是肠胃病学、心脏病学、精神病学、真菌学和肿瘤学[1-7]。以往对CYP2C19的研究多基于其基因多态性,而在炎症及免疫应激方面对代谢活力影响的研究甚少。我们在此基础上,主要研究在免疫性肝损伤过程中[8-10],CYP2C19的活力变化及代谢情况。因此,急需要建立体内和体外CYP2C19活力的检测方法,来评估伴有炎症和免疫刺激等情况下,代谢酶活性变化对上述5个医学领域治疗方案的影响,调整剂量和药疗方案,减少药物不良反应和不必要的药物相互作用,提高治疗效果,做到个体化精准治疗。
1 材料
1.1 主要实验仪器Waters高效液相系统(1525泵, 2996-二极管阵列紫外可见检测器,美国)、TGL-16C型离心机和TGL-20bR低温高速离心机由上海安亭科学仪器厂提供、日本岛津AUW120D型分析天平、上海本昂科学仪器有限公司NBI-24W型氮气吹干仪、姜堰市新康医疗有限公司XK96-A型快速混匀器、上海赛默飞世尔仪器有限公司MuLtiskan FC型酶标仪,OptimaL-80XPULtracentrifuge低温超高速离心机和3111型CO2培养箱、北京欣凯隆生物科技有限公司XHF-D型内切式匀浆机。
1.2 主要实验试剂奥美拉唑钠标准物质(含量:95.2%,批号:100760-201504)、BCG冻干粉(60 mg/支,批号:2016-01),由中国食品药品检定研究院提供;奥美拉唑钠注射液(批号:20180727G2),从常州四药制药有限公司购买;奥美拉唑镁肠溶片(批号:1912015),购自阿斯利康制药有限公司;武汉博士德生物工程有限公司提供BCA蛋白定量试剂盒(批号:12C17B46);NADPH再生系统(批号:20180906),从北京汇智泰康医药技术有限公司购买。无水甲醇(色谱纯,批号:20191023),天津市大茂化学试剂厂提供;其它实验试剂为国产分析纯。
1.3 动物♂SD清洁级大鼠,(180~220) g,购自内蒙古大学动物实验中心,动物许可证号SCXK(蒙)2005-0001;♂昆明种清洁级小鼠,(18~22) g,从斯贝福北京生物技术有限公司引进,动物许可证号SCXK(京)2019-0010。
2 方法
2.1 HPLC方法学建立
2.1.1色谱条件 C18高效液相色谱柱 (4.6 mm×250 mm,5 μm);流动相:甲醇 ∶水=50 ∶50(体内实验)或甲醇 ∶0.01 mol·L-1K2HPO4= 60 ∶40(体外肝微粒体实验);流速设置为1 mL ·min-1;进样量25 μL。OME对照品及代谢物5'-OHOME紫外检测波长分别为304 nm和262 nm,柱温30 ℃。
2.1.2标准曲线、线性范围和检出限 用天平称取OME对照品5 mg加甲醇溶解配成500 mg·L-1的贮备液,置于4 ℃冰箱避光保存。吸取OME贮备液0.2 mL,并用甲醇稀释为梯度浓度为0.25、0.5、1、2、5、10、20、30 mg·L-1的溶液,然后加入3 mL乙酸乙酯进行萃取,3 500 r·min-1离心10 min,分离上清置于玻璃试管中用氮气吹干仪将其吹干,用300 μL流动相复溶,然后进行HPLC分析。用测得的样品峰面积 (Y)对浓度(X)进行线性回归,回归方程为:Y=114 013X-239 51(R2=0.999 4,n=6),在0.25~40 mg·L-1浓度范围内线性关系良好,最低检测限为0.05 mg·L-1,可用于后续实验。
2.1.3日内/日间精密度(RSD)和回收率 利用10、20 mg·L-1高低2种浓度和各5个样品测定的结果计算日内RSD;日间RSD也采用上述两种浓度和样品数在不同的5 d测定结果计算,详见Tab 1。

Tab 1 OME intra-day differences,inter-day differences and recovery
2.2 实验动物分组及免疫性肝损伤模型的制备♂ SD大鼠适应性饲养并正常自由进水进食。采用单次静脉注射BCG (125 mg·kg-1)复制免疫性肝损伤模型,Control组静脉注射等体积的生理盐水。实验d 14,将上述大鼠各分为两组,一组尾静脉注射奥美拉唑钠(5 mg·kg-1),另外一组灌胃奥美拉唑镁肠溶片(50 mg·kg-1)。在给药后分别按照不同时间点(静脉注射2、5、8、15、20、30和120 min;灌胃0.5、0.75、1、1.5、2、3和4 h)进行眼内眦静脉丛取血,之后采用HPLC法测定CYP2C19在体内的代谢活性。
♂昆明种小鼠称体质量、标号,按随机数列表分为Control、BCG组。采用单次静脉注射BCG (125 mg·kg-1)复制免疫性肝损伤模型,Control组静脉注射相同体积的生理盐水。实验d 14颈椎脱臼法处死小鼠,门静脉灌流法冲洗肝脏,迅速取出小鼠肝脏,提取肝微粒体,HPLC法测定CYP2C19体外代谢活性。
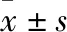
3 结果
3.1 免疫性肝损伤对大鼠奥美拉唑在体内代谢活性的影响
3.1.1体内代谢的药时曲线考察 大鼠尾静脉注射奥美拉唑钠5 mg·kg-1或灌胃奥美拉唑镁肠溶片50 mg·kg-1后,用内径1 mm的细玻璃管于给药后从大鼠眼内眦静脉丛取血0.2 mL于肝素化试管中,取血点分别是2、5、8、15、20、30、120 min(注射)或30、45、60、90、120、180、240 min(灌胃)。血样经3 500 r·min-1离心10 min,分离血浆。精确吸取血浆200 μL于离心管中,加入乙酸乙酯3 mL涡旋震荡5 min,3 500 r·min-1离心10 min进行萃取。分离上清置于玻璃试管中,40 ℃氮气吹干,300 μL流动相复溶,涡旋混匀过滤后进样,供HPLC分析检测。BCG免疫性肝损伤导致探针药物OME在灌胃给药后5、8、15、20、30 min血药浓度明显高于Control(P<0.05),表明CYP2C19代谢活力降低,见Fig 1。与上述结果相似,BCG免疫性肝损伤导致探针药物OME在注射给药后60、90、120、180 min血药浓度明显高于Control(P<0.05),表明CYP2C19代谢活力降低,见Fig 2。
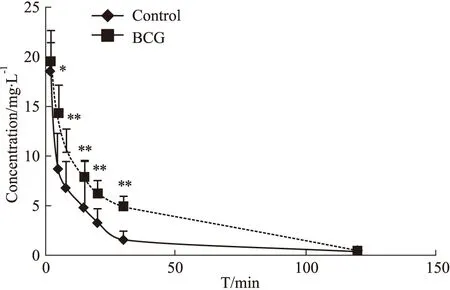
Fig 1 Effect of immune liver injury on blood concentration of OME in *P<0.05,**P<0.01 vs control
Fig 2 Effect of immune liver injury on blood concentration of OME in *P<0.05,**P<0.01 vs control
3.1.2体内代谢的药物代谢动力学参数考察 将大鼠体内血药浓度的经时变化代入DAS 3.0药代动力学分析软件进行分析,经计算机拟合,大鼠体内奥美拉唑代谢符合二房室模型。药代动力学参数见Tab 2和Tab 3,两种给药途径的药代动力学参数出现相似的结果。BCG免疫性肝损伤组大鼠血浆消除半衰期(T1/2)延长,清除率(CL)减慢,曲线下面积(AUC(0-t))明显增大,与Control比较差异具有显著性(P<0.05),而消除速率常数(Ke)和表观分布容积(V)则无显著变化。表明BCG组大鼠CYP2C19代谢活力降低。

Tab 2 Pharmacokinetic parameters of intravenous injection of OME in rats
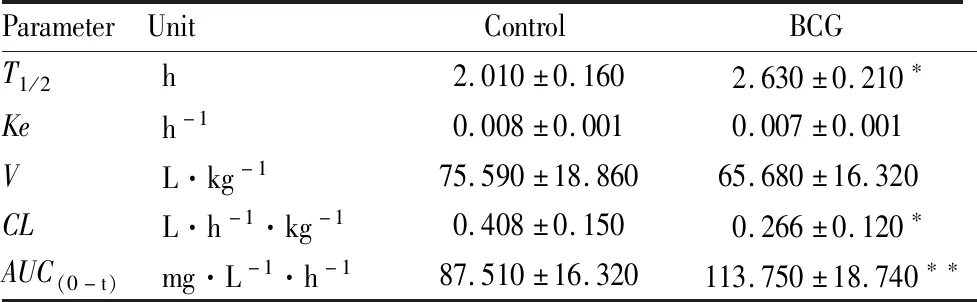
Tab 3 Pharmacokinetic parameters of oral OME in rats
3.2 HPLC法测定CYP2C19在体外的代谢活性
3.2.1小鼠肝微粒体的制备方法及其体外方法学建立 实验小鼠禁食12 h,自由饮水,实验当日将其麻醉后,采用冰冷生理盐水门静脉灌流,冲洗肝脏,使其呈土黄色。取适量肝组织于玻璃试管中,加入25%磷酸盐缓冲液(pH 7.4),内切式匀浆机3 500 r·min-1,0.2 min制备肝组织匀浆液。
3.2.1.1 差速离心法分离小鼠肝微粒体 4 ℃,10 000 r·min-1离心20 min肝匀浆液,分离并保留上清。上清再置于超高速离心机4 ℃,100 000 r·min-1离心1 h。用25%磷酸盐缓冲液中重悬离心后的粉红色微粒体沉淀物,贮存于-80 ℃冰箱备用。
3.2.1.2 钙沉淀法分离小鼠肝微粒体 将肝脏匀浆液在低温高速离心机4 ℃,12 000 r·min-1离心20 min,保留上清。按照10 ∶1的比例于上清中加入CaCl2溶液(88 mmol·L-1),充分混匀后,15 000 r·min-1离心30 min,弃上清,沉淀物中再适量加入25%磷酸盐缓冲液,15 000 r·min-1再次离心30 min。丢弃上清后所得。加入25%磷酸盐缓冲液适量,重悬上述粉红色肝微粒体沉淀物,置于-80 ℃冰箱储存备用。
3.2.1.3 BCA法测定小鼠肝微粒体的蛋白质浓度 按照蛋白样本 ∶生理盐水=1 ∶30的配比将其稀释到适宜浓度,进行标准品溶液的配制。把标准品溶液以及稀释好的蛋白样本适量逐个加入96孔板中,再加入200 μL BCA工作液,充分混匀后,把96孔板放在CO2培养箱中37 ℃孵育30 min。把冷却到室温后的酶标板置于酶标仪内测定其在562 nm处的吸光度。把测得标准品溶液(Y)浓度对吸光度值(X)做线性回归方程,得标准品溶液的标准曲线回归方程:Y=0.000 2X+0.199 6,R2=0.997 3。
3.2.1.4 构建小鼠肝微粒体孵育体系 孵育体系总体积为200 L,由肝微粒体、Tris-盐酸缓冲液,NADPH 1 mmol·L-1、探针药物OME组成。适量浓度体积的肝微粒体中分别加入不同质量浓度的OME和Tris-盐酸缓冲液,先在37 ℃的CO2培养箱中预孵育5 min,然后加入NADPH(A液 ∶B液=5 ∶1)启动催化反应,30 min后加入3倍体积的乙酸乙酯终止反应。旋涡5 min, 8 000 r·min-1离心10 min,把置于玻璃试管中的上清液40 ℃氮气吹干,用300 L流动相复溶,HPLC进样对CYP2C19体外代谢活性进行测定。OME的终质量浓度分别为400、500 mg·L-1。
3.2.1.5 不同微粒体浓度对OME代谢影响 以15 mg·L-1的OME加入孵育系统,观察不同微粒体浓度对代谢率的影响,结果见Fig 3。根据数据,认为15 mg·L-1的底物浓度,0.7 g·L-1的微粒体浓度的孵育体系最为合适。

Fig 3 Effects of different microsome concentrations on OME metabolism
3.2.1.6 不同底物浓度对OME代谢影响 见Fig 4。根据上图数据,选择孵育体系中加入0.7 g·L-1的微粒体,进行不同底物浓度对代谢影响的实验,结果显示,10~20 mg·L-1的底物浓度处于曲线的中间部分,适合做后续实验。
3.2.1.7 不同孵育时间对OME代谢的影响 按着上述实验结果,选择0.7 g·L-1的微粒体15 mg·L-1的底物浓度加入孵育体系,观察不同的孵育时间对代谢率的影响。结果显示,孵育20 min最合适。见Fig 5。
3.2.1.8 差速离心法和钙沉淀法制备微粒体代谢率的比较 见Fig 3,经统计学检验,各个微粒体浓度下,两种方法的代谢率相似,没有显著性差异。相对于差速离心法,钙沉淀法更加便捷,不需要超高速低温离心机,可做大样本的实验。见Fig 6。
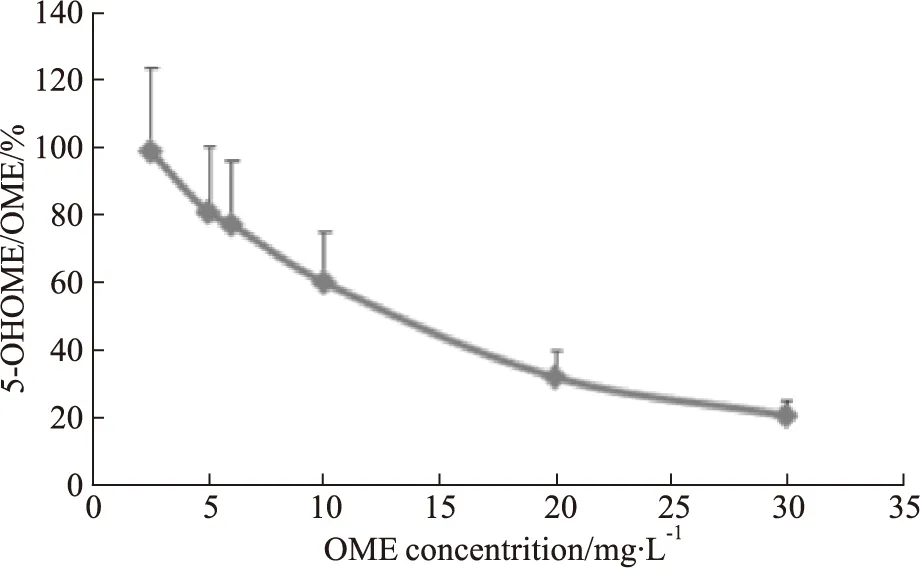
Fig 4 Effect of different substrate concentrations on OME metabolism

Fig 5 Effect of different incubation time on OME metabolism
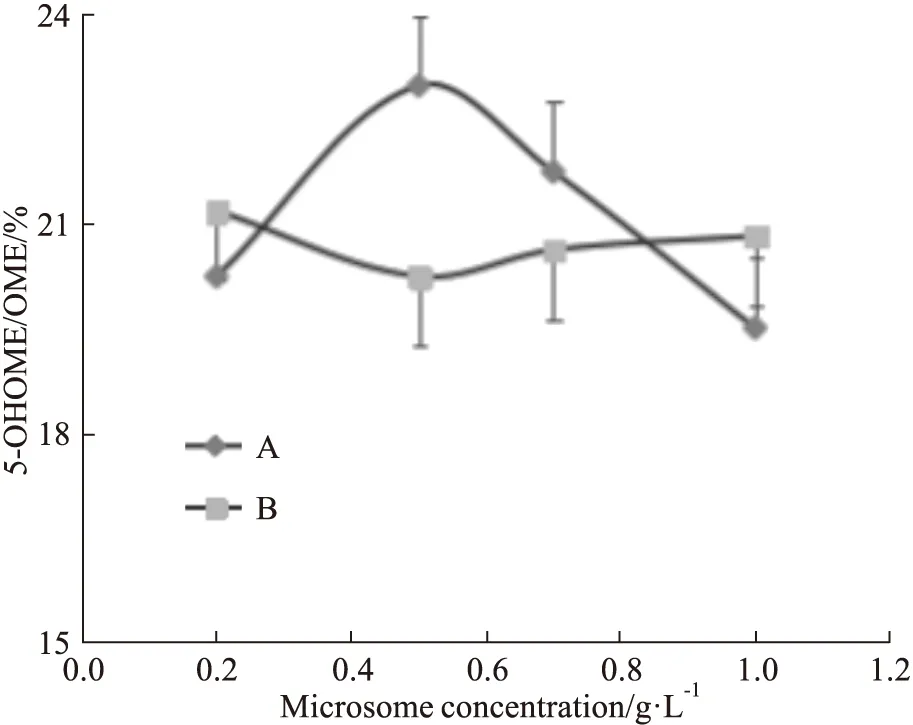
Fig 6 Comparison of metabolic rate between two microsome preparation methods
3.2.2BCG诱导免疫性肝损伤对CYP2C19体外代谢活力的影响 结果如Fig 7,以5-OHOME生成率描述代谢率,反映CYP2C19体外代谢活力。与对照组比较,BCG组OME代谢活力明显降低,差异具有显著性(P<0.05)。表明CYP2C19代谢活力下降。在400、500 mg·L-1两个浓度都得到了相同的结论。应用Michaelis-Menten方程和Eadie-Hofstee制图法,计算米氏常数Km和最大反应速度Vmax。Control组Vm值为82.9 nmol·min-1·mg protein,Km值为50.1 μmol·L-1;BCG组Vm值为38.6 nmol·min-1·mg protein,Km值为18.2 μmol·L-1),表明BCG组大鼠底物亲和力降低(Km),酶促反应速度减慢(Km)。
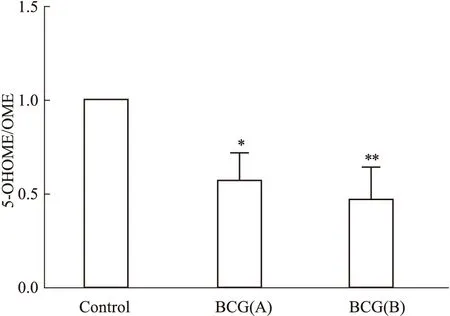
Fig 7 Effect of BCG immune liver injury on metabolic rate of *P<0.05,**P<0.01 vs control
4 讨论
本研究建立了以OME为探针药物,从而考察CYP2C19在体内、体外代谢活性的研究方法。通过尾静脉及灌胃给药后,检测血浆中OME及其代谢物5'-OHOME的血浆药物浓度经时变化曲线。另外将OME经肝微粒体孵育体系后,检测其与5-OHOME的生成、代谢速率,以此来反映CYP2C19在体外的活性变化。经过本实验系统地研究,体内CYP2C19代谢采用静脉注射大鼠模型,相对于口服给药,数据相对准确,影响因素小。而口服给药可能受到过多的吸收效率的个体差异的影响,数据变动范围较大。体外肝微粒体孵育系统实验可以更好地判断肝脏药物代谢酶的代谢活力,而体内实验是肝脏和其它还有CYP2C19代谢酶亚型的器官代谢活力的总和。体外实验还证实,钙沉淀法较沿用了多年的差速离心法更加方便,数据也较稳定,适合检测肝脏微粒体代谢活力。分析其原因可能是CYP2C19位于线粒体和内质网的内膜上,细胞破碎的程度决定酶提取的多少,内切式匀浆机定转速和时间可实现每个样本均一的破碎程度,微粒体蛋白定量的准确性进一步保证了数据的准确性,钙沉淀法完全可以高效、简便和大样本的进行肝脏微粒体实验,避免了超高速冷冻离心机的限制。孵育体系条件的精准性也是实验成功的决定因素。孵育时间、底物浓度和微粒体的浓度都进行了系统地实验,摸索出了合适的条件。
作为6种主要的CYP450家族中重要的一个亚族,CYP2C19活性除了受基因多态性影响,细菌、病毒等感染造成的免疫性肝损伤亦明显影响其活性,进而可影响机体对药物的暴露程度,产生药物不良反应或药物相互作用,影响个体化用药药疗方案的制定[1]。CYP2C19参与的药物代谢有[1-7]:质子泵抑制剂埃索美拉唑、兰索拉唑、奥美拉唑、托拉唑、雷贝拉唑;抗抑郁药阿米替林;抗血小板药氯吡格雷;5-羟色胺再摄取抑制剂类抗焦虑药西酞普兰、依他普仑;三环抗抑郁药氯米帕明和丙咪嗪;抗焦虑药氧异安定、地西泮;止痛药美沙酮;抗真菌药伏立康唑;抗雌激素他莫昔芬;抗病毒奈非那韦。BCG诱导的免疫性肝损伤过程中[8-10],CYP2C19代谢活力下调,可影响上述多种药物的代谢,从而影响肠胃病学、心脏病学、精神病学、真菌学和肿瘤学5大医疗领域的药物治疗。根据本研究,在免疫性肝损伤过程中,可合理调整上述5大领域的药疗方案,做到精准治疗,个体化治疗。
