鸡矢藤环烯醚萜苷抑制NO-CGMP/PKG信号保护新生大鼠神经元
2020-11-18胡才彪秦志强周兰兰
王 坤,胡才彪,章 成,秦志强,周兰兰
(1.安徽医科大学药理学教研室,安徽 合肥 230032;2. 深圳职业技术学院医护学院,广东 深圳 518055)
疼痛(pain)一直困扰着人类,一氧化氮/环磷酸鸟苷/蛋白激酶G(NO/cGMP/PKG)是体内参与痛觉中枢传递作用的重要蛋白通路[1], NO/cGMP/PKG通路的激活能使抑制剂受体磷酸化(如γ-氨基丁酸)而降低其疼痛抑制作用,脊髓兴奋性氨基酸释放增加导致继发性痛觉过敏,同时促进胞内Ca2+浓度升高,继而引发一系列胞内过程。不同来源以及不同氧化还原状态的一氧化氮(nitric oxide,NO)可能具有神经元保护或者损害作用,而过量NO可能通过各种机制导致细胞和组织损伤[2-3]。研究发现,iNOS和nNOS活性神经元主要位于L3-L5脊髓段的背角侧和中央管周围[4]。nNOS在脊髓内表达上调受iNOS调节,可能是维持小鼠慢性周围神经病理性疼痛的重要因素[5]。我们前期结果及其他研究均表明,cGMP依赖的蛋白激酶PKGI在伤害性感受链的发育及脊髓痛觉过敏机制中是发挥cGMP功能作用的关键调节因子[6-7]。鞘内注射NOS抑制剂(例如L-NAME和L-NMMA)抑制NO合成,或直接敲除NO或抑制cGMP合成,均可减少神经性疼痛的伤害感受行为[5,8]。
鸡矢藤环烯醚萜苷(iridiod glycosides from Paederia scandens,IGPS)是从茜草科植物鸡矢藤中提取的一类有效活性成分,主要有效成分包括鸡矢藤苷、鸡矢藤次苷、车叶草苷等。IGPS是GRA公认安全的具有有效治疗作用的植物成分之一[9]。课题组前期研究结果显示,IGPS在小鼠福尔马林试验、扭体试验、坐骨神经结扎模型等均显示良好镇痛活性,且无成瘾性[6,10]。本文采用NO供体硝普钠(sodium nitroprusside,SNP)诱导的背根神经节神经元伤害模型,进一步研究IGPS抑制NO-CGMP/PKG信号、保护新生大鼠神经元的作用。另外,为排除直接在离体培养细胞加中药提取物的可能影响,本研究采用了在药理学中经有效验证的血清药理学方法制备IGPS含药血清。
1 材料与方法
1.1 药品与试剂IGPS由安徽医科大学药理学教研室提供,棕黄色粉末,临用时用蒸馏水配制,批号151120。SNP(431451,Sigma 公司);兔抗鼠神经元特异性烯醇化酶(NSE,BA0535,BOTER 公司);Bradford蛋白浓度测定试剂盒、NO含量和NOS活性测定试剂盒均购自南京建城生物工程研究所;cGMP试剂盒购自上海中医药大学核试验室;Revert AidTMFirst Strand cDNA synehesis Kit (00033699,Fermentas公司);PCR MasterMix (17304,北京天根公司);Fluo-3,AM(F026,DOJINDO Laboratories)。
1.2 动物♂SD大鼠,体质量200±20 g,购于安徽医科大学实验动物中心(合格证号:皖医实动准字第 01 号)。实验前给予动物至少3 d适应周期。于温度(22~24)℃、相对湿度(60±5)%,及12 ∶12 h明暗循环条件下饲养。
1.3 新生大鼠背根神经节神经元纯化、培养及神经元特异性烯醇化酶免疫组化鉴定无菌条件下取新生大鼠脊神经节, Collagenase-Dispase在37 ℃ CO2培养箱消化,加入MEM-F12培养基,培养皿提前用多聚赖氨酸和层粘连蛋白包被处理,离心得到单细胞悬液以1×108个·L-1密度接种于培养皿,37 ℃、5% CO2条件下培养1周。取出培养板,用2%多聚甲醛(含0.3% Triton X-100)室温固定30 min,加1 ∶100 NSE,加1 ∶200生物素化山羊抗兔IgG。使用DAB显色试剂盒,依次经梯度浓度乙醇脱水、透明、封片,于倒置显微镜下随机选取5个视野,同一视野下计数染色的阳性细胞与总细胞数量之比,即为神经元细胞纯度。
1.4 IGPS含药血清制备♂SD大鼠40只,饲养3 d后随机分组:正常对照组,IGPS(70、140、280 mg·kg-1)组,灌胃给药,连续3 d,每日2次。最后1次灌胃1 h后于大鼠腹主动脉采血,4 ℃静置过夜,2 000 r·min-1离心25 min,取上层血清,0.22 μm 微孔滤膜滤过除菌,56 ℃水浴灭活,-20 ℃条件下冻存备用。
1.5 SNP致DRG神经元损伤模型制备、MTT法测定细胞活力及IGPS含药血清的处理DRG细胞培养72 h,随机分为正常对照组、模型组和IGPS含药血清组(280、140、70 mg·kg-1)。模型组及用药组均用200 μmol·L-1SNP溶液灌注预处理30 min,然后各药物组加入由正常细胞培养基1 ∶8稀释的IGPS含药血清100 μL。并设置调零组(只加培养基和药物且不含DRG细胞)和阴性对照组(培养孔内含DRG细胞的同时加入培养基和空白血清),每个浓度设置5个复孔,所有组别DRG细胞处理后分别继续培养24 h。各实验孔内加入MTT(终浓度 0.5 g·L-1), 置于培养箱37 ℃、5% CO2孵育 4 h,加入DMSO(150 μL/孔),酶标仪于570 nm波长处测定各孔吸光度(A 值)。
1.6 DRG神经元cGMP/PKG信号通路指标测定
1.6.1NO和cGMP含量测定、iNOS活性测定 新生大鼠DRG神经元培养 72 h,建立SNP模型及用含药血清处理后,提取总蛋白,使用Bradford蛋白浓度测定试剂盒测定蛋白质浓度。采用分光光度计法测定NO含量和iNOS活性,具体操作步骤按试剂盒说明书进行。采用放射免疫法测定cGMP含量,数据由Gamma放射免疫测定仪(UstcZonkia GC-1500)记录。
1.6.2RT-PCR测定iNOSmRNA,PKGIAαmRNA和PKGIβmRNA 使用TRIzol试剂从培养DRG细胞提取总RNA及纯度鉴定,引物设计如下表所示:

GenePrimerSequence(5'-3')BasepairiNOSForwardAGAGAAGGGCGCGTTGTGGTAGTT506bpReverseTGTCAGATGGCAAGGGTTCAGGTGPKGIαForwardCTTCTTCGCCAACCTG369bpReverseGGCAAACGCTTCTACCAPKGIβForwardGGGCTCATTCCGATTT363bpReverseTCATGGCCTTTGTTCAGβ-actinForwardATGCCATCCTGCGTCTGGACCTGGC606bpReverseAGCATTTGCGGTGCACGATGGAGGG
两步法进行cDNA合成,具体操作步骤按试剂盒说明书进行,分别取上述cDNA 10 μL与iNOS等或β-actin引物进行PCR反应,按试剂盒说明书操作步骤进行。
使用琼脂糖凝胶电泳对PCR混合物进行分析,并通过凝胶记录系统(Biosens SC810,中国上海)对图像进行采集。产物相对含量用电泳条带信号灰度值与β-actin电泳条带信号灰度值之比表示。
1.7 DRG神经元荧光染色及胞浆游离Ca2+浓度测定Fluo-3/AM储备液(5 μmol fluo-3,AM, 0.005% Pluronic F-127, 0.1% DMSO),-80 ℃避光保存,使用前解冻。培养皿滴入0.2 mL Fluo-3,AM预知液,正常培养箱孵育1 h。去除染液,缓冲液冲洗。培养皿置于激光共聚焦显微镜(Leica TCS SP5,德国莱卡公司)载物台上,记录连续动态扫描的细胞内荧光强度(FT)变化。Fluo-3,AM在波长488 nm处激发,发射波长526 nm,采样频率为488 HZ,每皿选3~5个视野,以FT变化反映细胞内游离钙浓度的变化。
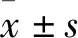
2 结果
2.1 新生大鼠DRG神经元细胞的培养,纯度测定及染色鉴定刚接种的DRG细胞呈圆形,明亮且分散(Fig 1A),4~6 h后开始贴壁。接种24 h后,大部分贴壁细胞开始长出突起,并可观察到突起末端的生长锥。孵育3~5 d后,细胞之间开始形成网络(Fig 1B)。用NSE抗体对新生小鼠原代培养DRG神经元进行免疫染色,NSE 主要在胞质中表达,阳性细胞数量居多,呈深棕色,细胞形态呈圆形、椭圆形以及多边形等,偶尔可观察到突起伸出(Fig 1C,1D)。鉴定结果显示,培养的DRG神经元细胞纯度达0.9以上。
Fig 1 Culture and identification of DRG neuronsA.DRG neurons cultured for 1 h (×1 000); B. DRG neurons cultured for 24 h (×200); C and D. DRG neurons identified by NSE immunohistochemistry (DAB×400)
2.2 SNP 对DRG神经元的损伤作用及IGPS含药血清的调节与对照组相比,SNP模型组DRG细胞的存活率为 57.73%,显示 SNP处理对DRG神经元造成了损伤(P<0.01)。而与 SNP模型组相比,IGPS 含药血清(140、280 mg·kg-1)组大鼠 DRG 神经元存活率呈现明显升高趋势(P<0.05,P<0.01),Tab 1。

Tab 1 Effect of IGPS-containing serum on survival in
2.3 SNP诱导DRG神经元NO/cGMP/PKG信号通路变化及IGPS含药血清的调节作用与对照组相比,用NO供体SNP预处理30 min可以明显增加亚硝酸盐水平并增强iNOS酶活性,而IGPS含药血清(280、140、70 mg·kg-1)的干预呈浓度依赖性地抑制亚硝酸盐水平以及iNOS活性的升高(Fig 2A)。cGMP定量显示了一致的结果,200 μmol·L-1终浓度的SNP溶液可以明显升高cGMP含量,而IGPS含药血清可以明显下调cGMP含量(Fig 2B)。

Fig 2 NO production modulated by IGPSA: NO production and iNOS activity; B: cGMP level. ##P<0.01, vs control. *P<0.05, **P<0.01 vs SNP.
2.4 SNP对DRG神经元iNOS,PKGIα和PKGIβ mRNA的表达的影响及IGPS含药血清的调节作用Fig 3A,B结果显示,与对照组相比,SNP促进了DRG神经元iNOS mRNA,PKGIα和PKGIβ mRNA的表达。与模型组相比,IGPS含药血清可明显下调受损DGR神经元iNOS mRNA(P<0.01,P<0.05),PKGIα mRNA(P<0.05,P<0.05)和PKGIβ mRNA(P<0.01,P<0.05)的过度表达。
2.5 SNP对DGR神经元细胞内Ca2+水平的影响及IGPS含药血清的调节作用与对照组相比,SNP作用DRG 神经元Ca2+浓度在15 s处有明显上升。对照组DRG 神经元Ca2+水平在55 s 内几乎没有变化(Fig 4A)。与对照组相比,SNP诱导DRG神经元的Fluo-3,AM荧光强度(103.936±16.945)远高于对照组神经元(20.896±9.471),差异有显著性(P<0.01)。 与SNP模型组相比,DRG神经元升高的Ca2+水平IGPS含药血清可以明显下调,差异有显著性(P<0.01,P<0.05)(Fig 4B)。
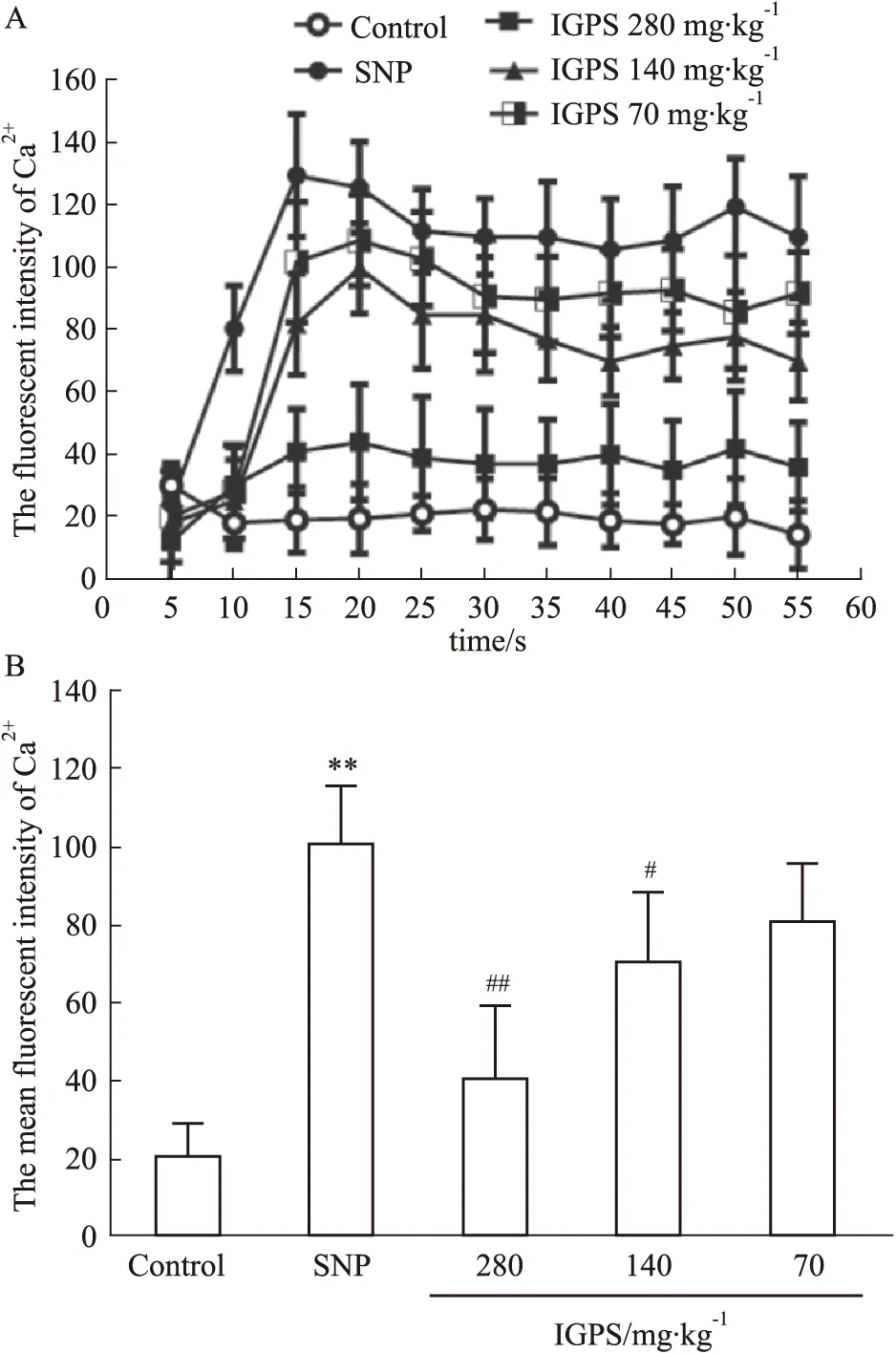
Fig 4 Intracellular Ca2+ variations in DRG neurons regulated by IGPSA: Effect of IGPS containing serum on time course of Ca2+ formation; B: The mean intensity of intracellular Ca2+concentration. Data represents mean±SEM of at least eight individual experiments. ##P<0.01 vs control, *P<0.05, **P<0.01 vs SNP

Fig 3 mRNA expression of iNOS, PKGΙα and PKGIβ decreased by IGPSA: Representative RT-PCR image of mRNA expressions of iNOS, PKGΙ (α, β); B: Relative ratios of iNOS, PKGΙ (α, β) to β-actin, respectively. ##P<0.01, vs control, *P<0.05, **P<0.01 vs SNP
3 讨论
NO作为信息传递分子参与体内多种生理病理过程,研究证实,过量NO可对神经元细胞产生毒性,本实验通过采用SNP作为NO供体提高DRG细胞内NO浓度,结果显示SNP在200 μmol·L-1浓度时,细胞存活率在50%左右,选择此浓度为造模浓度最适合。IGPS为中药提取物,采取中药血清药理学的实验方法,从细胞水平探讨中药的作用机理。实验结果显示,IGPS含药血清可明显提高NO损伤后神经元的存活率,提示IGPS含药血清对SNP损伤DRG细胞具有一定的保护作用。
研究证实,cGMP依赖性的PKG酶参与了脊髓的疼痛传递,当外周神经受损出现炎症可引起外周PKGI激活并逆向转运至DRG神经元中,致使脊髓PKGI表达量增加[11]。我们进一步研究发现,IGPS的镇痛作用可能与NO介导的信号转导通路有关。IGPS含药血清可明显抑制DRG神经元细胞NO和cGMP含量, 可明显下调PKGI(α,β)mRNA表达,即IGPS可通过抑制PKG介导的NO/cGMP信号通路的磷酸化发挥镇痛作用。N型和L型电压门控的Ca2+通道阻滞剂可有效缓解与神经性疼痛相关的痛觉过敏和异常性疼痛,不影响正常痛觉。我们实验结果表明,IGPS可以明显降低由外源NO引起的钙离子浓度升高,这表明诱导炎症性和神经性疼痛可能需要钙依赖的突触后机制。
综上,研究结果表明,IGPS含药血清可通过抑制NO诱导的cGMP/PKG 信号通路及升高细胞内钙离子浓度,有效降低SNP损伤DRG神经元的死亡率而产生保护作用。
