异时性多中心骨肉瘤治疗的中长期随访结果
2020-11-17刘巍峰宫丽华杨勇昆黄真金韬孙扬王任先陈大福郝林张清丁宜牛晓辉
刘巍峰 宫丽华 杨勇昆 黄真 金韬 孙扬 王任先 陈大福 郝林 张清 丁宜 牛晓辉
多中心骨肉瘤(multicentric osteosarcoma, MOS)为患者出现全身骨骼多处骨肉瘤病灶且不同时伴有肺及其他内脏转移,是骨肉瘤的一个罕见亚型,在骨肉瘤中占比例为1%~5%[1-3]。以多中心病灶出现时间与首发病灶间隔6个月为节点,MOS被分为同时性MOS(synchronous multicentric osteosarcoma,SMOS)和异时性MOS(metachronous multicentric osteosarcoma,MMOS)[1,4]。SMOS为多数骨肿瘤专科医生所了解;MMOS常因不同病灶出现时间间隔延长而与单中心骨肉瘤的骨转移难以区分,部分患者因生存预期较差而放弃治疗,使得获取完整临床资料和积累治疗经验较为困难,已有文献多为个案报道[5]。术前化疗+手术+辅助化疗的常规新辅助治疗对MMOS第2病灶是否有效以及MMOS相对单中心骨肉瘤的生物学行为和治疗结果究竟如何等问题仍不清楚。本研究通过对一组MMOS患者的临床资料进行回顾性分析,探讨MMOS的流行病学特点、手术和化疗对MMOS的中长期治疗结果以及MMOS与单中心骨肉瘤的差异及其预后影响因素,以期为MMOS的临床治疗提供指导。
资料与方法
一、资料
1. 一般临床资料:回顾分析北京积水潭医院骨肿瘤科2001年1月至2018年6月收治的MMOS患者40例的临床资料。
2. 病例纳入与排除标准:(1)病例纳入标准:初诊时单中心病灶与再发骨肉瘤病灶出现时间间隔≥6个月;再发第2部位骨肉瘤病灶诊断时不合并肺转移及其他内脏转移;所有病灶出现部位无既往放疗史;既往无全身代谢性骨病及肿瘤病史[1,6]。(2)病例排除标准:有且只有2个病灶,符合Enneking报道的跳跃病灶(skip metastasis);合并肺转移的单病灶骨转移;初发骨肉瘤病灶局部复发侵及毗邻骨导致的多骨受累[6-8]。
二、方法
1.病例搜集:回顾我科病例资料库中高级别骨肉瘤患者2 342例的临床资料。根据临床数据库和影像数据库资料、病案室病历和病理科报告进行严格筛选,记录患者的性别、发病年龄、初诊时病史时间、首发症状、确诊时间、临床一般表现、初诊主诉部位、再发第2部位间隔时间、手术情况及历次病理结果等。患者首发骨肉瘤部位均得到了外科治疗,部分再发部位因患者选择放弃治疗而未行手术切除。获得高级别骨肉瘤多骨发病153例,根据MMOS的诊断标准,排除合并肺部及其他内脏转移的骨转移病例57例和SMOS患者56例,最终确认MMOS患者40例[9]。其中34例患者完成6个月以上随访。
2. 诊断与评估:(1)常规生化检查,包括碱性磷酸酶(alkline phosphatase,AKP)和乳酸脱氢酶(lactate dehydrogenase,LDH)等项目。(2)依据初诊患者主诉病灶部位的X线、CT增强、MRI增强、区域淋巴结超声以及胸部CT和全身骨扫描等检查结果,对骨扫描显示异常部位加做影像学检查,完成病例分期,并进行病理穿刺活检明确诊断。
3.治疗:行常规术前新辅助化疗(对截肢病例可不行术前化疗),记录患者入院后化疗次数和用药剂量。目前规范化疗定义为术前新辅助化疗2~3个月(≥2个周期),手术后辅助化疗6~9个月,序贯化疗12~16个周期(≥12个周期)[9]。化疗药物与剂量:甲氨蝶呤(methotrexate,MTX)10~12 g/m2,多柔比星90 mg/m2,异环磷酰胺12~15 g/m2,顺铂120~140 mg/m2。
手术治疗包括保肢和截肢。记录手术切除边界和重建方法、术后局部复发和手术并发症。
4. 复查:按照我科MOS随访方法进行定期规范复查[9]。在复查中发现第2部位骨肉瘤病灶,采用与首发病灶相同检查方法进行影像学评估和病理活检以明确诊断。行全身PETCT或全身骨扫描结合颅脑、胸腹盆CT或MRI,明确此时无肺及内脏转移。对第2部位骨肉瘤仍采取术前化疗+手术切除+术后化疗的治疗模式。
5.随访:采用以下方式进行随访:(1)电话随访,(2)门诊复查,影像学登记,(3)微信图片及视频随访资料登记。
6. 数据分析:对初诊和新辅助化疗后的AKP、LDH指标进行比较,观察化疗对实验室指标的影响;依据MMOS中仅有1个新发骨肉瘤病灶与2个以上新发病灶对病例进行分层;根据MMOS分型方法,将新发病灶出现时间与首发病灶间隔24个月以内和24个月以上的患者数据进行比较;对新发骨肉瘤病灶行手术与否的患者数据进行比较;以单因素分析方法对手术治疗、规范化疗、再发病灶数量以及再发病灶出现时间对患者生存率的影响进行研究;以多因素分析方法对各指标中影响MMOS患者预后的独立危险因素进行研究。
结 果
一、一般情况
40例MMOS患者占2 342例骨肉瘤患者的1.7%。其中男26例,女14例,年龄和中位年龄分别为(20.3±11.9)(10~61)岁和16.5(13,20)岁。初诊时病史(3.9±3.6)(1~24)个月,中位数为3(2,4)个月。初诊时首发骨肉瘤部位分别为股骨23例、胫骨9例、肱骨3例、腓骨3例、桡骨和下颌骨各1例。40例骨肉瘤首发及再发部位病灶共计132个,其中股骨37个,脊柱21个,胫骨20个,骨盆14个,肱骨11个,颅骨6个,腓骨6个,肋骨5个,骶骨4个,足3个,桡骨2个,胸骨、肩胛骨和髌骨各1个。其中23例(57.5%)患者再发骨肉瘤病灶数为1个,17例(42.5%)患者再发病灶数>1个。40例(100%)患者首发病灶主诉均为局部疼痛不适及明显肿胀;32例(80.0%)患者再发病灶主诉局部疼痛不适,8例(20.0%)患者则是定期复查骨扫描发现再发病灶,早于症状出现时间。再发病灶出现于第1次术后7~107个月,其中23例(57.5%)出现于24个月以内,17例(42.5%)出现于24个月以后。病理学检查结果为成骨型骨肉瘤26例(65.0%),成软骨型骨肉瘤2例(5.0%),成纤维型骨肉瘤9例(22.5%),小细胞型骨肉瘤1例(2.5%),未分化型骨肉瘤1例(2.5%),血管扩张型骨肉瘤1例(2.5%)例。影像学表现为单纯成骨硬化23例(57.5%),混合型骨破坏16例(40.0%),溶骨型破坏1例(2.5%)。
二、治疗方式
1. 化疗与手术:初发骨肉瘤初次治疗时5例(12.5%)未行术前化疗,1例(2.5%)接受1次术前化疗,34例(85.0%)接受3~6次术前化疗,31例(77.5%)接受术后化疗,共22例(55.0%)接受了规范化疗。再发骨肉瘤病灶仅11例(27.5%)接受了术前化疗或术后辅助化疗。初诊与化疗后AKP水平分别为(310±248)和(212±160) IU/L,化疗后显著降低(t=2.502,P=0.018);化疗前与化疗后LDH水平分别为(251±100)和(236±89)IU/L,差异无统计学意义(t=0.664,P=0.514)。
2.手术切除方式和切除边界:患者发生第2部位肿瘤与首发病灶手术间隔(29.9±23.5)(7~107)个月,中位间隔时间为21.5个月,其中23例进展时间<24个月,17例进展时间≥24个月。40例(100%)患者均接受了首发病灶安全边界切除,其中保肢38例,截肢2例。24例(60.0%)患者接受了第2部位病灶手术治疗,其中20例(83.3%)为安全外科边界切除,包括保肢15例和截肢5例。非肢体病灶手术包括颅骨切除2例、脊柱附件切除1例和肋骨切除1例。
3.重建:对27例首发病灶行瘤段截除和肿瘤型人工关节置换术,3例行自体骨灭活再植,3例行大段异体骨重建,1例行自体腓骨移植重建,4例行单纯切除术,2例行截肢术(髋关节离断和半骨盆离断各1例)。
三、生存与预后
对完成6个月以上随访的34例患者进行生存和预后评价。随访时间为(56.9±39.4)(17~198)个月,中位随访时间为46(31.5,69.0)个月。34例患者2、3、5和10年生存率分别为91.0%、67.1%、48.5%和32.8%(图1),异时骨肉瘤病灶进展后1、2、3和5年生存率分别为71.6%、51.4%、38.1%和18.5%(图2)。异时病灶数=1个和>1个的患者5年生存率分别为54.7%和38.9%,差异无统计学意义(χ2=1.031,P=0.310)(图3)。异时肿瘤病灶接受手术患者5年生存率(55.1%)大于未接受手术患者(35.1%),差异有统计学意义(χ2=4.280,P=0.039)(图4),接受规范化疗与非规范化疗患者5年生存率分别为49.1%和47.5%,差异无统计学意义(χ2=0.001,P=0.974)。异时肿瘤病灶出现时间<24个月与≥24个月患者5年生存率分别为68.8%和22.1%,后者明显降低(χ2=9.184,P=0.002)(图5)。单因素分析结果显示异时肿瘤病灶是否手术治疗以及病灶进展时间具有组间差异(表1),多因素回归模型分析结果表明异时病灶进展时间是影响MMOS预后的独立危险因素(表2)。典型病例见图6。
讨 论
一、MMOS的概念、分型和诊断标准
关于MOS的文献报道最早可以追溯至1922年,日本学者Aizawa等[10]描述了原作者White针对1例下肢3处骨肉瘤患者的个案报道。Silverman等于1936年首次提出MOS这一概念[11]。Halpert等[12]在1949年对MOS概念进行了补充和完善。一般而言,MOS具备如下特征:(1)多部位骨骼系统出现骨肉瘤病灶;(2)不同部位病灶可同时或者异时出现,通常以出现时间间隔6个月为临界值,间隔6个月以上出现者为MMOS;(3)同时出现多中心病灶或异时出现多个部位肿瘤累及时无肺及其他内脏转移证据;(4)多中心病灶的病理学特征相对一致,不同于转移性病灶的异质性;(5)患者既往无全身性代谢性骨病、佩吉特病或放射治疗史[1,4,6,13-14]。但是,在临床上对于部分MOS的诊断仍存在困难,如受累长骨同一间室两端受累而骨干髓内正常,或者仅股骨远端和胫骨近端受累的病变,被认为是跳跃病灶而非真正的MOS[8]。继发出现的多骨受累往往容易与单骨骨肉瘤多发转移相混淆,需要确认是否在骨转移前合并肺或其他内脏转移[15]。根据Amstutz[16]和Mahoney等[17]的分类方法,MMOS初步分为2个亚型:(1)异时病灶在初诊骨肉瘤后6~24个月出现,可以继发为单骨受累,也可以多个骨结构受累,最易被认为是原病灶出现的骨转移;(2)异时病灶为初诊骨肉瘤24个月之后出现,这类患者可以有很长的无疾病生存(disease-free)期,所以对其中部分患者需要慎重评估是否出现第2肿瘤病灶。这两个亚型与SMOS合并分类时,可划分为ⅢA和ⅢB期[16]。
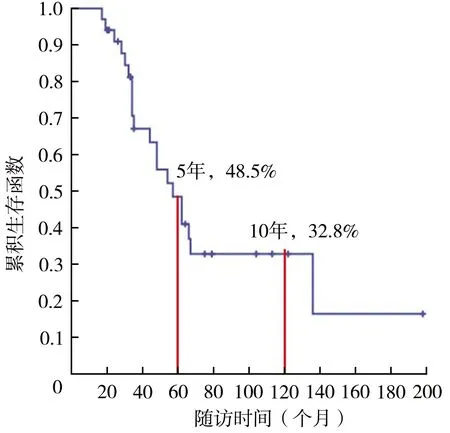
图1 MMOS患者总体累积生存率
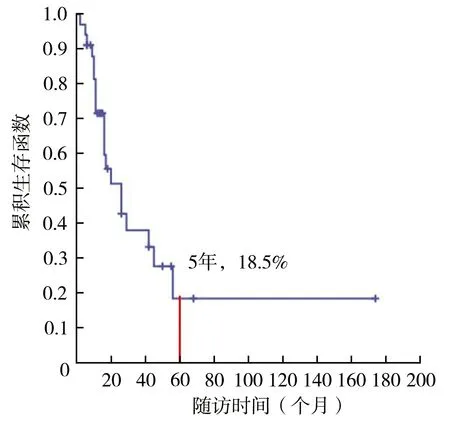
图2 MMOS患者异时病灶进展后总体累积生存率
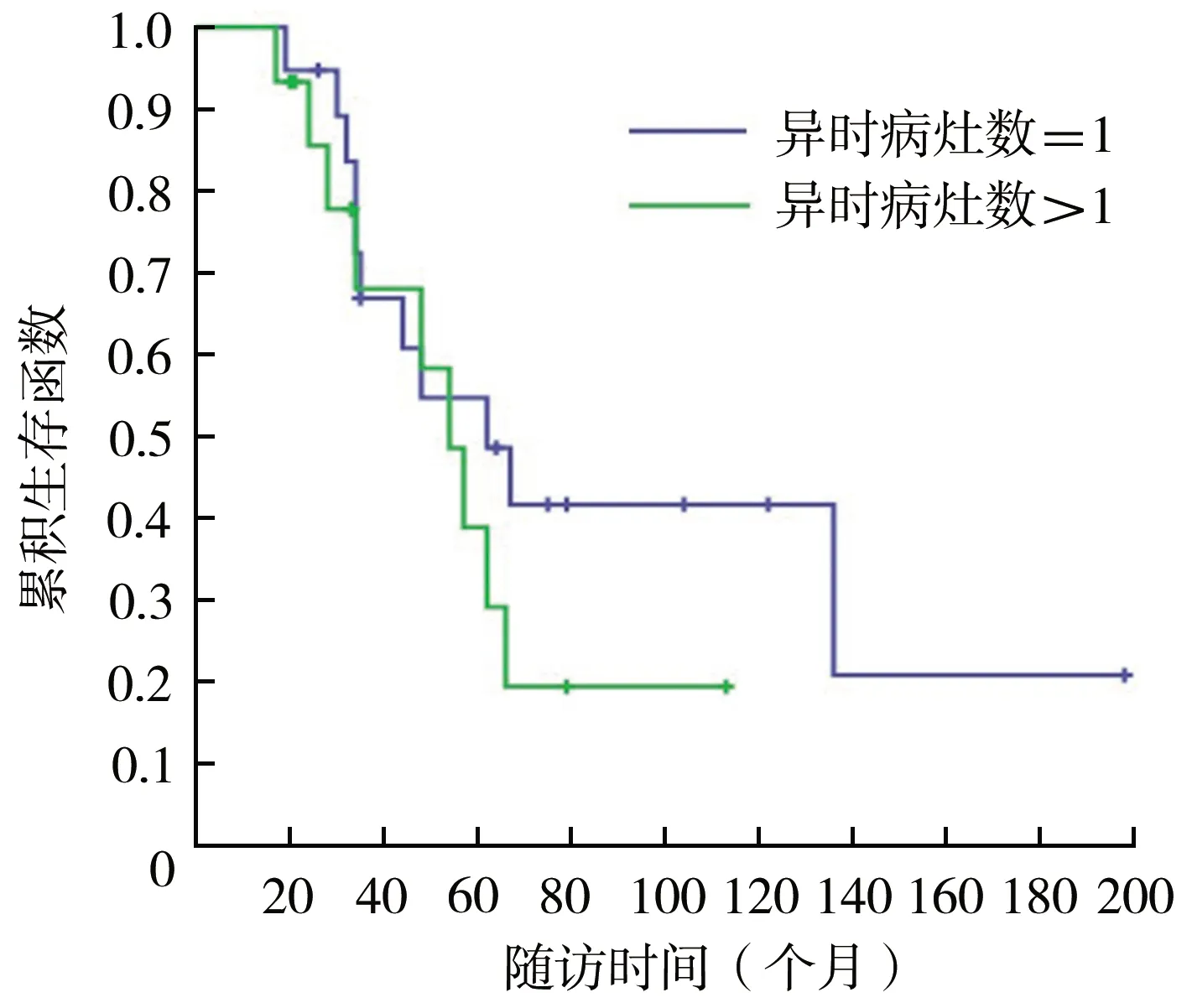
图3 MMOS病灶数量=1与>1患者生存率比较
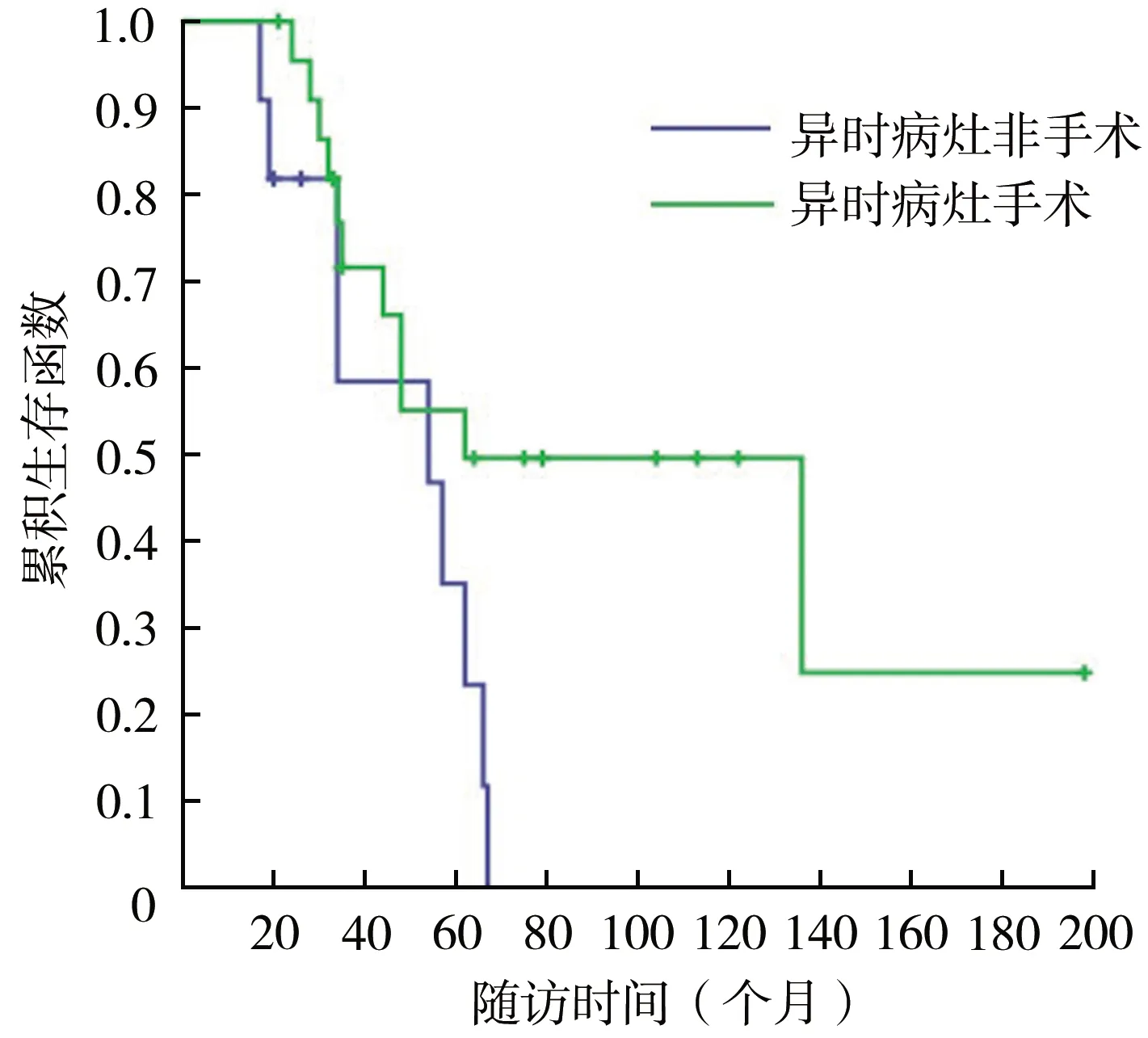
图4 MMOS异时病灶手术与否患者生存率比较
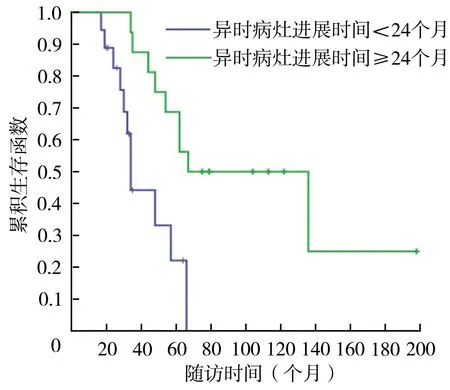
图5 MMOS异时病灶进展时间分层生存率比较
二、MMOS的发病特征、发病机制及其与骨转移的鉴别
MMOS的发病特征为次第多骨起病,关于是多中心起源还是继发骨转移一直存在争议。不同人种的差异并不显著[18]。学者对于MMOS的发病机制至今仍未达成共识。大多数学者支持MMOS为多中心起源,单一病灶骨肉瘤最常见为肺转移,极少见出现骨转移[15],且多中心病灶的病理形态特征非常近似[11, 15,19]。本研究组患者发病过程支持多中心起源,在骨骼第2部位出现骨肉瘤病灶,影像学表现均为局部混合型骨破坏表现且不合并肺转移。由于MMOS患者可能在经历较长时间的无病生存期后出现第2部位肿瘤,对于是原病灶转移导致全身多发及内脏侵犯还是内脏肿瘤导致的骨转移,往往需要通过全身影像进行评估。骨肉瘤本身导致的肺外内脏转移极其罕见。与SMOS不同,对MMOS的诊断再次病理活检不可或缺,并对于临床决策至关重要[9]。除了多中心起源论,部分学者提出了转移起源论,即MMOS是由某个原始骨肉瘤病灶转移至其他骨骼而形成多中心表现[13,16-17]。虽然MMOS诊断时在影像学上没有肺转移证据,但是Parham等[20]通过解剖学研究发现即使大体观正常的肺组织,镜下也可以见到瘤栓。Corradi等[1]发现,部分MOS病灶表现为一致的成骨改变,而有的病例则表现为1个主体病灶和若干较小病灶,后者则是转移起源论支持者所认同的征象。Bacci等[3]与Longhi等[2]的研究结果表明多病灶化疗后的反应基本一致,据此认为这些病灶具有同源性,并非多中心起源而是同一病灶转移的结果。本研究组40例患者中23例仅有单发的第2部位肿瘤,影像学表现均较为典型,17例为多发的第2部位肿瘤,不存在明显的1个较大主体病灶和若干小病灶表现。本研究组24例患者接受了第2部位手术,仅10例再次接受术前化疗,再次化疗局部影像学反应与第1次化疗类似。故而就本研究组病例的临床表现而言,与两种起源理论都有一定相似性,但结合MMOS的定义,更符合多中心起源的标准。MMOS的诊断标准明确,发生机制有待进一步研究。
三、MMOS的治疗及预后影响因素
MMOS的治疗通常包括化疗和手术。目前绝大多数MOS相关文献集中于SMOS,对MMOS的研究较少。化疗带给SMOS患者的获益已得到了较为一致的评价[9]。但是本研究结果表明,对第1次手术部位的规范化疗并不能改善第2部位肿瘤的预后,且由于仅部分患者再发MMOS时选择了化疗,化疗并未使MMOS患者整体显著获益。对于单发异时性病灶患者,本研究结果显示化疗对局部保肢仍具有积极意义。手术治疗在SMOS的单因素分析结果中显示对预后有积极作用[9]。Longhi等[2]报道了SMOS患者接受新辅助化疗的结果,其中接受手术治疗的患者预后明显优于病灶负荷大且未接受手术治疗的患者。Bacci等[3]与Bacci等[21]研究结果表明,手术结合化疗可以相对延长SMOS患者生存时间。本研究组中异时病灶接受手术的患者在预后单因素分析结果中同样存在显著的优势,与Rizzoli的研究结果类似[2]。本研究组患者总体5年生存率为48.5%,显著低于单中心骨肉瘤患者[22];如果按照异时病灶出现后计算则仅为18.5%,低于Corradi等[1]报道的结果,而10年生存率与之相近。异时病灶出现的时间是影响预后的独立危险因素,患者首次病灶和异时病灶之间的无病生存期越长则预后越好,这与临床观察结果一致。据此以间隔时间24个月为界限将MMOS患者划分为ⅢA和ⅢB型[13],同时能够较好地指导预后。多数学者将患者存活时间≥10年作为长期存活[1,11]。MMOS患者长期存活率极低。本研究组至随访期末仅1例患者达到10年以上存活。本研究发现肿瘤病灶数量以及是否接受化疗均对患者预后无影响,考虑为单发骨肉瘤一旦再次出现骨组织受累,首次化疗难以对异时病灶起效,且化疗对骨的改善作用乏善可陈。手术可改善MMOS患者的生存曲线,考虑为MMOS本身预后差,有机会接受手术的患者大多数肿瘤负荷低,局部异时性病灶有机会达到减瘤甚至无瘤状态,未接受手术患者可能因瘤负荷过大而没有手术治疗机会或因经济条件等原因难以后续跟进治疗,从而出现选择偏倚。异时病灶出现时间越晚的患者预后越好,这与转移性病灶类似,越早出现远隔部位的受累表明患者对前序治疗反应越差;间隔时间越长则肿瘤的惰性越强,Aung等[23]研究发现超过24个月后出现异时病灶的骨肉瘤患者经过综合治疗5年生存率可达到61%,远高于在24个月以内出现进展的患者(8%)。目前MMOS的治疗手段有限,对于需要安全边界的外科治疗、改善症状的姑息手术以及特殊部位的活检,本研究中对计算机导航的运用为外科边界设定和微创提供了技术保障[24]。未来对骨肉瘤转移和MOS的基因组学研究有助于对MMOS的发生和发展机制进行更深入的了解以及对其新的治疗方法进行探究[25-26]。
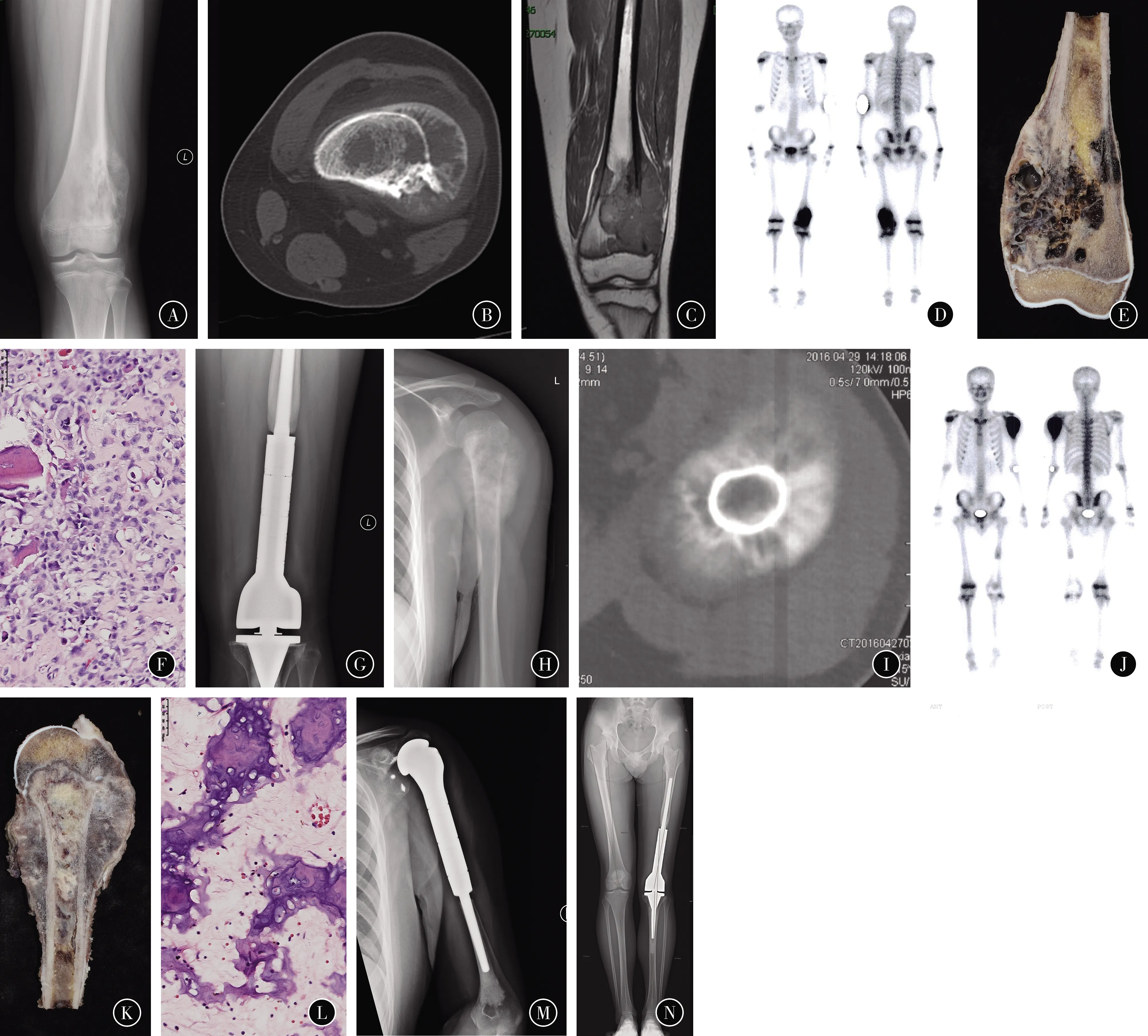
图6 患者男,13岁,左股骨下段骨肉瘤 A 左股骨下段X线可见成骨破坏,基质不均,边界不清,骨膜反应和软组织包块 B 左股骨下段CT骨窗可见混合型骨破坏,皮质破坏,软组织包块并成骨 C MRI T1加权像示左股骨下段髓内病灶破坏皮质形成骨外软组织包块 D 全身骨扫描显示股骨单发病变 E 术前4次新辅助化疗后行瘤段截除标本 F 术后病理检查可见肿瘤大片坏死(HE染色,×40) G 肿瘤型人工假体置换术后22个月随访假体位置及功能良好 H 第1次术后22个月左肩部肿胀疼痛,X线显示左肱骨上段成骨破坏、骨膜反应和软组织包块 I 左肱骨CT骨窗可见放射状骨膜反应和软组织包块 J 全身骨扫描显示左肱骨上段单发病变,同时复查胸部CT未见肺转移 K 再行4次新辅助化疗后行肱骨瘤段截除标本 L 肱骨术后病理检查可见大片肿瘤坏死区域(HE染色,×40) M 左肱骨上段假体置换术后40个月X线示假体位置良好。截止随访期末假体功能良好 N 左股骨下段假体置换术后62个月X线示假体位置良好。截止随访期末患者无病生存假体功能良好
四、本研究的局限性
本研究纳入了迄今为止最大宗的MMOS病例,但是仍存在以下不足:(1)研究方法为回顾性分析,跨年度治疗存在异质性;(2)因MMOS患者生存预期差、治疗周期长,患者依从性远低于单中心骨肉瘤,部分患者随访时间较短,影响整体真实世界数据评估;(3)对异时病灶的病理学评估,未来可以进一步进行分子水平的鉴定或基因组学研究以探讨其来源和机制。
总之,MMOS患者手术治疗后中长期生存率较低,异时骨肉瘤病灶出现与首发病灶出现的时间间隔是影响患者预后的独立危险因素。
