基于微滴式数字PCR的饮料中嗜酸乳杆菌定量检测
2020-11-17刘洋张娜娜窦同海俞漪徐琼曲勤凤赵渝杨捷琳朱春梅
刘洋,张娜娜,窦同海,俞漪,徐琼,曲勤凤,赵渝,杨捷琳,朱春梅
(1. 上海市质量监督检验技术研究院国家食品质量监督检验中心(上海),上海200233;2.上海昂朴生物科技有限公司,上海201114;3.上海师范大学生命科学学院,上海200234;4.上海海关动植物与食品检验检疫技术中心,上海200135;5.杜邦营养与生物科技丹尼斯克(中国)投资有限公司,上海200335)
0 引 言
嗜酸乳杆菌作为重要的益生菌被广泛用于食品中。Kumar[1-4]等人发现嗜酸乳杆菌对大肠杆菌、腹泻致病菌等均有抑制作用;降低血浆中胆固醇含量[5];对乳糖不耐症有一定的疗效[4,6],对机体健康有促进作用等[5,7]。嗜酸乳杆菌能在发酵过程中产生乳酸,并通过氨基酸代谢增加风味[8]。在我国,饮料中添加益生菌特别是嗜酸乳杆菌成为新的发展趋势[8]。
微滴式数字PCR 技术(droplet digital polymerase chain reaction,ddPCR)是近年来新发展起来的定性定量分子检测新方法[9],用于转基因成分、食品中致病菌、掺假产品等的检测,以及在临床上用于肿瘤细胞的检测[10-16]。1992 年,Sykes[17]等就首次提出了ddPCR的构想,是一项基于单分子目标基因PCR 扩增的绝对定量技术,主要原理是将含有DNA 模板的PCR 反应体系分布到大量的独立反应室,单分子间通过大量稀释后分离,使得每个独立反应室中含有小于或等于一个拷贝,然后使这些反应室在相同条件下独自进行PCR 扩增[18-19]。含有DNA 分子的微反应室能够发生PCR 反应,即产生阳性信号;而不含DNA 的微反应室则产生阴性信号[18,20],再利用泊松分布,逐一对阳性信号的微反应室计数,从而计算出样品中初始的DNA 模板量[21]。
ddPCR 技术以其准确性好、灵敏度高、无需任何校准物质、可进行绝对定量等优势,已经在临床诊断、基因表达、环境微生物检测等方面得到了广泛的研究和应用。本研究主要基于嗜酸乳杆菌SPIDR 序列,结合ddPCR 方法定量检测饮料中的嗜酸乳杆菌,为该类产品的品质检测提供技术手段。
1 材料与方法
1.1 材料与试剂
本研究根据国家卫生健康委员会发布的《可用于食品的菌种名单》,结合市场上饮料中常见的乳酸菌菌株,选择4 个嗜酸乳杆菌,19 个其他菌株进行特异性检测(表1)。
上述菌株购买后均由上海市质量监督检验技术研究院自行保存。 Lactobacillus acidophilus NCFM(HOWARU®Dophilus)、Lactobacillus acidophilus La-14、HN001 HOWARU®Rhamnosus、Lactobacillus casei Lc-11、Lactobacillus paracasei Lpc-115、Lactobacillus paracasei Lpc-37、Lactobacillus salivarius Ls-33 由丹尼斯克(中国)投资有限公司惠赠。
1.2 仪器与设备
T100 微滴式数字 PCR 扩增仪、QX200 微滴读取仪、PX1 板封口机、QX200 微滴生成仪,美国BIO-RAD;Vortex Genie2 漩涡振荡器,美国 SI;移液枪,美国GILSON;SW-CJ-2D 超净工作台,苏州净化;ESCO LA2-4A1生物安全柜,新加坡艺思高。
1.3 主要试剂与材料
ddPCR Supermix for probes、微滴生成专用油、96孔板、微滴生成卡,美国BIO-RAD。
引物与探针见表2,由英潍捷基(上海)贸易有限公司合成。
2 实 验
2.1 核酸提取方法
2.1.1 标准菌株核酸提取方法
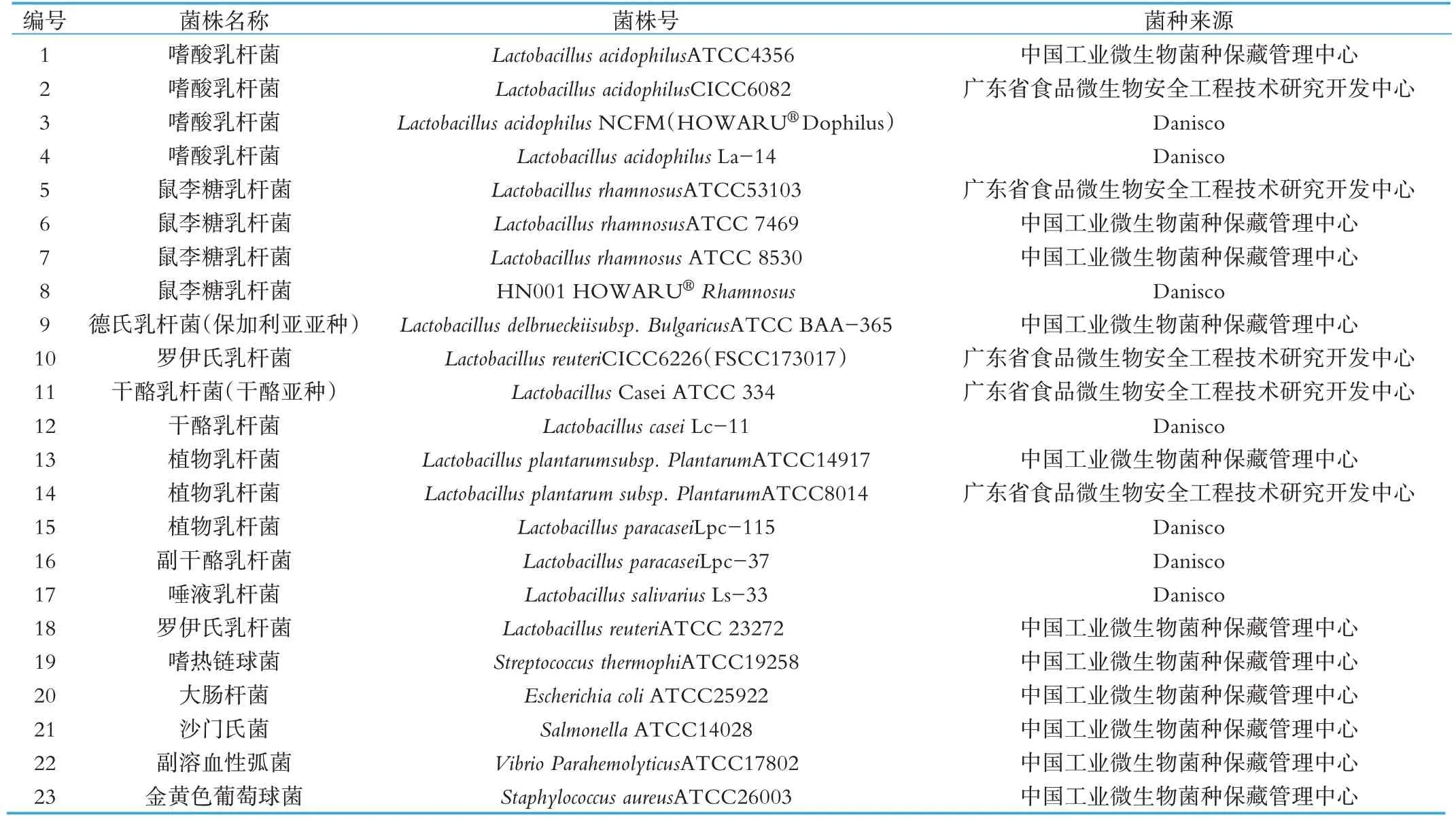
表1 菌株名称及其编号

表2 本研究用到的引物与探针
(1)菌株富集:吸取1 mL 培养液,加入2 mL 无菌离心管中,13 000 rpm,离心5 min,去除上清,重复上述步骤1次,即共吸取培养液2 mL取沉淀。
(2)菌株裂解:富集后的沉淀中加入400 μL 10 mg/mL溶菌酶,37 ℃,水浴 2 h;加入 400 μL CTAB 裂解液,3 0 μL 蛋白酶K,混匀,56 ℃,2 h。而后进行核酸提取[22]。
2.1.2 实验样品核酸提取方法
样品进行前处理:取饮料25 mL 加入到225 mL 的无菌蒸馏水中,混匀,取5 mL 的样品加入15 mL 离心管中,9 000 g 离心 5 min,去上清;沉淀中加入 5 mL 无菌蒸馏水,涡旋振荡混匀,混匀液放在沸水中加热,直至蛋白质絮状物出现,9 000 g 离心5 min,去上清,沉淀中加入5 mL 无菌蒸馏水溶解,涡旋振荡器上混匀,再次在沸水中加热10 min,9 000 g 离心10 min,去上清。沉淀加400 μL 浓度为10 mg/mL 的溶菌酶,在涡旋振荡器上将沉淀混匀,37 ℃孵育2 h,加入400 μL的CTAB 裂解液,56 ℃水浴 2 h。而后提取核酸[22]。粗提取核酸进行过柱纯化,用于后续PCR 扩增。
2.2 体系及条件
ddPCR 扩增体系如下配制:2×ddPCR Master Mix 各 10 μL,NCFM P F(10 μmol/L)、NCFM P R(10 μmol/L)各 1.8 μL,NCFM P 探针(10 μmol/L)0.5 μL,DNA 模板 4 μL,无菌蒸馏水补足至 20 μL。配制好的反应体系移至微滴生成卡中,加70 μL 微滴生成专用油,在微滴生成器中将微滴生成卡中的样品生成微滴。取40 μL 生成的样品微滴至96 孔板中,封膜。在PCR 仪中进行扩增。扩增程序为:预变性10 min,96 ℃ ;94 ℃ 30s 变性,60 ℃ 1 min 退火加延伸,40 个循环;98 ℃ 10 min 热失活;4 ℃ 保存。升温速度2 ℃/s。扩增结束,将96 孔板放置在微滴读取仪中读数。
2.3 ddPCR 扩增方法建立
2.3.1扩增条件优化
2.3.1.1 扩增温度优化
以嗜酸乳杆菌标准菌株核酸为模板,优化扩增温度。退火温度设置为 60、59.2、58、56.1、53.8、51.9、50.7、50.0 ℃共8个温度梯度。
2.3.1.2 扩增模板优化
以嗜酸乳杆菌标准菌株核酸为模板,分别对10 ng/μL、5 ng/μL、3 ng/μL、2 ng/μL、1 ng/μL、200 pg/μL、100 pg/μL、10 pg/μL 等几个核酸浓度进行检测。根据扩增显示的阳性微滴数选择最适的模板浓度。
2.4 ddPCR 扩增方法验证
2.4.1 特异性检测
特异性测试采用4 株嗜酸乳杆菌菌株,14 株其他乳杆菌,1 株嗜热链球菌以及4 株致病菌的核酸为模板,采用建立的ddPCR 扩增体系进行检测。
2.4.2 重复性试验
选取嗜酸乳杆菌标准菌株的核酸,选择1、0.1、0.01、0.001 ng/μL 等 4 个质量浓度的核酸稀释液进行扩增。根据阳性微滴数计算CV 值。
2.4.3 灵敏度试验
以嗜酸乳杆菌标准菌株核酸为模板,对核酸浓度分别为 3 ng/μL、2 ng/μL、1 ng/μL、200 pg/μL、100 pg/μL、10 pg/μL、1 pg/μL、0.5 pg/μL、0.25 pg/μL、0.05 pg/μL 进行检测。根据ddPCR 扩增显示的阳性微滴数选择最适的核酸浓度。
2.4.4 抗干扰试验
本研究选择质量浓度为 2 ng/μL、1 ng/μL、100 pg/μL、50 pg/μL、10 pg/μL、1 pg/μL 的嗜酸乳杆菌标准菌株核酸,分别 1∶1 添加 1 ng/μL 与 50 pg/μL 的德式保加利亚乳杆菌,进行PCR 扩增。对比实验组与对照组阳性微滴数之间的差异,判断该方法抗其他菌种干扰的能力。
2.5 实际样品检验
市场上购买含有嗜酸乳杆菌的饮料共11 份,不含嗜酸乳杆菌的饮料1 份。提取样品核酸进行扩增,根据阳性微滴数计算样品中嗜酸乳杆菌含量。
3 结 果
3.1 扩增温度和模板浓度的优化
对引物和探针的温度优化扩增结果显示,不同温度梯度对于检测的结果影响较小。60 ℃时阳性微滴较多,选择60 ℃作为扩增的退火温度。
扩增浓度优化的结果图如图1 所示,可以看出,核酸浓度为10 ng/μL、5 ng/μL、3 ng/μL 时,无阴性微滴出现,提示核酸浓度过高;核酸浓度为2 ng/μL、1 ng/μL、200 pg/μL 和100 pg/μL 时,阳性微滴与阴性微滴之间有明显的界限,但核酸浓度为2 ng/μL 时拖尾较为严重。后续实验选择1 ng/μL 的核酸浓度作为实验浓度。
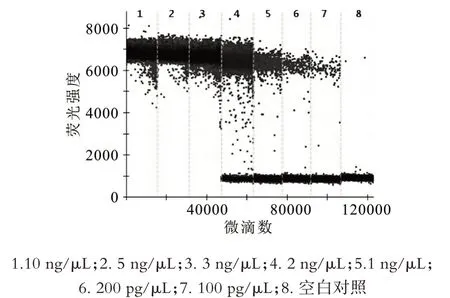
图1 模板浓度优化结果
3.2 ddPCR 特异性检测
特异性检测结果如图2 所示,嗜酸乳杆菌扩增出现阳性微滴,其他菌株均未出现阳性微滴,说明引物及探针的特异性好,方法适用于嗜酸乳杆菌的特异性检测。
3.3 重复性试验
不同浓度核酸重复性检测结果如表3 所示,检测结果的CV 值在2.34%~6.1%之间,小于7%,在可接受范围内,证明该方法的重复性好。

图2 特异性检测结果
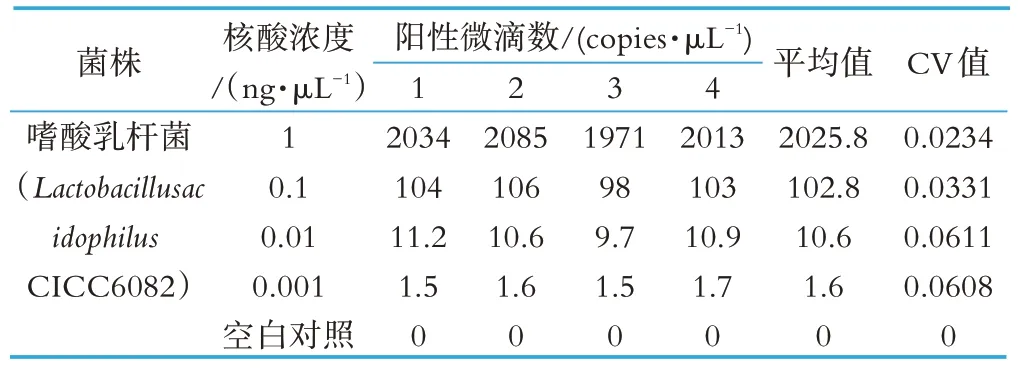
表3 ddPCR重复性验证
3.4 灵敏度检测
核酸水平灵敏度检测结果表4 所示,核酸浓度为3 ng/μL 时,阳性微滴与阴性微滴不能区分;核酸浓度在 2 ng/μL~0.25 pg/μL 之间阳性微滴与阴性微滴可明显区分,0.1 pg/μL 时无阳性微滴出现,说明在核酸水平ddPCR 的检测下限为0.25 pg/μL。

表4 添加不同浓度菌株扩增微滴数
3.5 抗干扰试验
抗干扰试验结果如图3 所示,两者的扩增结果与对照组比较,两者在数值上无明显差异,证明该方法具有良好的抗干扰能力。
3.6 实际样品检测
对市售的11 份样品进行数字PCR 定量检测,结果显示标签标示添加嗜酸乳杆菌的样品全部扩增出阳性微滴(表5)。除10 号样品外,样品中菌的含量为1.6×103~2.3×106copies/g,与标签信息基本相符。结果表明,本研究建立的数字PCR 检测方法可用于实际样品中嗜酸乳杆菌的定量检测。
4 总 结

图3 添加干扰菌扩增的结果图
随着社会和民众对健康的重视,益生菌在食品中的应用越来越广泛,其中嗜酸乳杆菌作为一类功效显著的益生菌,在饮料、发酵乳、婴幼儿配方乳粉中应用较多。因益生菌原料成本较高,且为生物活性物质,其添加种类和添加量需要特别关注。我国食品安全国家 标准要求饮料中添加菌种的活菌数必须≥106CFU/mL。但目前,对于饮料中益生菌的菌种检测主要依赖传统的培养法,耗时耗力,结果受影响因素较多,难以满足市场精确鉴定和定量的要求,急需快速、准确、特异性高的检测方法。
目前,基于微滴式数字PCR 的分子检测方法在食品微生物检测中得到较大的关注和探索。蔡一村[23-25]等借助数字PCR 检测肉制品中掺假,并得出肉质量与阳性微滴数之间的关系式;赵新等[26-29]借助数字PCR 检测食品中的致病菌;Collier R 等[30]研究了数字PCR 在转基因植物检测方面的应用[31-32];周巍[33-34]等开发了数字PCR 在乳制品中致病菌检测方面的方法。这些研究表明数字PCR 具有快速、准确、通量高等优点,是食品微生物定量的重要技术。目前,国内外对嗜酸乳杆菌的精确定量检测研究报道较少。
本研究利用菌种特异性引物建立了嗜酸乳杆菌数字PCR 检测方法并在饮料中应用。方法特异性高,灵敏度达到0.25 pg/μL,且重复性好。实际样品检验结果表明方法定性定量准确,与标签宣称基本相符。该方法可用于饮料中嗜酸乳杆菌的定量检测。
