模拟氨碱法制备纯碱实验的探讨
2020-11-16王开华周彦
王开华 周彦

摘要: 通过定量实验探究吸收液温度、通气方式等对模拟氨碱法制备纯碱实验的影响,并优化了实验条件: 向饱和氨化食盐水中通入二氧化碳气体,开始1分钟通气应缓慢,然后以最大速率通气;采用38~45℃的温水浴可缩短反应时间。
关键词: 模拟氨碱法; 纯碱制备实验; 饱和氨化食盐水; 实验条件优化
文章编号: 10056629(2020)10007203
中图分类号: G633.8
文献标识码: B
1 问题的提出
人教版《化学与技术》“纯碱的生产”专题中,介绍了氨碱法与侯氏制碱法生产纯碱的原理,并对生产原理进行了模拟实验。但按课本中的实验操作,观察不到预期的实验现象,很多教师为此做了改进实验条件的探索。
陈国钦将二氧化碳气体通入氨化食盐水中,实验过程中,最短在12分钟看到明显浑浊[1]。王绪言利用改进后的实验装置,先向饱和氯化钠溶液中通氨气,然后通入二氧化碳气体,控制好实验条件,能够看到白色沉淀产生[2]。刘怀乐将二氧化碳气体通入饱和氨化食盐水中,将反应试管置于冷水中。饱和氨化食盐水的用量不同,得到沉淀的时间有差异,最短在5~10分钟出现明显浑浊[3]。张婷等向饱和氨化食盐水中通入二氧化碳气体,温度在42℃左右,采用“喷散式”吸收二氧化碳,通气速率保持气泡在240个/min左右,通气15分钟后可见晶体析出[4]。裴锐、赵华先向饱和食盐水中间歇性地通入半个小时的氨气,然后通入半个小时的二氧化碳气体,看到烧瓶底部有明显固体析出[5]。
总结以上氨碱法的模拟实验,得出实验的方法主要是两种: 一种是先向饱和食盐水中通入氨气,一段时间后再通入二氧化碳气体;另一种是将二氧化碳气体通入氨化食盐水中。
提出问题: (1)先通氨气再通二氧化碳气体的方法存在实验时间长(一般短则1小时左右),实验装置复杂,实验现象不明显,容易造成氨气泄露或倒吸等问题,不适合作为课堂实验。(2)将二氧化碳气体直接通入饱和氨化食盐水中,最短在10分钟左右出现明显浑浊,比较适合课堂实验。但也存在矛盾的情况,比如为了加快反应,有的认为应该将反应装置置于热水浴中,有的认为应该置于冷水浴中;另外对于二氧化碳气体的通入,始终都是一种通气速率,未曾考虑反应过程中通气速率的差别对产生沉淀时间和沉淀质量的影响。本文将重点探究通气方式、实验温度对实验结果的影响,寻找最佳实验条件,以期为课堂实验提供参考。
2 实验过程
2.1 实验材料与装置
2.1.1 实验材料
实验药品: 饱和氨化食盐水[将过量氯化钠固体加入浓氨水中,振荡,静置过夜,即得饱和氨化食盐水[6])、酚酞溶液、碳酸氢钠固体、硫酸溶液(浓硫酸与水1∶2稀释)]
仪器: 铁架台、圆底烧瓶、球形分液漏斗、橡胶管、15mm×150mm试管、导气管(带尖嘴)、200mL烧杯
2.1.2 实验装置
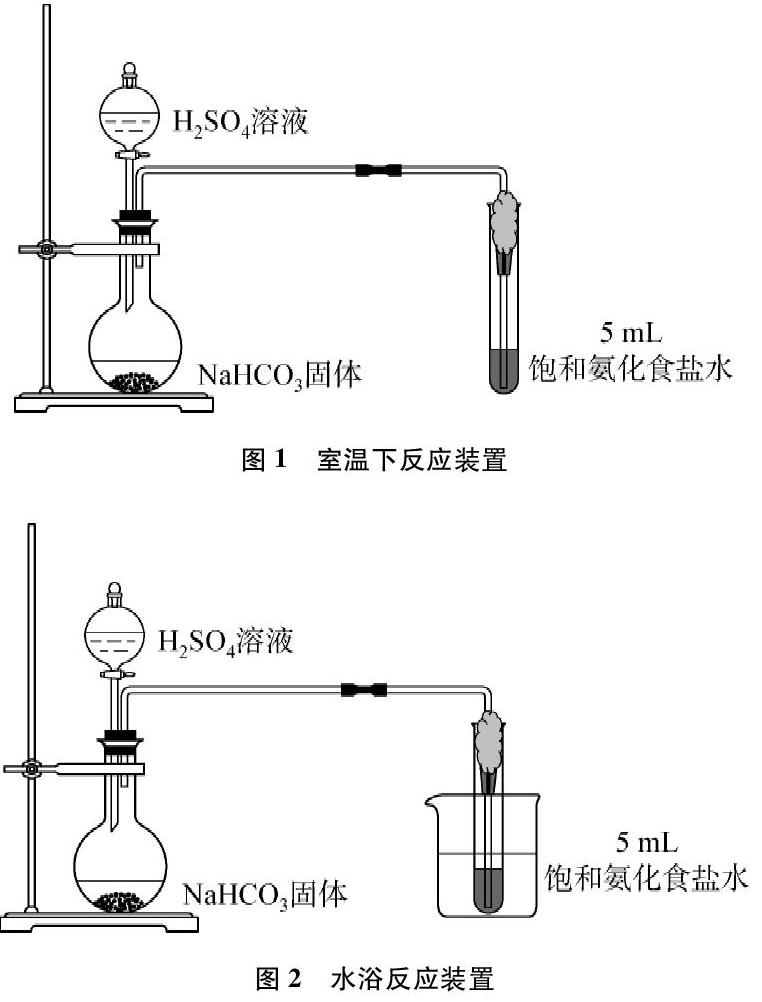
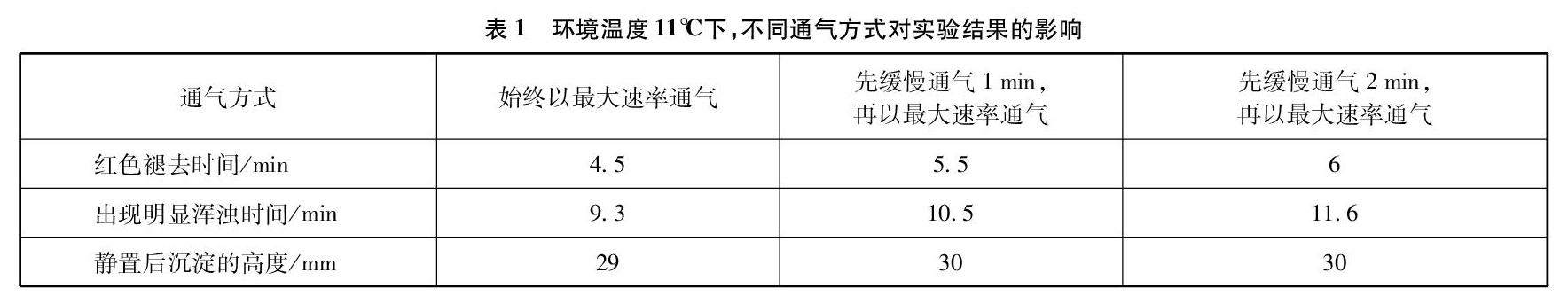
实验装置见图1、图2。
2.2 实验方法
饱和氨化食盐水每次均取5mL,滴入1滴酚酞溶液,盛有饱和氨化食盐水的试管口用一团棉花塞住,导气管的尖嘴直达试管底[7](粉碎气泡,气体与溶液有更好的接触)。
2.3 对照实验
2.3.1 通气方式对实验的影响
缓慢通气是指在液面上方可以形成气泡柱,气泡柱高度在5~10mm之间;最大速率通气是指气体将溶液冲起,形成气泡柱的高度大于10mm,但不与试管口的棉花接触;出现明显浑浊是以看不清试管内插入的导气管为准;静置后沉淀的高度,是指出现明显浑浊后再通气2分钟,并静置1小时后的沉淀高度。
酚酞溶液与饱和氨化食盐水混合,通过溶液颜色的变化能够监测到反应的发生。但无论选择哪种通气方式,溶液褪色以后,并没有立刻出现明显的浑浊,要继续通气4min左右才会出现浑浊,且很快沉淀增多,逐渐看不清试管内的导管。
实验结果(见表1)分析,不同的通气方式,收获沉淀的量差别不大。溶液红色褪去和出现明显浑浊的时间比较: 始终以最大速率通气<先缓慢通气1min,再以最大速率通气<先缓慢通气2min,再以最大速率通气。如果仅从缩短实验时间的角度,应采用“始终以最大速率通气”的方式。但是实验过程中,开始通气速率较快,实验装置周围会闻到强烈的刺激性气味,即使在棉花上滴几滴稀硫酸,仍然能够闻到。这是由于一开始氨水浓度大,通入二氧化碳气体太快会将氨气带出。而先缓慢通气2min,再以最大速率通气,整个过程闻不到任何刺激性气味,但是实验时间过长。若先缓慢通气1min,再以最大速率通气,实验过程中也几乎无任何刺激性气味,实验的时间相应缩短,因此这是一种比较理想的通气方式。缓慢通气的时间如果小于1min,则快速通气时就会出现明显的刺激性气味,说明仍有氨气被带出,且时间不易控制。
2.3.2 反应温度对实验的影响
为了防止氨气的扩散,通气时宜采用先缓慢通气1min,再以最大速率通气的方式。综合相关资料,我们将水浴温度控制在38~45℃[8,9],冷水浴选择实验室的自来水(5℃)作对比试验,实验结果列于表2中。
实验分析,溶液红色褪去和出现明显浑浊的时间比较: 温水浴(38~45℃)<无水浴(11℃室温)<冷水浴(5℃),因此在相同的通气方式下,随着实验温度的升高,实验所需时间缩短。
化学反应NaCl+NH3+CO2+H2ONaHCO3+NH4Cl(放热),实验过程中可以明显感受到试管外壁温度的升高。从理论上分析,降低温度应有利于平衡向着正反应方向进行,同时降低碳酸氢钠的溶解度。但从实验时间上看,温度降低造成反应速率下降,实验时间较长,而温水浴中实验时间较短,适合课堂实验。温水浴时,38~45℃这个温度范围都可以,这样可以避免实验时为维持一定温度而分散精力(课堂实验时,烧杯中的水加热至45℃,停止加热,将装饱和氨化食盐水的小试管放在烧杯中,至实验结束温度大约降至40℃)。当时实验的环境温度为11℃,若环境温度升高,比如将实验药品置于20℃的空调屋内8小时,则无需温水浴,实验8min后即可看到明显浑浊。
3 实验结果与讨论
氨碱法制备纯碱的实验,对于课堂演示,适合采用向饱和氨化食盐水中通入二氧化碳气体的方法。通入二氧化碳气体的方式,应先缓慢通气1min,再以最大速率通气。这样一来可减少氨气的逸出,避免环境污染,二来使反应更加充分,提高原料利用率。反应的温度宜采用38~45℃的温水浴,不适宜采用冷水浴的方式。若环境温度较高(如20℃以上),则无需温水浴,实验装置可进一步简化。
为了很好地指示反应的进程,向饱和氨化食盐水中滴入1滴酚酞试液,当溶液红色完全褪去后,还需继续通入二氧化碳气体4min左右,才能看到明显的浑浊。当溶液红色褪去以后,通入二氧化碳气体速率要快,一来加快化学反应速率,二来避免通气导管尖嘴处固体析出而堵塞气路。实验中选择碳酸氢钠固体与硫酸反应制取二氧化碳,可以保证“最大速率通气”,且硫酸滴速加快,产生二氧化碳气体的速率可以进一步提高。
纯碱制备原理的模拟实验,有助于学生对纯碱生产原理和工业生产流程的理解,将理论学习、科学探究以及生产实际三者联系起来,能更好地体会科学知识与科学方法的价值。
参考文献:
[1][7][8]陈国钦. 做好氨碱法实验的关键是什么[J]. 化学通报, 1957, (8): 67~69.
[2]王绪岩. 联合制碱法反应原理的模拟实验设计[J]. 化学教学, 2008, (5): 12~13.
[3][6]刘怀乐. 纯碱生产实验的秘诀[J]. 化学教学, 2011, (1): 48~49.
[4][9]張婷等. 模拟氨碱法制备纯碱实验的条件优化[J]. 化学教学, 2016, (6): 72~75.
[5]裴锐, 赵华. 趣玩化学, 感受化学制备的魅力——以“纯碱的制备实验”为例[J]. 中学化学教学参考, 2018, (6): 27~29.
