环状RNA作为生物标志物的研究进展
2020-11-16于越郁景文许秋梦凌新宇奚望张宇峰王志农
于越,郁景文,许秋梦,凌新宇,奚望,张宇峰,王志农
海军军医大学 长征医院 a.胸心外科;b.脊柱外科;上海 200003
环状 RNA(circular RNAs,circRNAs)是一类由前体mRNA(pre-mRNA)成熟时外显子反向剪切形成的单链闭合RNA。由于其不具有polyA尾,以往多聚腺苷酸RNA的分析研究中很少发现circRNA[1],对其产生及功能也不甚了解。近年来随着新一代测序技术的迅速发展,越来越多的circRNA进入人们的视线。目前研究已证实超过1万种circRNA广泛存在于动植物细胞、细菌、病毒和真菌中[2],部分circRNA在特定细胞或组织中高表达。circRNA的形成方式主要包括内含子配对驱动的成环(intron pairing-driven circularization)、RNA结合蛋白配对驱动的成环(RBP pair-ing-driven circularization)以及套索驱动的成环(lariat-driven circularization)[3]。绝大多数 circRNA存在于细胞质中,部分含有内含子的circRNA也可以定位于细胞核内[4]。研究发现,circRNA具有miRNA海绵(microRNA sponge)、调节转录和合成蛋白等功能,并且在肿瘤和心血管疾病等疾病的发生和发展中发挥了重要的调控作用。本文对circRNA的生成、调控、功能以及作为肿瘤生物标志物的潜能做简要综述。
1 circRNA的生成和特性
1.1 外显子circRNA的生成与调控
在真核细胞中,剪接体通过2次转酯反应切除pre-mRNA中的内含子,并将2个外显子连接起来,形成成熟的线性RNA。部分外显子circRNA的产生也依赖于此机制。Jeck等[5]提出外显子环化的2种方式,即套索驱动环化和内含子配对环化。套索驱动环化是pre-mRNA经外显子跳读(exon skipping)和典型剪接作用后产生线性RNA和套索,套索下游的3'端与上游的5'端相连成环后切除内含子形成外显子circRNA;外显子两侧的内含子通过互补配对序列结合,在空间上缩小了剪接供体与剪接受体的距离,两侧内含子相连接或被降解,脱落的外显子环化形成外显子circRNA,即内含子配对驱动环化。此外,RNA结合蛋白通过结合两侧内含子,也可发挥驱动环化作用。
套索驱动环化主要受外显子跳读调控,而内含子配对驱动环化主要受两侧的内含子序列尤其是反向互补序列调控。跨侧翼内含子的配对与单个侧翼内含子配对间的竞争调控着circRNA的成环效率。这些互补序列的选择性配对及其动态调控使得同一基因可产生多个circRNA,这种现象被称为可变环化(alternative circularization)。RNA 结合蛋白 QKI(quaking)、MBL(muscle blind)、NF90/NF110通过作用于侧翼内含子序列,发挥促进成环的作用[6]。RNA剪接因子作用于RNA的腺苷脱氨酶(adenosine to inosine acting on RNA enzyme 1,ADAR1),通过干扰侧翼互补序列从而抑制成环,而剪接体对成环效率无明显调控作用。此外,circRNA的形成还受外显子长度、微小 RNA(microRNA,miRNA)和自身的反馈调节[7]。
1.2 内含子circRNA的生成与调控
针对Ⅰ型和Ⅱ型内含子,目前认为存在不同的成环模型[8]。Ⅰ型内含子参与常规剪接。首先,细胞核内含鸟苷酸的辅酶以3'端羟基对5'端剪接位点发动亲核进攻,取代5'端外显子成为内含子的新5'端;随后游离的外显子3'端羟基进攻3'端剪接位点,释放线性内含子,使其与下游外显子连接。被释放的内含子2'端鸟苷对靠近内含子5'端的磷酯键进行亲核进攻,最终使5'端部分序列释放并形成2'-5'连接的Ⅰ型内含子circRNA。此种方式的特点在于内含子不能完整保留成环。外显子3'端剪接位点水解后,鸟苷进攻5'端剪接位点进而环化形成保留全长的Ⅰ型内含子circRNA;而3'端外显子释放后,暴露的内含子末端2'端羟基进攻5'端剪接位点形成2'-5'连接的Ⅱ型内含子circRNA[8]。内含子环化主要受5'端剪接位点附近的一段7 nt左右富含GU碱基的序列以及一段11 nt左右富含C碱基的结构等保守序列的调控。
1.3 circRNA的代谢
circRNA稳定的闭合环状结构使其不具有线性RNA的3'和5'端,因此能抵抗绝大部分以3'和5'端为作用靶点的RNA酶的降解作用。circRNA主要被部分miRNA、小干扰RNA(small interfering RNA,siRNA)和蛋白质降解,胞外囊泡(extra cellular vesicles,EVs)的外排作用也可以清除胞内积蓄的circRNA[9]。小脑退行性相关蛋白基因(cerebellar degeneration-related gene 1,CDR1)反义链转录的circRNA因子CDR1as又被称为ciRS-7(circular RNA sponge for miR-7),可被 miRNA效应因子AGO(argonaute)蛋白家族结合并降解,也可以被miR-671降解[9]。
2 circRNA的功能
2.1 circRNA与RNA相互作用
研究发现,部分circRNA存在miRNA结合位点,可发挥miRNA海绵的作用,在竞争性内源性RNA(competing endogenous RNA,ceRNA)调节网络中扮演重要角色[10]。例如CDR1as拥有74个miR-7结合位点,可对miR-7起负性调控作用,影响其靶基因的表达;CDR1as过表达能大量结合miR-7,导致其靶基因表达水平升高[11]。Y染色体性别决定区(sex-determining region Y,SRY)产生的circRNA拥有16个miR-138的结合位点,可结合miR-138进而调控miR-138下游靶基因的表达水平[11]。此外,circRNA也可以与细胞外源性miRNA结合。例如circRNA可与病毒miRNA结合,从而影响免疫应答过程[12]。Li等[13]研究发现,一些由外显子环化形成的circRNA可与U1核内小分子 RNA(small nuclear RNA,snRNA)和多种蛋白结合形成复合体,进而与RNA聚合酶Ⅱ转录复合物相互作用促进基因表达。
2.2 circRNA与蛋白质相互作用
2.2.1 调控基因表达 circ-ankrd52和circ-sirt7可与RNA聚合酶Ⅱ相互作用调控转录。通过设计不同的反义核苷酸(antisenseoligode-oxynucleotide,ASO)抑制 circ-ankrd52和 circ-sirt7的表达,发现ANKRD52和SIRT7基因的转录产物减少,证明部分circRNA可以通过结合RNA聚合酶Ⅱ促进其亲本基因的转录[14]。
2.2.2 参与抗病毒免疫反应 与病毒感染相关的免疫因子NF90/NF110可以与外显子两侧配对序列结合促进circRNA的形成,同时可与circRNA结合形成circRBP复合体。当细胞被某些病毒感染时,NF90/NF110会与circRBP复合体解离并快速转运至细胞质,进而结合病毒mRNA,抑制病毒mRNA的翻译与病毒复制。circRNA及其生成过程正是通过与NF90/NF110的协调互作,间接参与了人体抗病毒免疫[14]。
2.2.3 促进伤口愈合 Yang等[15]利用穿刺针在同一小鼠背部两侧建立了创伤模型,分别注射过表达 circ-Amotl1(circular angiomotin like 1)载体和对照载体,结果发现注射circ-Amotl1的创口愈合明显好于对照创口,H-E染色和免疫组化显示注射circ-Amotl1后创口处组织的愈合再生活动增强,这与circ-Amotl1促进成纤维细胞的增殖活性有关。
2.2.4 参与细胞衰老进程 缺氧诱导因子(hypoxia inducible factor 1α,HIF-1α)和局部黏着斑激酶(focal adhesion kinase,FAK)具有抑制细胞衰老的作用。研究发现,某些心脏病患者的心肌组织中circ-Foxo3的表达显著升高,circ-Foxo3能与FAK和HIF-1α结合并抑制其功能,从而加速心肌细胞的衰老进程[16]。
2.3 circRNA的翻译功能
研究发现,水稻黄斑类病毒circRNA等外源性circRNA可在真核细胞内翻译成蛋白质。该类circRNA拥有一个内部核糖体进入位点和2~3个开放读框(open reading frame,ORF),可直接翻译为相对分子质量16 000的基础蛋白[17]。大肠杆菌和人类细胞中的circRNA可通过滚环扩增(rolling circle amplification,RCA)机制生成多种蛋白产物[16]。近期研究人员构建了转基因模型进行蛋白组学分析,发现ZNF609基因的第2外显子环化形成的内源性circ-ZNF609可直接翻译成某种与肌肉发生相关的蛋白质,但其翻译效率远低于线性RNA[17]。
3 circRNA与肿瘤
3.1 circRNA-miRNA轴调控肿瘤信号通道
circRNA作为一个重要的miRNA调节因子,通过发挥miRNA海绵作用进行基因调控。研究发现,ciRS-7/miR-7轴可在多种肿瘤相关路径中发挥作用。miR-7能直接作用于靶基因mRNA并下调表皮生长因子受体(epidermal growth factor receptor,EGFR)等的表达;在乳腺癌中,miR-7/Pakl通路具有调控低侵袭性乳腺癌表型向高侵袭性乳腺癌表型转化的作用;miR-7还可以通过下调组蛋白赖氨酸N端甲基转移酶SET结构域分支型 1(histone-lysine N-methyltransferase 1,SETDB1)减少转录信号转导子与激活子3(signal transducers and activators of transcription 3,STAT3)的表达,从而抑制乳腺癌细胞上皮间质转化(epithelial-mesenchymal transition,EMT)进程,发挥抑制肿瘤细胞转移的作用;在肝癌细胞中miR-7可减少磷脂酰肌醇3-激酶催化亚基δ的表达并影响肝癌细胞的迁移能力。Xu[17]发现miR-7可减少干扰素诱导蛋白P56的表达并激活转录因子核因子κB(nuclear factor-κB,NF-κB),发挥抑制肝癌细胞转移的作用。此外,ciRS-7/miR-7轴可通过调节miRNA的靶基因对肿瘤发挥双向调控作用。环状 ITCH(cir-ITCH)发挥由 Wnt/β-catenin信号转导通路介导的miR-7海绵作用,参与结肠癌的发生和发展;cir-ITCH还可竞争性结合miR-7、miR-17和miR-214,抑制食管癌细胞的生长。
3.2 circRNA调控肿瘤发生和发展的其他方式
ci-mcm5、ci-sirt等circRNA作为转录调控因子可增强亲本基因的转录过程,促进或抑制肿瘤的发生和发展[18]。例如CZNF292通过减少胶质瘤细胞内周期蛋白A、周期蛋白依赖性激酶2(cyclin-dependent kinases 2,CDK2)、β-catenin、p-STAT3(Tyr705)和p-STAT5(Tyr694)的表达,抑制肿瘤细胞增殖和肿瘤周围血管形成;CZNF292表达下调将导致 NF-κB、Sp1、HIF-1、AP-1(activator protein 1)、STAT3等相关因子对应基因的转录水平下降,从而抑制肿瘤细胞形成[18]。circRNA还可与RBP如QKI、AGO、MBL等结合并在肿瘤的发生和发展中发挥重要作用[19]。RNA结合蛋白QKI-5在多种肿瘤中发挥抑制作用。肿瘤的EMT与肿瘤的侵袭性密切相关,同时circRNA表达水平上调参与对EMT的调控。研究发现circRNA的生成受QKI的调控,这提供了一种由QKI介导的以circRNA为靶点的新的癌症治疗方法[19]。此外,circ-Foxo3可通过与细胞周期蛋白依赖性激酶抑制剂P21及细胞周期蛋白依赖性激酶CDK2形成复合体阻碍细胞周期的进程;在肿瘤细胞中circ-Foxo3的表达量降低,细胞增殖加快。c-Myc是一种重要的转录因子,circ-Amotl1可诱导c-Myc进入细胞核并增强其结合下游基因启动子的能力,促进肿瘤细胞的增殖。将PML-RARα融合基因外显子产生的融合circRNA(f-circRNA)转入白血病小鼠的细胞中,发现其具有加速细胞增殖的促癌作用;此外,circRNAf-circM9还具有增强肿瘤细胞耐药性的作用[20]。
3.3 circRNA与肿瘤外泌体
外泌体是一种多形性囊泡状小体,可由各种类型的细胞分泌并广泛分布于各种体液中。外泌体可携带蛋白质、脂质、RNA等多种细胞成分;它既可被细胞释放,也能被细胞摄取,是一种细胞间的信息传递系统。在肿瘤细胞中,外泌体通过释放蛋白质和mRNA等物质促进血管再生和细胞增殖,提高肿瘤细胞的存活率。研究发现,超过1000种circRNA存在于血清中的外泌体中,且含量显著高于其对应的线形RNA。circRNA进入外泌体被排出细胞的过程受胞内与之相关的miRNA水平的调节。Li等[21]研究发现与健康人群的血清样本相比,结直肠癌患者的血清外泌体中有67种circRNA表达上调[20],并且新产生了257种circRNA,而这些circRNA的来源基因在肿瘤组织中也显著上调,提示血清中circRNA的含量与肿瘤组织中某些基因的表达变化有关,而外泌体中的circRNA是否参与肿瘤的发生和发展须进一步研究证实。血清外泌体中的circRNA在肿瘤患者与健康人群中呈差异性表达,表明其具有成为一种新型肿瘤诊断标志物的潜力[21]。
4 circRNA作为肿瘤生物标志物的研究进展
越来越多的研究表明circRNA在肿瘤的发生和发展中扮演重要角色,同时,circRNA具有含量丰富、结构稳定、时空特异性和组织细胞特异性等特征,且可在唾液、血液、外泌体中被检出。因具备上述特征,circRNA作为肿瘤生物标志物已逐渐成为研究热点(表1)。
4.1 筛查或诊断肿瘤
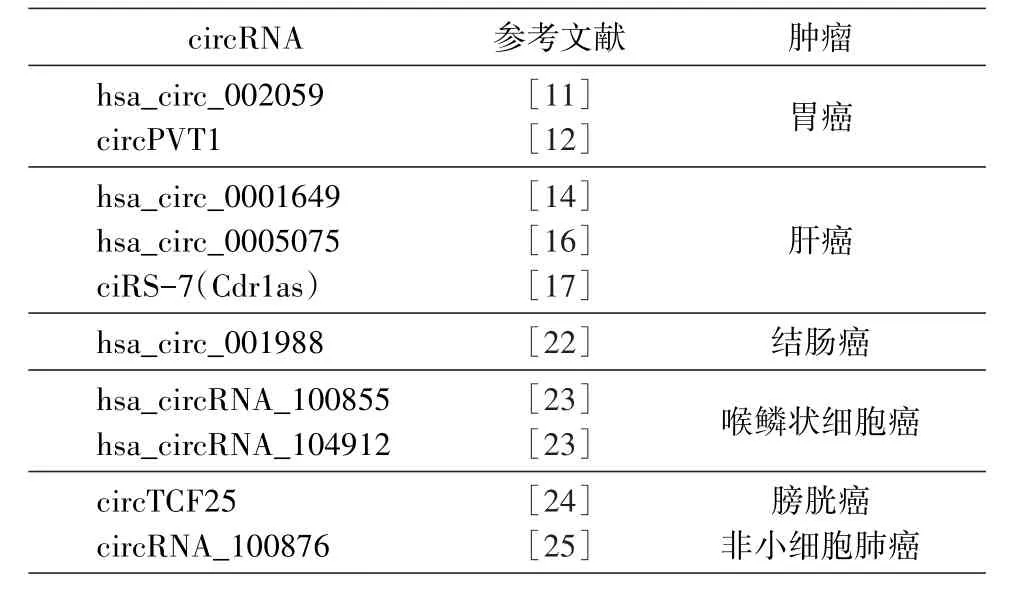
表1 circRNA作为肿瘤生物标志物
Nair等[26]发现了乳腺癌肿瘤组织中1155种特异性表达的circRNA,与周围正常组织相比有715种表达上调。在疾病的相关性分析中,联合circ-006054、circ-406697和circ-100219进行分析后发现,受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)达到0.82,提示联合应用这3种circRNA可以作为较好的乳腺癌生物标志物[26]。在胃癌患者的肿瘤组织和血浆中,circ-000190表达显著下调;与传统的胃癌生物标志物癌胚抗原(CEA)和CA19-9相比,circ-000190具有更高的敏感度和特异度,提示circ-000190具有作为诊断胃癌生物标志物的潜能。此外,hsa_circ_0002059可能与胃癌的发生相关,胃癌患者外周血血清中可检测出hsa_circ_0002059,且其表达量高于健康人群,提示外周血中hsa_circ_0002059的表达具有作为胃癌生物标志物的潜能。研究发现,hsa_circ_0001649的表达在肝细胞癌(hepatocellular carcinoma,HCC)组织中显著下调。与癌旁组织相比,肝癌组织中hsa_circ_0005075的表达存在差异,且hsa_circ_0001649的表达量与肝癌组织大小相关。
4.2 判断肿瘤转移与预后
研究发现,非小细胞肺癌(non-small cell lung carcinoma,NSCLC)组织中表达水平上调的circRNA_100876与肺癌的淋巴结转移和分期密切相关,提示circRNA_100876可作为判断NSCLC转移和预后的潜在生物标志物[25];circTCF25是一种与胃癌细胞增殖相关的circRNA[24]。一项包含187例临床样本的相关性分析结果显示,circPVT1高表达患者的生存率更高。提示circPVT1可能是一项独立于肿瘤大小、TNM分期的可用于判断胃癌患者预后的临床指标。
4.3 预测肿瘤复发
胃癌复发常出现在Ⅲ期患者接受根治性切除术后1年内。Zhang等利用circRNA芯片发现了46种在肿瘤组织中特异性表达的circRNA,最终建立了以4种circRNA为基础的临床标本术后复发预测体系,该方法的AUC值达0.764,高于对照组的0.711,表明联合检测这4种circRNA的表达可成为监测Ⅲ期胃癌根治性切除术后复发的生物标志物。
4.4 circRNA和其他肿瘤生物标志物
肿瘤外泌体的分子特征可部分反映其来源肿瘤的表型,它所携带的肿瘤特异性抗原和miRNA可以作为肿瘤诊断标志物。在包括膀胱癌、结直肠癌和黑色素瘤等在内的多种肿瘤临床病例中,均可以从患者血清、尿液等体液中分离得肿瘤外泌体用于早期诊断。circRNA作为一种新型的潜在生物标志物,与传统肿瘤生物标志物关系密切。研究表明,HCC患者ciRS-7的表达水平与甲胎蛋白(AFP)和微血管侵犯(MVI)有关。此外,hsa_circ_0005075分别与传统HCC生物标志物miR-93和miR-182有潜在的结合位点。因此,将circRNA与传统肿瘤生物标志物联合运用,可能是相关疾病诊断的更有效的方法与途径。
5 结语
目前关于circRNA的种类、来源、生物学特征以及功能等已有一定认识,但与其他RNA相比,对于circRNA的研究仍处于起步阶段。circRNA的表达调控、对miRNA的海绵作用、对基因的转录调控、病毒调控作用、蛋白质的翻译,以及其与疾病的关联等均须更深入的探讨。已有肿瘤疾病相关研究将血液中的circRNA与现有临床生物标记物进行比较,试图发掘circRNA单独或联合应用于临床诊断的前景,并且在某些肿瘤中已经初步证实了其潜在的应用价值。circRNA的特异性和稳定性或许会成为其作为生物标记物的关键优势。虽然尚不能断言circRNA一定可用于疾病的诊断、疗效判断及预后等,但随着circRNA研究手段和方法的不断进步和完善,有理由相信未来circRNA的价值会被更多地挖掘,circRNA在临床方面的研究必将呈现突破性进展。
