TNF-α诱导的NF-κB慢病毒报告基因系统的构建
2020-11-16周晨辰查玉华张硌
周晨辰,查玉华,张硌
解放军总医院 第五医学中心南院区医学工程科,北京 100071
核因子NF-κB是1986年发现的一种转录因子,因它与活化B细胞的免疫球蛋白κ轻链的增强子元件结合而得名[1]。NF-κB家族包含5个成员,即 NF-κB1(p105和 p50)、NF-κB2(p100和p52)、c-Rel、RelB和 RelA(p65)[2]。这些蛋白质共享一个Rel同源域(RHD)[3],该域介导DNA结合、二聚化,以及与特定抑制因子IκB的相互作用使其处于非激活状态。上游信号如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等激活 NF-κB信号通路,进而促使IκB降解,释放的NF-κB二聚体进入细胞核与相应的位点结合,进而调节编码细胞因子、生长因子、促凋亡或抗凋亡蛋白等多种基因的转录[4-5]。
我们利用报告基因编码易于检测的酶或蛋白的性质,通过对现有慢病毒载体的改造[6-7],构建了一种由上游激活序列UAS和NF-κB响应元件作为转录调控顺式元件,以Pmin为启动子,以GalVP64为放大调控因子,以mCherry为报告基因序列的表达载体,并进一步构建了受NF-κB调控表达mCherry荧光蛋白的细胞株。该细胞株可用于NF-κB活化状态的检测以及与NF-κB活化调控相关药物的筛选。
1 材料与方法
1.1 材料
293T、RAW264.7细胞,载体pCDH-GFP-PuronoCMV由本实验室保存;感受态大肠杆菌DH5α、质粒提取试剂盒及DNA电泳凝胶回收试剂盒购自天根生化科技(北京)有限公司;限制性核酸内切酶EcoRⅠ、BamHⅠ,Q5高保真聚合酶,PCR试剂,DNA聚合酶,dNTPs购自NEB公司;DMEM购自Thermo Fisher Scientific公司;胎牛血清由Gibco公司生产;Lipo2000购自Invitrogen公司;PCR引物由生工生物工程(上海)有限公司合成;UASSSCc-GV64mCherry表达调控序列由苏州鸿讯科技合成。
1.2 质粒的构建与鉴定
用EcoRⅠ、BamHⅠ分别双酶切pCDH-GFPPuro-noCMV载体与UAS-SSCc-GV64mCherry表达调控序列,酶切产物连接构建为pCDH-UNPG-mCherry(图1),转化大肠杆菌DH5α感受态并扩大培养,挑取单克隆,提取质粒,用EcoRⅠ、BamHⅠ双酶切鉴定。
1.3 慢病毒包装
将293FT细胞接种于平皿中,细胞密度达70%~80%时开始转染。总质粒转染量为9 μg,包括 PMD 1.5 μg、SPA 3 μg、pCDH-UNPG-mCherry 4.5 μg。转染后8 h或过夜更换无抗生素培养基,36~48 h再补充5 mL无抗生素培养基。转染后72 h收上清,用0.22 μm滤器过滤。为提高病毒滴度,用10K离心过滤器4000 r/min离心20 min浓缩含病毒上清,-20℃保存或立刻使用。
1.4 RAW264.7细胞的感染及筛选
待感染的对数生长期RAW264.7细胞接种至6孔板中,加入50 μL浓缩后的病毒,8 h后更换新鲜培养基,4~5 d可见部分细胞发绿色荧光。此时用5 μg/mL嘌呤霉素处理细胞24 h,然后换为新鲜的完全培养基以促进细胞生长,扩大培养后于荧光显微镜下观察荧光。
1.5 稳定表达细胞系的有效性验证
将上述获得的稳定表达细胞计数,按1×105/孔加入24孔板,待细胞长至80%后加入10 ng/mL的NF-κB信号通路刺激物TNF-α,12 h后于荧光显微镜下观察荧光。
2 结果
2.1 慢病毒报告基因pCDH-UNPG-mCherry质粒的鉴定
重组慢病毒表达质粒pCDH-UNPG-mCherry经EcoRⅠ、BamHⅠ双酶切后得到约9000和1500 bp的2条带,与pCDH-GFP-Puro-noCMV和UASSSCc-GV64mCherry的长度相符,并经测序鉴定正确(图2)。
2.2 pCDH-UNPG-mCherry RAW264.7细胞株的验证
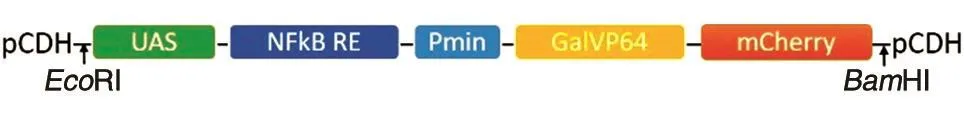
图1 pCDH-UNPG-mCherry构建示意图
用包装好的pCDH-UNPG-mCherry慢病毒感染RAW264.7细胞,构建的慢病毒表达载体包含mCherry基因片段,导入细胞后能够表达具有绿色荧光蛋白特征的融合蛋白,在488 nm激发光照射下产生稳定的绿色荧光。加入TNF-α刺激12 h后NF-κB信号通路激活,解离出的NF-κB与质粒中的NF-κB响应元件结合,启动mCherry基因片段的转录和表达,并在590 nm激发光照射下产生稳定的红色荧光。
如图3所示,TNF-α诱导组的细胞有较强的mCherry表达,阳性率约为90%,而未加TNF-α组细胞mCherry阳性表达率约为10%。结果表明所构建的慢病毒质粒已在RAW264.7细胞内表达,受NF-κB调控表达mCherry荧光蛋白的pCDHUNPG-mCherryRAW264.7细胞株已成功建立,TNF-α诱导的NF-κB慢病毒报告基因系统已构建成功。
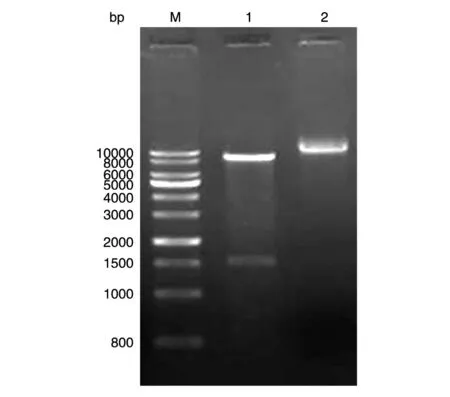
图2 重组质粒pCDH-UNPG-mCherry的酶切电泳验证
3 讨论
NF-κB信号通路在多种生理和病理过程中起重要作用。激活的NF-κB通过介导靶基因来抑制正常细胞或癌细胞凋亡,促进细胞存活[8-9]。NF-κB还可以通过调控编码抗氧化因子的基因来防止程序性坏死。鉴于其在癌症发生和进展中的作用,NF-κB信号通路是药物干扰的一个强有力的靶点[10-13]。目前,对于NF-κB的鉴定主要是通过鉴定其信号通路特异性标志物来实现的,由此衍生出许多方法,如Q-PCR、流式分选、Western印迹、免疫荧光,但这些方法大多步骤较为繁琐,实验周期较长。
本实验通过将NF-κB的反应元件与mCherry结合并构建在慢病毒表达载体中,将载体转染目的细胞,通过荧光的有无来鉴别目的细胞对NF-κB活性的响应,从而起到分选鉴别NF-κB激活的作用。利用这种“开关”效应可极大地提高实验效率,并可直接用于以TNF-α或其受体家族为靶点的药物筛选及活性检测。由于NF-κB是细胞内多个信号通路的交汇点,因此该细胞系具备通用性,具有研究及应用价值
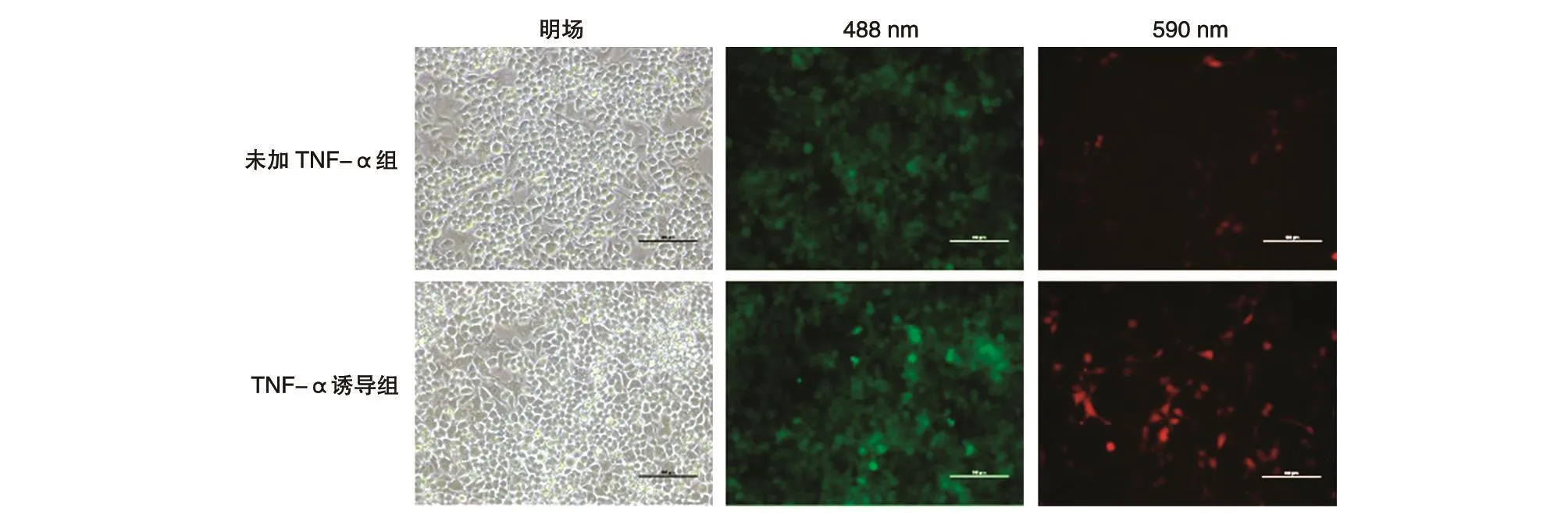
图3 pCDH-UNPG-mCherry RAW264.7细胞株的鉴定
