新型冠状病毒N蛋白原核可溶性表达与血清学评价
2020-11-16侯江厚孙卫国黄国红詹晓燕杨奕梅
侯江厚,孙卫国,黄国红,詹晓燕,杨奕梅
1.昆明市妇幼保健院,云南 昆明 650013;2.解放军总医院 第八医学中心,北京 100091
新型冠状病毒肺炎(coronavirus disease 19,COVID-19)是新型冠状病毒(SARS-CoV-2)感染引起的以肺部病变为主的新发传染病,可引起消化系统和神经系统损伤,严重者可导致死亡[1]。目前针对COVID-19还没有特效治疗药物,疫苗也处于临床试验阶段,患者的早诊断、及时收治和隔离对有效控制疫情至关重要[2]。新冠病毒感染的大量排查主要采用核酸检测,因其敏感性强而成为疑似病例确诊的金标准[3]。但该技术对实验场所及人员要求高,操作繁琐,受环境条件影响较大,容易受气溶胶的污染而出现假阳性[4]。传统的抗原抗体反应是临床实验室检测的重要补充,利用抗原检测感染者血清中的抗体是快速筛查和核酸辅助诊断的重要手段。目前很多公司已开发出用于COVID-19临床诊断的血清学检测试剂盒,如胶体金法和传统ELISA法,筛选出SARS-CoV-2中保守的具有优势表位的抗原或联合抗原是血清学诊断成功的关键。SARS-CoV-2基因大小约为29.8 kb,基因组含有14个开放读框(ORF),共编码 27~28个蛋白质[5]。N 蛋白是SARS-CoV-2的核衣壳蛋白,位于病毒内部,是干扰素(IFN)的拮抗剂和病毒编码的RNA干扰抑制因子,与病毒复制有关[6]。β属冠状病毒的N蛋白相对比较保守,合成数量众多,具有很强的抗原性,在诱导宿主免疫应答甚至发病机制中发挥重要作用,常被用作冠状病毒诊断的抗原位点[7]。蛋白质中二硫键的形成是原核生物和真核生物蛋白合成的重要过程,重组蛋白的可溶性表达往往代表着蛋白正确的空间折叠方式,保持了蛋白的天然空间结构。为了保证新冠病毒N蛋白重组纯化过程的天然构象,我们将N蛋白与DsbC蛋白融合表达[8],充分利用DsbC蛋白二硫键异构酶和分子伴侣的生物特性,促使融合蛋白在重组表达过程中以可溶性的形式存在于上清中,提高SARS-CoV-2感染者的检出率,为以N蛋白为检测抗原开发血清学检测试剂盒打下基础。
1 材料与方法
1.1 材料
大肠杆菌 BL21(DE3)、质粒 pET-DsbC 由本室保存;SARS-CoV-2 N蛋白表达序列核酸载体pUC18-SARS-CoV-2 N由北京万域美澜科技公司沈春奇老师惠赠;质粒提取试剂盒、DNA凝胶回收试剂盒购于天根生物科技公司;限制性核酸内切酶、T4DNA连接酶购自NEB公司;KAPA高保真DNA聚合酶、dNTP购自北京阅微基因公司;亲和树脂购自友谊中联生物科技公司;羊抗人IgG、TMB显色液购自索莱宝生物公司;新型冠状病毒IgG抗体检测试剂盒(酶联免疫法)购自北京华大吉比爱生物技术公司,酶标板条上包被有SARSCoV-2全病毒裂解液;30例临床确诊COVID-19患者血清、50例健康人血清由生物公司收集,ELISA实验委托公司完成,严格按照生物安全有关规定操作,遵循实验室操作的常规规定。
1.2 SARS-CoV-2 N蛋白核酸扩增引物的设计与合成
根据GenBank中的SARS-CoV-2 N蛋白核酸序列(MN908947.3),参照载体pET-DsbC多克隆位点,设计合成针对N蛋白核酸的特异引物,在下游引物的5'端引入大肠杆菌偏性的终止密码子TAA。上游引物为P1(5'-ACGCGTCGACTCTG ATAATGGACC-3'),下游引物为 P2(5'-CTAGCT AGCTTAGGCCTGAGTTGAGTCAGC-3'),上、下游引物末端分别引入SalⅠ和NheⅠ酶切位点(下划线序列)。
1.3 重组pET-DsbC-N融合表达质粒的构建
以载体pUC18-SARS-CoV-2 N核酸为模板,在热激TaqDNA聚合酶作用下,采用引物P1和P2,常规PCR扩增SARS-CoV-2 N核酸序列(扩增条件:94℃预变性5 min;98℃变性20 s,68℃退火 20 s,72℃延伸 80 s,30个循环;72℃延伸 5 min)。1%琼脂糖电泳验证扩增产物的大小,胶回收PCR产物,回收的产物和表达载体pET-DsbC均经SalⅠ和NheⅠ双酶切,1%琼脂糖电泳切胶回收酶切后的产物,在T4DNA连接酶的作用下把回收片段克隆到表达质粒pET-DsbC中,连接产物转化大肠杆菌感受态细胞BL21(DE3),筛选阳性克隆进行测序。
1.4 DsbC-N融合蛋白的原核可溶性表达
将经公司测序正确的DsbC-N融合蛋白工程菌接种于含50 ng/mL卡那霉素的LB培养基中,置于摇床内37℃振荡培养激活,次日按1∶50的比例转接到同样体系的LB培养基中,37℃振荡培养至菌液D600nm达0.4,加入终浓度为0.3 mmol/L的IPTG,37℃继续振荡培养诱导5 h。诱导后的菌液于4℃、5000 r/min离心收集菌体,沉淀菌体加入1×PBS缓冲液混匀后,冰浴状态下超声波破碎,4℃、12 000 r/min离心30 min,收集上清和沉淀,12%SDS-PAGE鉴定融合蛋白DsbC-N在原核系统内的表达形式。
1.5 DsbC-N融合蛋白的亲和纯化
融合蛋白DsbC-N的N端带有6×His标签,可利用亲和层析对上清蛋白进行纯化。4℃条件下取离心后的上清,按2 mL/min的速度过镍离子亲和柱,以1×PBS平衡4个柱体积后,用100 mmol/L咪唑洗脱杂蛋白3个柱体积,再用200 mmol/L咪唑洗脱目的融合蛋白,收集目的蛋白,以15%SDS-PAGE对纯化后的融合蛋白进行纯度测定。
1.6 DsbC-N融合蛋白的血清抗体ELISA实验
纯化的DsbC-N融合蛋白经水充分透析后,采用BCA方法进行浓度测定,以包被液将重组蛋白稀释为 15 μg/mL,酶标板每孔包被 100 μL,室温放置2 h,PBST缓冲液洗板4次;用10%小牛血清在4℃冰箱内封闭过夜,次日用PBST洗板5次,待测样本血清和健康人血清均以1∶50稀释,每孔加入100 μL,于 37℃温箱内孵育 1 h,洗板5次,拍干,以1∶1000稀释的HRP标记的羊抗人IgG于37℃孵育1 h,PBST洗板5次,TMB显色,酶标仪检测D450nm值。待测的30份经核酸检测阳性血清和50份健康者血清以新型冠状病毒IgG抗体检测试剂盒进行对比检测,实验严格按照试剂盒说明书进行。分析结果。
2 结果
2.1 SARS-CoV-2 N核酸序列PCR扩增与表达载体构建
以载体pUC18-SARS-CoV-2 N为模板,PCR扩增获得SARS-CoV-2 N核酸序列,1%琼脂糖电泳验证产物,结果如图1,在约1260 bp处存在清晰单一的条带。SARS-CoV-2 N蛋白全长420个氨基酸残基,对应基因大小为1260 bp,实验结果符合理论值。
对PCR产物进行胶回收,通过基因克隆技术,将SARS-CoV-2 N核酸连接到表达载体pETDsbC上,转化大肠杆菌BL21(DE3),筛选阳性克隆并测序保存。
2.2 DsbC-N融合蛋白的原核表达形式分析
将测序正确的pET-DsbC-N载体工程菌接种于含卡那霉素的LB培养基中,在37℃条件下进行扩增培养和诱导表达,表达的菌体经超声波破碎后,分别取上清和沉淀用12%SDS-PAGE鉴定融合蛋白DsbC-N在原核系统内表达形式,结果如图2。DsbC-N融合蛋白在原核系统内获得较高表达,融合蛋白占菌体总蛋白的30%以上。超声波破碎后,发现融合蛋白主要以包涵体的形式存在于菌体沉淀中,但有约30%的融合蛋白存在于上清中。上清中的蛋白通常为天然状态,因此收集超声波破碎后的上清准备亲和纯化。
2.3 DsbC-N融合蛋白的亲和纯化
用100 mmol/L咪唑洗脱杂蛋白,200 mmol/L咪唑洗脱目的融合蛋白,收集目的蛋白,15%SDS-PAGE分析纯化后蛋白的纯度,结果如图3。融合蛋白经亲和纯化后,纯度可达92%以上,高纯度的重组蛋白是后续开展血清学实验获得高特异性的保证。
2.4 DsbC-N融合蛋白的血清抗体ELISA实验
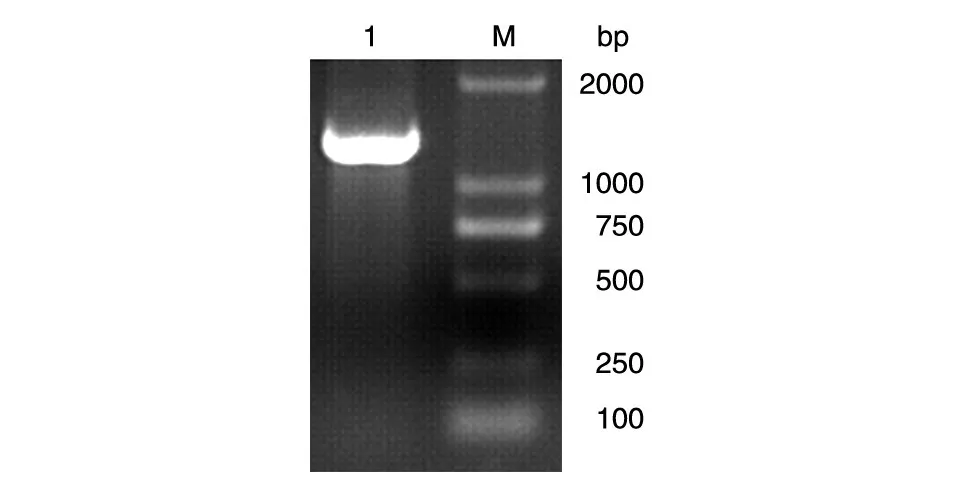
图1 SARS-CoV-2 N蛋白核酸PCR序列凝胶电泳鉴定
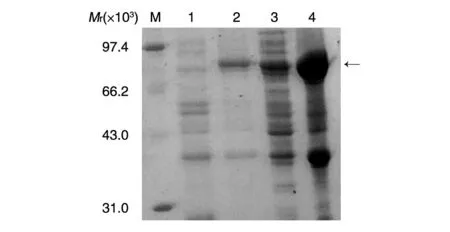
图2 DsbC-N原核系统内表达形式分析
用新型冠状病毒IgG抗体检测试剂盒对待测的30份阳性血清和50份健康者血清进行初检,结果出现1例假阴性,检出率为96%;出现假阳性2例,特异性为96%。重组DsbC-N融合蛋白抗原经稀释后包被过夜,最佳原始包被浓度为15 μg/mL,待测血清最佳稀释度为1∶50。常规操作进行血清学ELISA分析,结果见图4,SARS-CoV-2感染者阳性血清相对健康人血清而言,ELISA实验中D450nm值具有显著性差异。其中30例明确新冠肺炎血清阳性检出例数为29例,检出率为96%;50例健康人对照血清检出1例,检出率为2%,特异性为98%。本实验设定cut-off值为健康人血清检测平均D450nm值+3倍标准差。
3 讨论
截至2020年8月20日,全球感染SARS-CoV-2的人数超过2000万。在早期检测中,核酸检测发挥了巨大作用,达到了早诊断、早隔离的目的。随着新冠病毒基因组序列的解析,各结构蛋白的表达序列被测序,重组诊断抗原开始发挥作用。病毒感染机体时,机体血清抗体中IgM出现最早,是急性期感染的诊断指标,但IgM浓度低,维持时间只有1周左右,并且亲和力低;IgG抗体产生较晚,能提示感染中后期或存在既往感染,并且IgG浓度高,维持时间长,亲和力高[9]。已有多家生物公司研发出检测SARS-CoV-2 IgM和IgG抗体的方法,为新型冠状病毒感染的辅助诊断和流行病调查提供了极好的检测手段。抗体检测的特异性与抗原位点的保守性密切相关,SARS-CoV-2的N蛋白是COVID-19检测的主要抗原位点[10],目前临床新冠病毒检测试剂盒大多采用N蛋白抗原或刺突蛋白(S蛋白)抗原,或者二者联用的方法检测血清抗体。为了提高N蛋白抗原在血清学诊断中的敏感性和特异性,同时提高N蛋白在原核重组中表达量,在本课题中我们将N蛋白与DsbC融合表达。在原核重组表达系统中,可溶性表达往往代表重组蛋白具有正确的空间折叠,保证了检测抗原的空间表位。利用DsbC蛋白分子伴侣和二硫键异构酶的生物学特性,获得了SARS-CoV-2 N蛋白的可溶性表达,很好地保证了在血清学诊断中的检出率。
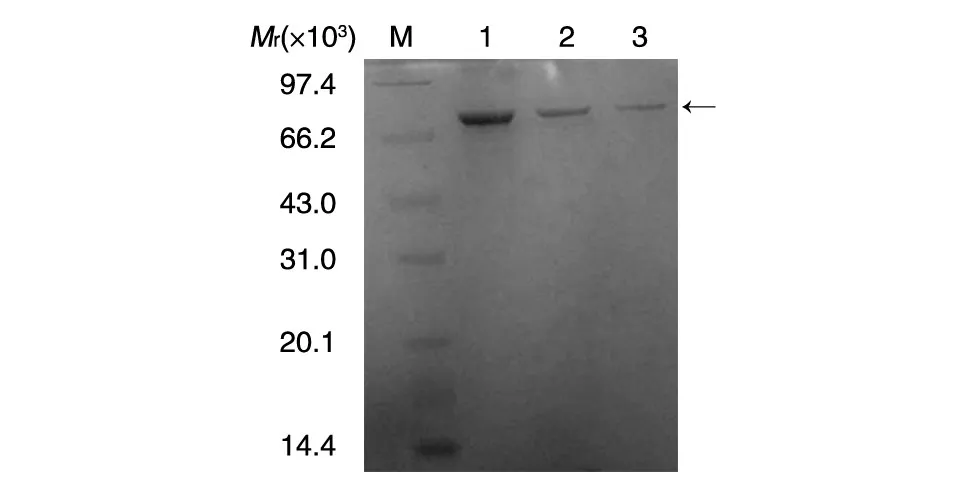
图3 DsbC-N融合蛋白亲和纯化SDS-PAGE分析
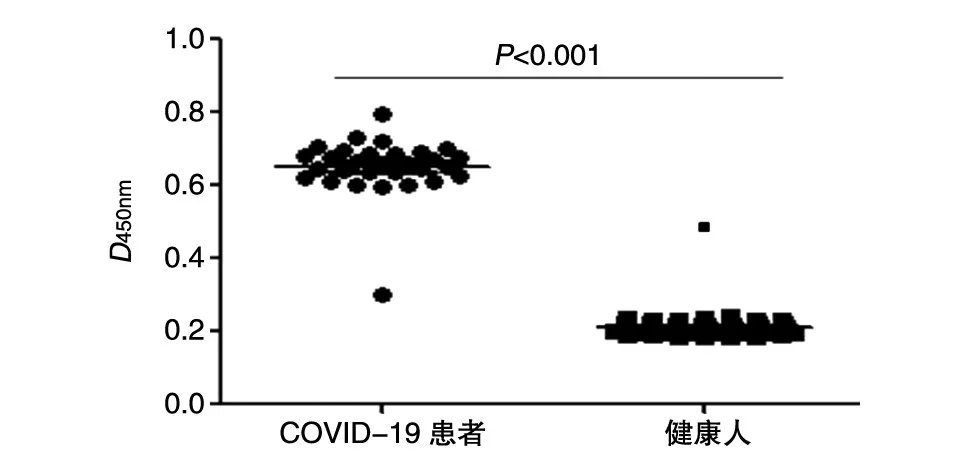
图4 DsbC-N融合蛋白的血清学ELISA分析
ELISA通常用于进展期和恢复期患者血清病毒的抗体检测[11],是一种传统的实验室检测技术,操作要求相对较低,可以明确患者是否近期或既往感染过SARS-CoV-2,有助于核酸检测阴性但临床上疑似患者的确诊。本课题中,我们利用融合重组N蛋白,采用ELISA方法检测明确感染者的血清抗体,在30例阳性样本中检出29例,阳性率可达96%,与现有IgG检测试剂盒的符合率为100%;在50例阴性样本中检出1例,特异性为98%。漏检1例,推测样本来源患者可能处于“窗口期”,虽然核酸检测为阳性,但患者血液内还无法检测到抗体,或者是血清在长时间保存过程中出现抗体聚集或降解,没有被抗原捕捉。本课题获得的可溶型重组SARS-CoV-2 N蛋白的融合蛋白用于血清学诊断的敏感性强,特异性高。当然,由于受国内患者样本来源枯竭的影响,没有通过大样本量进行验证。后续将与公司合作,明确该融合蛋白在血清学诊断上的可行性,开发临床检测试剂盒,以控制SARS-CoV-2传染,做到早诊断、早隔离、早控制。
