茯苓抑制小肠收缩的作用机制△
2020-11-16肖洪贺张明波郭周全杨静娴
肖洪贺,张明波,郭周全,杨静娴
辽宁中医药大学 药学院,辽宁 大连 116600
茯苓为多孔菌科真菌茯苓Poriacocos(Schw.) Wolf的干燥菌核,具有利水渗湿、健脾、宁心等功效。茯苓性平,味甘淡,既能健脾,又能渗湿,常与人参、白术、甘草等配伍,治疗脾虚运化失常所致泄泻,如健脾丸、参苓白术散、四君子汤等健脾类方剂中均配有茯苓[1-3]。本课题组前期实验发现,茯苓提取物能抑制乙酰胆碱刺激的离体小肠痉挛性收缩,并且能有效缓解新斯的明诱导的小鼠胃肠功能亢进[4],但茯苓抑制小肠收缩的作用机制尚不明确,且未见国内外相关文献报道。
分子对接(molecular docking)是一种利用计算机模拟配体(蛋白质、DNA/RNA、小分子)与受体生物大分子相互结合,根据计算得出的物理化学参数来预测其结合模式及亲合力的方法[5]。利用分子对接技术可以从化合物库中筛选出具有一定生物活性的候选化合物,特别适合从中药复杂成分中筛选出可能的有效成分,进而从分子层面揭示中药的物质基础和作用机制[6]。
本实验采用离体小肠灌流技术,观察茯苓对小鼠离体小肠自发收缩以及不同工具药刺激下的小肠收缩的拮抗作用,并比较阻断M受体前后茯苓抑制小肠收缩作用的差异;利用分子对接技术将茯苓中33个化合物与M受体进行对接打分,筛选得到能够结合M受体的有效成分,进而从分子层面分析茯苓抑制小肠收缩的作用机制及主要活性成分,为茯苓健脾功效的研究与应用提供实验依据。
1 材料
1.1 试药
茯苓购自河北亚宝药业有限公司,产地云南,经辽宁中医药大学康廷国教授鉴定为多孔菌科真菌茯苓P.cocos(Schw.) Wolf的干燥菌核。
氯化乙酰胆碱(acetylcholine,Ach,上海阿拉丁生化科技股份有限公司,批号:A111014);硫酸阿托品(atropine,上海阿拉丁生化科技股份有限公司,批号:A109524);无水乙醇(分析纯,南京化学试剂有限公司);聚山梨酯-80(南京化学试剂有限公司);氯化钡(BaCl2)和氯化钙(CaCl2)均为分析纯。
1.2 仪器
RM6240B型多道生理信号采集系统(成都仪器厂);电热套(北京市永光明医疗仪器厂);501型恒温水浴锅(金坛市白塔新宝仪器厂);JJ224BC型分析天平(常熟市双杰测试仪器厂);DFT-50型中药粉碎机(温岭市林大机械有限公司)。
1.3 实验动物
SPF级雄性昆明种小鼠,体质量18~22 g,购自辽宁长生生物技术有限公司,合格证号:SCXK(辽)2015-0001。
2 方法
2.1 茯苓提取液的制备
茯苓饮片粉碎,过60目筛,称取80 g,加8倍量50%乙醇溶液,浸泡1 h,回流1 h,趁热抽滤,滤渣加6倍量50%乙醇溶液,回流1 h,趁热抽滤,合并2次滤液,60 ℃水浴浓缩,以2%的聚山梨酯-80水溶液配成2 g·mL-1的茯苓提取液(按生药量计算),-20 ℃冻存备用。
2.2 肠管标本的制备与收缩曲线记录
参照文献方法[7],小鼠禁食12 h(自由饮水),脱颈处死后迅速剪开腹腔,剪取回肠部位肠段,剥离肠系膜后按1 cm长度剪成数段,台氏液清洗内容物,两端穿线,置于盛有80 mL台氏液的麦氏浴槽中,一端连于接张力换能器,一端固定于L形通气钩,温度控制在(37±0.2)℃,持续通入空气。设置肠管预负荷1~1.5 g,待恢复自发收缩后,将收缩曲线波谷调至基线,记录自发收缩曲线5 min。
2.3 茯苓对小鼠离体小肠自发活动的影响
记录自发收缩曲线后,分别依次加入茯苓提取液20、20、40、80、160、320、640 μL,每个浓度作用5 min,记录收缩曲线,溶媒组加入等体积2%聚山梨酯-80,根据公式(1)计算平均肌张力抑制率,平均肌张力即为收缩波形曲线下面积[8]。
平均肌张力抑制率=(茯苓给药后的平均肌张力-
自发收缩时的平均肌张力)/
自发收缩时的平均肌张力×100%
(1)
2.4 茯苓对Ach、BaCl2和CaCl2刺激下的离体小肠收缩的影响
记录自发收缩曲线后,分别加入Ach(终浓度为7.5×10-7mol·L-1)、BaCl2(终浓度为1.56×10-4mol·L-1)、CaCl2(终浓度为1.39×10-5mol·L-1),作用10 min后,分别依次加入茯苓提取液20、20、40、80、160、320、640 μL,每个浓度作用5 min,记录收缩曲线,根据公式(2)计算平均肌张力抑制率。CaCl2组采用无钙台氏液,溶媒组加入等体积2% TW-80水溶液。
平均肌张力抑制率=(工具药刺激后的平均肌张力-
茯苓给药后的平均肌张力)/
工具药刺激后的平均肌张力×100%
(2)
2.5 M受体对茯苓抑制离体小肠收缩的影响
记录自发收缩曲线后,加入硫酸阿托品(终浓度为8.69×10-6mol·L-1)孵育5 min以阻断M受体,然后加入Ach(终浓度为7.5×10-7mol·L-1)使肠管收缩,作用10 min后,依次加入茯苓提取液20、20、40、80、160、320、640 μL,每个浓度作用5 min,记录肠管收缩曲线,计算平均肌张力抑制率,比较阻断M受体前后茯苓拮抗小肠收缩的作用差异。
2.6 茯苓所含化学成分与M受体的分子对接
查阅文献收集得到茯苓中33个化学成分,利用Chemdraw画出结构式,利用Chem3D将结构式转换成为三维结构,采用MM2力场对其进行结构优化,借助Autodock Tool将33个化合物加氢、加电荷后转成Autodock文件(pqbqt)格式,建立可供筛选的化合物数据库。从PDB数据库下载M受体的结构文件(ID为3UON)[9],利用Discovery Studio从蛋白晶体复合物中提取原配体分子,配体分子和受体大分子分别进行加极性氢、赋予电荷,采用Autodock Vina V1.1.2 软件将M受体与原配体重新对接,Grid box范围设定为28 nm×28 nm×28 nm,中心坐标为(X:8.73,Y:-0.02,Z:-3.06)。采用Autodock Vina V1.1.2对茯苓中33个化合物和M受体进行虚拟对接,对接过程中,只改变配体的构象,而保持蛋白构象不变,其余所有参数均采用默认值。另外选取4个M受体拮抗剂作为阳性对照进行对接打分,名称及结构见图1。

图1 M受体拮抗剂的名称及结构式
3 数据统计

4 结果
4.1 茯苓对小鼠离体小肠自发活动的影响
如图2A所示,离体肠管经过10~15 min后恢复自发收缩,呈现良好的节律性。累积加入溶媒持续作用60 min,仍保持良好的活性,肠管活力与实验开始时无明显减弱,说明本实验方法可靠。如图2B所示,肠管恢复自发性收缩后,累积加入0.5~32 g·L-1茯苓提取液,肠管收缩基线逐渐降低,收缩幅度逐渐减小,平均肌张力(即收缩曲线下面积)逐渐降低,并呈现剂量依赖性关系。当茯苓质量浓度增至32 g·L-1时,平均肌张力抑制率达到(181.92±47.75)%(见图3),说明茯苓能够显著抑制小肠自发性收缩。

注:A.溶媒组;B.茯苓组。图2 茯苓对离体小肠自发活动波形的影响

注:与2%聚山梨酯-80组比较,**P<0.01。图3 茯苓对离体小肠自发活动平均肌张力的影响
4.2 茯苓对Ach、BaCl2和CaCl2所致的离体小肠痉挛性收缩的影响
如图4所示,恢复自发收缩的离体肠管,在给予Ach、BaCl2或CaCl2后,小肠收缩波形基线明显抬高,给予0.5~32 g·L-1的茯苓提取液可明显降低波形基线,并剂量依赖性抑制小肠平均肌张力,与溶媒组比较差异有统计学意义(P<0.05,P<0.01,见图5),说明茯苓能够有效抑制Ach、BaCl2或CaCl2引起的小鼠离体小肠痉挛性收缩,而对Ach的抑制作用最强,所以后续实验选择M受体进行研究。

注:A.Ach组;B.BaCl2组;C.CaCl2组。图4 茯苓对Ach、BaCl2和CaCl2所致的离体小肠痉挛性收缩波形的影响

注:与2%聚山梨酯-80组比较,*P<0.05,**P<0.01。图5 茯苓对Ach、BaCl2和CaCl2所致的离体小肠痉挛性收缩平均肌张力的影响
4.3 M受体对茯苓抑制离体小肠收缩的影响
小鼠离体小肠恢复自发收缩后,给予Ach刺激,收缩基线立即抬高,小肠呈现痉挛性收缩;给予茯苓后,小肠的收缩幅度和收缩基线迅速降低。事先给予硫酸阿托品阻断M受体,茯苓对小肠收缩的抑制作用明显减弱(见图6),与未给予硫酸阿托品的Ach+茯苓组比较差异有统计学意义(P<0.05,见图7),说明茯苓抑制小肠收缩的作用与M受体有关。
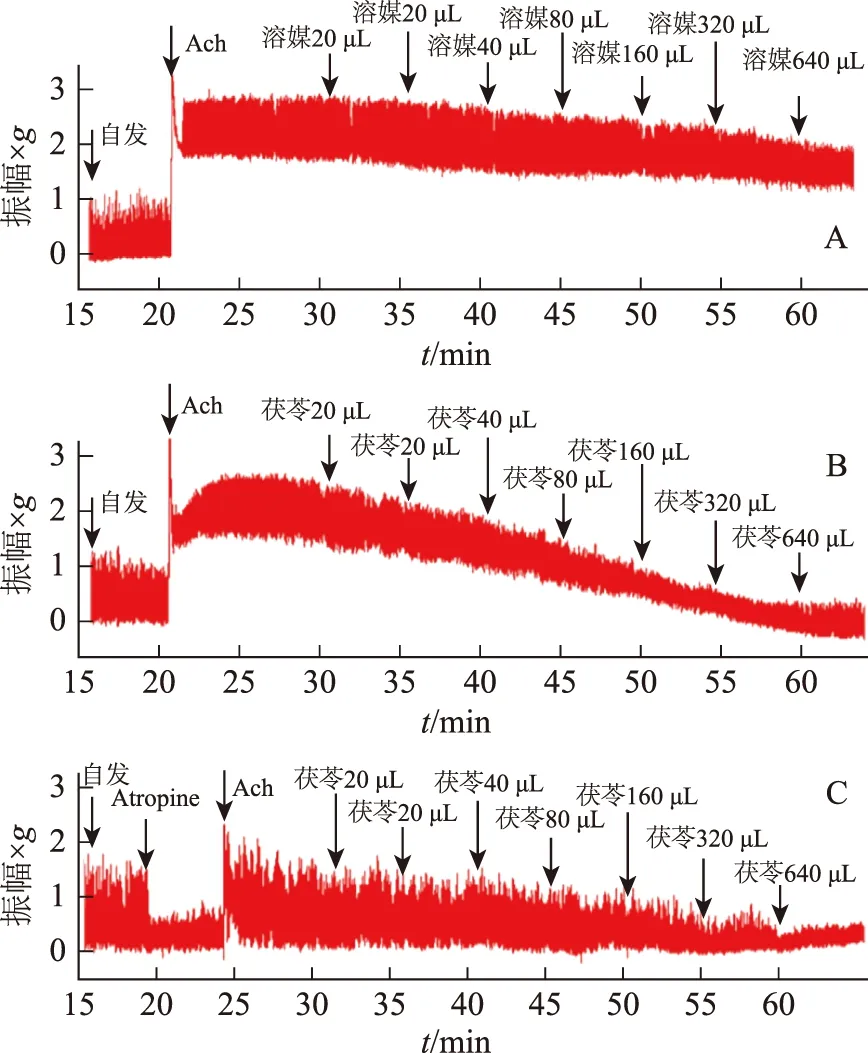
注:A.溶媒组;B.Ach+茯苓组;C.Atropine+Ach+茯苓组。图6 M受体对茯苓抑制离体小肠收缩波形的影响

注:与2%聚山梨酯-80组比较,*P<0.05,**P<0.01;与Ach+茯苓组比较,#P<0.05,##P<0.01。图7 M受体对茯苓抑制离体小肠平均肌张力的影响
4.4 茯苓成分与M受体对接的结果
茯苓中的齿孔酸、松苓酸A、3-氢化松苓酸、麦角甾醇等成分能够与M受体结合,结合能分别为-9.3、-9.2、-9.1、-8.6 kcal·mol-1,均低于M受体阻滞剂阿托品、异丙托溴铵、哌仑西平、托特罗定与M受体的结合能,说明茯苓中的活性成分能够与M受体结合,阻断M受体的生物学功能(见表1)。齿孔酸、松苓酸A和3-氢化松苓酸与M受体主要以

表1 茯苓33个成分及M受体阻滞剂与M受体的结合能力 kcal·mol-1

注:A、B.齿孔酸;C、D.松苓酸A;E、F.3-氢化松苓酸。图8 茯苓代表性成分与M受体相互作用
氢键和疏水作用结合(见图8)。齿孔酸与M受体的TYR83形成氢键,与TRP422、PHE181形成疏水作用(见图8A~B);松苓酸A与M受体的THR187形成氢键,与TRP422、TRP99、TYR426、TYR177、LEUA100形成疏水作用(见图8C~D);3-氢化松苓酸与M受体主要以氢键和疏水作用结合,与M受体的TYR83、ASN491、PHE181形成氢键,与TRP422、TRP426和TYR80形成疏水作用(见图8E~F)。
5 讨论
胃肠动力的异常能够引起许多胃肠疾病,如最常见的功能性胃肠道疾病——肠易激综合征(irritable bowel syndrome,IBS)。IBS患者的内脏灵敏性异常升高,脑肠肽水平也处于异常状态[10]。腹泻型IBS患者小肠转运速度过快,营养物质来不及吸收就被转运至结肠,导致结肠内产气增加;而便秘型IBS患者小肠运转速度过慢,水分被过度吸收而致便秘[11]。所以调节小肠蠕动功能,有可能是治疗腹泻型IBS的有效途径。
小肠的蠕动依赖于小肠平滑肌的电生理活动。动作电位直接引起平滑肌的收缩,慢波电位本身不引起收缩,但是可以引发动作电位,进而调控平滑肌的收缩节律和运动功能[12]。小肠平滑肌的运动受到神经和体液的调节,其中胆碱能神经元及相应受体对胃肠活动的调节作用至关重要。内源性神经递质Ach能够激活小肠平滑肌的M胆碱能受体,使胞内三磷酸肌醇(IP3)和二酰基甘油(DG)水平升高。IP3作为第二信使与IP3受体结合,使肌质网内贮存的高浓度Ca2+迅速释放到胞浆中,进而启动平滑肌兴奋-收缩偶联,引起平滑肌收缩。此外,胃肠平滑肌上还存在组胺和5-羟色胺等受体,以及钙离子通道、钾离子通道和钠离子通道,共同调节胃肠平滑肌的动力功能[13-16]。
茯苓是常见的健脾利湿中药,其健脾作用多与调节胃肠道蠕动功能有关。已有研究表明,茯苓水提液能够抑制正常小鼠胃排空和小肠推进[17],茯苓粗提物能够舒张家兔离体空肠和盲肠[18]。离体灌流结果显示,茯苓提取液能够浓度依赖性地抑制小鼠小肠自主收缩,并显著抑制Ach引起的小肠痉挛性收缩;当肠管经M受体阻滞剂阿托品孵育后,茯苓抑制小肠收缩的作用明显减弱,与无阿托品孵育组比较差异有统计学意义,说明茯苓需要通过与M受体相互作用才能有效地抑制小肠收缩。
为了进一步验证茯苓与M受体的相互作用,本研究采用分子对接技术对茯苓中含有的成分与M受体进行虚拟对接。分子对接结果显示,茯苓中含有大量能够与M受体结合的成分,其中齿孔酸、松苓酸A、3-氢化松苓酸、麦角甾醇、去氢齿孔酮酸与M受体结合的自由能均低于阿托品、异丙托溴铵等M受体阻滞剂,说明茯苓具备阻断M受体的物质基础,并且这些能够与M受体结合的化合物可能是茯苓抑制小肠收缩的主要活性成分。
此外,本研究发现,茯苓还能一定程度上抑制BaCl2和CaCl2引起的小肠痉挛性收缩。BaCl2是平滑肌内向整流钾通道阻滞剂,能够通过阻断内向整流钾通道引起细胞膜去极化,激活电压依赖性Ca2+通道,使胞外Ca2+进入胞内,导致平滑肌收缩[19-21]。茯苓能够抑制BaCl2、CaCl2引起的小肠痉挛性收缩,说明茯苓除了能阻断M受体外,还能通过调节钾通道和钙通道活性而发挥舒张小肠平滑肌的作用,这也契合了中药多成分、多靶点、多途径的作用特点。
综上,本研究结合小肠灌流技术和分子对接技术,考察了茯苓对离体小肠收缩抑制作用及其机制,发现茯苓能够通过抑制M受体,并调节钾通道和钙通道抑制小肠的自发收缩和痉挛性收缩;齿孔酸、松苓酸A、3-氢化松苓酸、麦角甾醇、去氢齿孔酮酸能够与M受体结合,可能是茯苓阻断M受体、抑制小肠收缩的主要活性成分。本研究为茯苓的健脾活性及治疗IBS等胃肠道疾病的应用提供了实验依据,关于茯苓调节钾通道和钙通道的具体机制还有待进一步研究。
